警惕检疫性有害生物马铃薯孢囊线虫(Globoderarostochiensis和G.pallida)入侵我国
2020-12-28彭焕刘慧江如
彭焕 刘慧 江如

摘要 马铃薯孢囊线虫包括马铃薯金线虫Globodera rostochiensis和马铃薯白线虫G.pallida,是马铃薯生产上危害最为严重的植物寄生线虫,一般造成30%的产量损失,在热带发病严重地区,产量损失高达80%~90%,甚至绝收。由于其危害严重性,包括我国在内的100多个国家将其列为重要检疫性有害生物。我国目前尚无马铃薯金线虫和白线虫的发生报道,但随着贸易全球化,马铃薯孢囊线虫传入我国的风险日趋增高。本文主要对马铃薯孢囊线虫的发生分布、危害症状、经济损失、生物学特性、传入我国的潜在风险和预防控制措施进行综述,旨在为防止马铃薯孢囊线虫入侵我国提供参考。
关键词 马铃薯孢囊线虫; 马铃薯金线虫; 马铃薯白线虫; 入侵; 预警
中图分类号: S 435.32
文献标识码: A
DOI: 10.16688/j.zwbh.2019523
Abstract The potato cyst nematodes (PCN), namely potato golden cyst nematode Globodera rostochiensis and potato pale cyst nematode G.pallida, are highly economically important pest of potato and cause yield losses up to 30%; in the tropics, yield losses are as high as 80%-90%, even no yields. These two cyst nematodes have been recognized as quarantine nematode pests in China and more than 100 other countries due to its devastating damage to potato crop. There are no distribution and occurrence of G.rostochiensis and G.pallida in China nowadays, however, the risk of introduction into China is increasing with the rapid development of trade globalization. In this paper, the occurrence, distribution, symptoms, yield loss, biological characteristics, potential introduction risks into China, prevention and control measures of potato cyst nematodes were reviewed, in order to provide a reference for the prevention and treatment of potato cyst nematodes.
Key words potato cyst nematode; Globodera rostochiensis; G.pallida; invasion; precaution
馬铃薯孢囊线虫包括马铃薯金线虫Globodera rostochiensis和马铃薯白线虫G.pallida,是马铃薯上最重要的植物寄生线虫[1]。由于其危害严重性和经济重要性,全球106个国家将其列为检疫性有害生物,该线虫也是我国重要的进境检疫性有害生物之一[2]。马铃薯孢囊线虫广泛分布于欧洲、亚洲、非洲、大洋洲和美洲大陆,在与我国毗邻国家如俄罗斯、日本、塔吉克斯坦等国均有发生和危害,随着国际贸易日趋频繁以及马铃薯引种和种质资源交换日益增加,传入我国的风险越来越大。近年来我国启动了马铃薯主粮化战略,种植面积快速增长,一旦马铃薯孢囊线虫入侵,将对我国马铃薯产业造成严重的威胁。本文综述了马铃薯孢囊线虫的发生分布、危害症状、经济损失、生物学特性、传入我国的潜在风险和预防控制措施,旨在为防止马铃薯孢囊线虫入侵我国提供参考。
1 分类地位和形态学特征
马铃薯金线虫G.rostochiensis和马铃薯白线虫G.pallida均属于线虫动物门Nematoda,侧尾腺口纲Secernentea,垫刃目Tylenchida,异皮线虫科Heteroderidae,球孢囊属Globodera[3]。
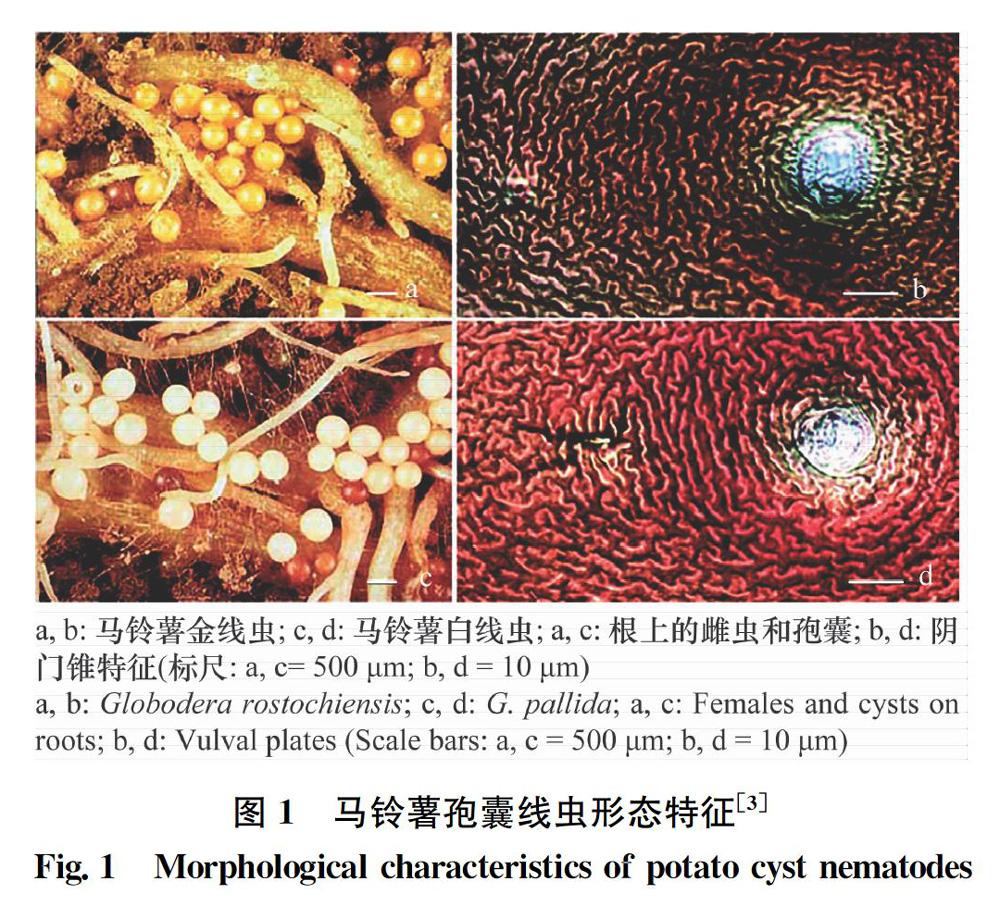
马铃薯金线虫和白线虫的形态学特征和形态测量值较相近(图1,表1)[3-5]。雌虫亚球型,颈凸出,虫体由白色变成黄色或棕色。孢囊表皮层具有Z字形的脊状纹。阴门锥为单环膜孔型,无阴门桥、下桥和其他内腺突,无泡状突。线虫卵存在于孢囊中,不形成卵块。2龄幼虫能自由活动,蠕虫状,虫体遍布脊环纹,且逐渐变细。
马铃薯金线虫和白线虫主要形态学差别是孢囊阴门锥中会阴-肛门间的脊数以及Granek比值(肛门到最近的阴门桥的长度除以会阴区直径),2龄幼虫口针长及口针基部球形状等(表1)。
2 危害损失和经济重要性
在马铃薯规模化种植地区,马铃薯孢囊线虫发病严重时,产量损失高达80%~90%,甚至绝收[6]。马铃薯产量损失与单位质量土壤中线虫卵量密切相关,当土壤中马铃薯金线虫卵的密度为20粒/g土时,马铃薯平均产量损失为2.75 t/hm2,最大损失为625 t/hm2 [7]。但马铃薯金线虫和白线虫的危害阈值会因土壤类型、地理位置和气候条件不同而存在较大差异。在英国,由于马铃薯孢囊线虫的危害,每年造马铃薯减产9%,经济损失超过5 000万英镑[8]。在意大利,马铃薯金线虫危害阈值为1.2~2.1粒卵/g土,马铃薯白线虫群体危害阈值为1.7粒卵/g土[9]。在荷兰,马铃薯品种对金线虫的耐性阈值为1.5粒卵/g土, 当每克土壤中马铃薯金线虫的卵为9、28、128粒时,造成马铃薯产量损失分别为20%、50%和90%[10]。据估计,全欧盟马铃薯孢囊线虫造成的年经济损失超过3亿欧元,造成马铃薯减产122%[11]。据Evens报道,在马铃薯金线虫广泛分布地区实施各种严格的防治措施后,仍能造成9%的产量损失[11]。在某种特定致病型且无抗病品种可以种植的地区,连年重茬种植马铃薯将减产90%,甚至绝产[12]。
全世界共有106个国家将马铃薯金线虫和白线虫列为检疫性有害生物,并对其实行严格的检疫和管理。在马铃薯金线虫和白线虫发生区域,尽管可以多种防控技术将其群体密度控制在经济阈值以下,马铃薯的产量虽然没有大幅度降低,但需要花费大量的长期监测、检疫和防控的费用[7]。研究还发现马铃薯金线虫能与大丽轮枝菌Verticillium dahliae复合侵染引起马铃薯早死病[13]。马铃薯白线虫与青枯病菌Ralstonia solanacearum及轮枝菌之间的相互作用,可造成复合侵染[6]。
3 起源和发生分布
目前认为,马铃薯孢囊线虫起源于南美洲的安第斯山脉,与马铃薯共同进化[14],并随着人类的活动,向欧洲及世界各地扩散蔓延[6]。马铃薯孢囊线虫最初传播到欧洲可能与19世纪50年代欧洲从拉丁美洲开始大量引进马铃薯育种材料有关。1881年,Kuhn在欧洲最先记录了马铃薯上的孢囊线虫种,传入欧洲30年后马铃薯孢囊线虫才繁殖到可以检测和危害的水平[15]。到20世纪初,欧洲许多国家发现了马铃薯孢囊线虫,随后马铃薯孢囊线虫传播到世界其他地区[15]。
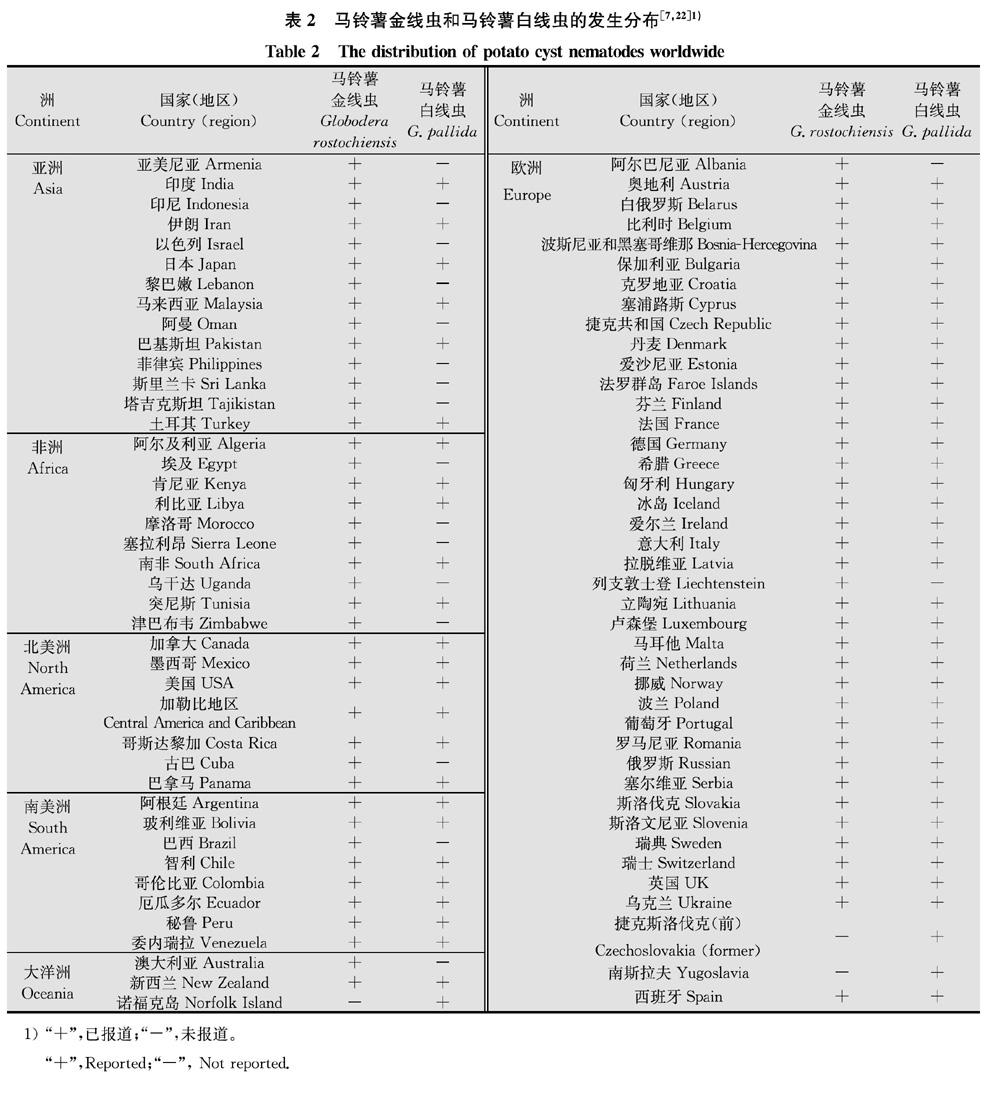
目前,马铃薯金线虫已在南美洲、北美洲、欧洲、亚洲、大洋洲和非洲等六大洲72个国家有发生和分布[16-23]。马铃薯白线虫分布虽然不如马铃薯金线虫广泛,但是在全世界五大洲热带和亚热带的冷凉地区以及温带的55个国家有发生和分布[8,17,19,21-22]。具体分布如表2所示。
4 生物学特性
4.1 危害症状
马铃薯孢囊线虫侵染寄主根系后,地上部无特殊识别症状。由于根系受害,植株对水分和营养物质的吸收能力降低,地上部表现矮化、黄化和缺水缺肥等症状[25],在干旱条件下叶片表现凋萎症状,中午时刻凋萎症状表现更加明显。田间病株分布不均匀,有发病中心,随着马铃薯的连续种植和农事操作,发病团连年扩大,最后全田发病。马铃薯孢囊线虫危害后常常使马铃薯植株早衰和侧根增生。在马铃薯开花期,受害植株的根部可见到金黄色或白色的球形雌虫,马铃薯金线虫雌虫成熟后逐渐呈金黄色,最后变成深褐色,而受害植株根部的马铃薯白线虫雌虫直至死亡仍为白色(图1),在马铃薯块茎上也能观察到白雌虫。马铃薯收获后,根系上的孢囊遗落到土壤中[3,15]。
4.2 寄主范围
马铃薯金线虫和白线虫能够侵染126种茄科植物[26-27],最主要的农作物寄主有马铃薯 Solanum tuberosum、番茄 Lycopersicon esculentum和茄子S.melongena等。此外多刺曼陀罗 Datura ferox、曼陀罗 D.stramonium、天仙子Hyoscyamus niger、秘鲁茄 L.glandulosum、毛番茄L.hirsutum、野生番茄L.peruvianum、醋栗番茄 L.pimpinellifolium、园艺番茄 L.pyriforme、烟草 Nicotiana acuminata、长叶酸浆 Physalis longifolia、毛酸浆P.philadelphica、美人襟属植物 Salpiglossis spp.、野生安第斯马铃薯S.acaule、红果龙葵S.villosum、少花龙葵S.americanum、森林茄S.armatum、澳洲茄 S.laciniatum、二倍體马铃薯S.brevidens、北美刺龙葵 S.carolinense、高龙葵S.chenopodioides、西瓜茄 S.citrullifolium 、科民茄 S.commersonii、S.demissum、欧白英S.dulcamara、银叶茄 S.elaeagnifolium、大茄 S.giganteum、黄马铃薯 S.goniocalyx、异叶茄S.heterophyllum、刺天茄 S.violaceum、黄龙葵 S.luteum、耳垂茄 S.mauritianum、龙葵S.nigrum、S.pinnatum、黄花刺茄(刺萼龙葵) S.rostratum等均为其有效寄主[28]。
4.3 生活史和侵染循环
在寄主根系分泌物的刺激下,马铃薯孢囊线虫2龄幼虫从孢囊内孵化后侵入到寄主根内,在根的中柱鞘、皮层或内皮层建立取食位点,开始寄生生活。2龄幼虫经2次蜕皮发育成4龄雌虫和4龄雄虫。4龄雌虫虫体呈腊肠状,经第4次蜕皮后变成雌成虫,雌成虫的后端不断膨大,撑破根表皮露出根外,仅头和颈部固着于根内。4龄雄虫卷曲在第3次蜕皮的角质层内,再经第4次蜕皮变成雄成虫,离开植株进入土内,雌成虫释放性信息素吸引雄成虫交配、受精产卵。马铃薯金线虫雌虫死亡后体壁变厚,变成黄色,最后变成金黄色。马铃薯白线虫雌虫在根表时呈白色,雌虫成熟后体壁变硬,变为褐色孢囊,从根表面脱落掉入土中,孢囊内的卵成为下一季作物的初侵染源(图2)。在一个马铃薯生长季节内,马铃薯孢囊线虫一般发生1代[20,29]。
马铃薯孢囊线虫的生活史与马铃薯的生活周期保持同步,适合马铃薯生长的环境条件也适合马铃薯金线虫和白线虫的生存和繁殖。根据土壤温度的不同,马铃薯孢囊线虫完成一个生活史需要6~10周[30]。在温度较低地区,一般每年发生1代,发生时期依赖于种植时期,当在4月上中旬和6月中旬种植时,2龄幼虫侵入90 d后才能完成1代,在潮湿的土壤中,气温低于25℃的地区可能发生2代[10]。
4.4 传播途径
人类活动是马铃薯孢囊线虫远距离传播和扩散的唯一途径。马铃薯孢囊线虫远距离传播到一个新的国家或地区最可能的途径是孢囊随粘附在马铃薯种薯、苗木、花卉鳞球茎或马铃薯块茎上的土壤传播[25]。在田间自然条件下,马铃薯金线虫和白线虫可通过水流、灌溉水和雨水传播,也可以通过农机具和农事操作等传播,大风也有传播作用。
4.5 发病的环境因素
有利于马铃薯生长发育的环境条件也有利于马铃薯金线虫和白线虫的繁殖和存活。冷凉环境有利于马铃薯白线虫的繁殖,而长时间的高温将限制其发育和繁殖[25], 马铃薯白线虫孵化的最适温度为16℃左右,16~25℃为侵入和发育的最适温度,土壤温度超过30℃,马铃薯白线虫不能正常发育。透气良好的砂土、粉砂土和泥炭土有利于白线虫移动、侵入和危害。马铃薯金线虫在土温达到10℃时开始活动,孵化的最适温度为20℃,低限为10℃,20~25℃为侵入和发育的最适温度,在此温度范围内,湿度达50%~70%时发生较重,30℃以上高温和干燥条件下发病较轻[6]。
昼长或光周期对马铃薯金线虫的生长、孵化和侵染性具有较明显的影响。生长在有稳定而充足的光照条件下的植物比光照不足的植物上马铃薯金线虫产生孢囊的数量多,短时间生长在完全黑暗中的植物上的孢囊滞育期将会延长。植物生长昼长为16 h时马铃薯金线虫产生孢囊的数目、孵化率和侵染率都比昼长12 h高[6,25]。
马铃薯孢囊线虫具有休眠和滞育的特性,在不良环境压力的影响下,即使作物生长期有活跃的孵化刺激物质存在,孵化也会停止,恶劣环境消除后,又开始迅速孵化出幼虫。在土壤类型和温度合适的条件下,孢囊内的卵可以存活长达28年[16,31]。在缺乏寄主的情况下,马铃薯孢囊线虫群体密度的年度衰减率与土壤温度密切相关,在冷凉土壤中的马铃薯金线虫群体的年衰退率为18%左右,在温度适中的土壤中为50%~80%,在高温土壤中可高达95%。在寄主植物根分泌物存在的情况下,可刺激60%~80%的卵孵化[25]。
5 传入我国的风险
近年来,全球经济一体化使得各国之间贸易往来越来越频繁,随着优良农作物品种资源的引进或交换,马铃薯金线虫和白线虫极有可能随马铃薯种质资源及其他植物资源的交换传入中国,尤其是从疫区国家或地区引进马铃薯种薯时,马铃薯金线虫和白线虫传入的可能性将会成倍地增加。20世纪80-90年代,在我国广州和深圳口岸曾从来自英国和北爱尔兰的马铃薯块茎上截获马铃薯金线虫[32-33],南京和青岛口岸曾从俄罗斯等国家的运输船只上2次截获马铃薯金线虫,1次截获马铃薯白线虫[34-35]。江苏江阴和常州口岸截获马铃薯金线虫和白线虫各1次[36]。李建中等[37]用生态位模型GARP和MaxEnt对马铃薯金线虫和白线虫在我国的适生区进行了分析,结果表明,云南、贵州、四川东北部、重庆东部,湖北西南部、湖南西北部、江苏东部、浙江东北部和福建沿海为马铃薯白线虫中高风险区,云南东北部、贵州、重庆、四川东部、湖南、湖北南部、山东南部、河南、安徽和江苏等省市为马铃薯金线虫中高风险区,以上研究结果表明,在我国马铃薯孢囊线虫传入和定殖的风险极大。
6 控制技术
6.1 严格实施检疫制度
马铃薯孢囊线虫是一种马铃薯生产上的毁灭性线虫病原物,目前我国尚未发现其分布和危害,因此必须采取严格的检疫措施,禁止从马铃薯金线虫和白线虫疫区引进种薯和其他可能携带孢囊线虫的植物材料,确因科研等特殊需要引进的, 应事先提出申请, 经国家质量监督检验检疫总局批准。从国外引进马铃薯应禁止带土,而且引进的马铃薯应在有严密的检疫设施条件下连续隔离种植两个生长季节方可放行,对进口马铃薯检疫检验除检查薯块外,还应检查薯块所携带的土壤,发现马铃薯金线虫和白线虫该批次马铃薯应立即退回或销毁处理。
6.2 轮作
利用马铃薯孢囊线虫寄主范围比较窄的特点,通过马铃薯与非茄科作物轮种,土壤线虫群体的数量将逐年下降。连续5~9年种植非寄主作物,可取得较好的防治效果。采用轮作、抗病品种以及杀线虫剂(熏蒸剂或内吸性颗粒剂)综合控制技术,可以快速地将线虫数量控制在经济阈值之下。试验证明,在英格兰地区,种植非寄主作物,土壤中线虫数量每年下降30%~50%,6~7年后,田间线虫数量即可降低到防控阈值之下[38]。另外,马铃薯早熟品种和罐头用马铃薯,生育期比较短,能限制线虫群体数量增加,缩短轮作期[39]。 在墨西哥,采用轮作和生物防治控制2年后,马铃薯金线虫密度下降89.2%[40]。
6.3 种植抗病品种
抗病品种能抑制马铃薯孢囊线虫的发育,研究发现,抗病品种的种植可以减少马铃薯金线虫和白线虫群体数量约80%~85%,但在土壤中金线虫和白线虫群体数量极高时,抗病品种也会因受到数量极多的幼虫侵入,产量受到一定程度的损失[26]。在加拿大魁北克地区种植1年携带H1抗性基因的马铃薯品种,土壤中线虫种群减少了62%~95%。连续种植抗病品种3年后,土壤中线虫种群减少超过95%,而种植玉米等非寄主作物,土壤线虫每年减少约30%[41]。在过去的20年里,有超过3 000份的马铃薯品种抗孢囊线虫的鉴定已经完成,其中部分抗病品种对某些特定致病型的马铃薯孢囊线虫减退率达50%以上。在英国,推广种植抗马铃薯金线虫但不抗白线虫的马铃薯品种‘Maris Piper,马铃薯金线虫的种群数量显著下降,而白线虫的数量显著上升,从而导致英国马铃薯孢囊线虫优势种群由马铃薯金线虫变为马铃薯白线虫[8,22]。
利用主效基因和多基因抗性培育出了抗金线虫的马铃薯品种,但多数是单抗金线虫,在英格兰已育成抗金线虫Ro1致病型和Ro4致病型的‘Maris Piper‘Maris Anchor‘Pentland Jauelin和‘Pentland等7个抗性品种[42]。马铃薯的双倍体种S.vernei以及三倍体S.tuberosum ssp. andigena已被用作培育抗马铃薯孢囊线虫的抗源材料。目前全世界培育出的抗马铃薯孢囊线虫的品种超过135个,但这些品种大多数只对金线虫有抗性[15,38,43]。目前对马铃薯白线虫抗性最好的品种是来自秘鲁的‘Maria Huanca, 此品种对广泛分布于南非和欧洲的白线虫的两个小种有高度抗性[43]。
6.4 化学防治
土壤熏蒸杀线虫剂和非熏蒸杀线虫剂都适用于马铃薯孢囊线虫的防治。当采取检疫措施需要立即降低土壤内金线虫密度时,土壤熏蒸剂如威百亩、棉隆、D-D混剂等常用来防治马铃薯金线虫并在欧洲和美国等地获得成功。在美国,应用1,3-二氯丙烯处理大量的马铃薯仍然被当做一项检疫处理措施,大劑量(420 L/hm2)处理对马铃薯金线虫的控制效果高达99%[44]。 在荷兰,广泛使用二氯丙烯和威百亩防治马铃薯金线虫[17]。在英国,2种熏蒸剂棉隆和威百亩允许在有限的地区使用[45-46]。棉隆和威百亩等异硫氰酸甲酯类农药对马铃薯孢囊线虫的控制效果达到80%以上,但对土壤温湿度有一定要求,在土壤温度高于15℃,土壤湿度65%左右的条件下才能发挥作用[45,47]。在单季马铃薯种植区,使用噻唑膦、丙线磷和草肟威都具有良好的防控效果[45],尽管噻唑膦等颗粒剂对马铃薯孢囊线虫的控制效果低于熏蒸剂,但是由于价格较低且使用方便,更容易被广泛使用[48]。另外氟噻虫砜等新杀线虫成分对马铃薯孢囊线虫也具有良好的控制效果,但防治效果稍差于噻唑膦[49]。
6.5 生物防治
在英國,淡紫拟青霉Paecilomyces lilacinus和厚垣轮枝孢Verticillium chlamydosporium被用于马铃薯孢囊线虫的防控[50]。研究发现,厚垣轮枝孢在温室和田间对马铃薯孢囊线虫的控制效果分别为70%和51%[48,51]。采用淡紫紫孢菌Purpureocillium lilacinum处理种薯后,对马铃薯孢囊线虫的控制效果达48%~70%[52]。哈茨木霉Trichoderma harzianum对于马铃薯孢囊线虫具有良好的控制效果[50]。 穿刺巴氏杆菌Pasteuria penetrans对于马铃薯孢囊线虫也具有良好的防治效果[53]。
6.6 物理防治和生物熏蒸
高温闷棚可用来杀死土壤内的马铃薯孢囊线虫,马铃薯收获后,夏季在病土上覆盖无色或黑色塑料薄膜,并灌水至土湿润,40 d后取走覆盖物,防治效果分别达到77%~96%和66%~67%[16,54]。研究发现,在发病地块种植芥菜和萝卜作为绿肥,翻耕至土壤中进行生物熏蒸能够有效控制土壤中马铃薯孢囊线虫的数量[55]。
6.7 种植诱捕植物
马铃薯孢囊线虫一旦成功侵入寄主,将在根上固定取食,无法自由移动。利用其专性寄生的特点,在发病地块继续种植马铃薯作为诱捕植物刺激马铃薯孢囊线虫孵化,种植4~5周后,最长不能超过6周,喷洒灭生性除草剂杀灭寄主马铃薯植株,导致线虫将无法继续发育而死亡[56]。在法国,种植1季诱捕植物后,土壤中马铃薯白线虫数量下降了80%,种植2季诱捕植物同时施用化学杀线虫剂丙线磷,土壤中线虫数量下降98.5%[57]。选用拟刺茄S.sisymbriifolium作为诱集寄主连续种植3年后,土壤中线虫密度降低了80%,种植马铃薯S.tuberosum, 龙葵S.nigrum, 欧白英S.dulcamara和曼陀罗D.stramonium等诱捕植物也能获得类似的控制效果[58-59]。
6.8 种植拮抗植物
拮抗植物的根系最初会受到马铃薯孢囊线虫2龄幼虫的侵染,但植物中的某些因子和物质会阻止其发育为成虫,在巴西,大托叶猪屎豆Crotalaria spectabilis、 菽麻C.juncea、 万寿菊Tagetes erecta、 印加孔雀草T.minuta和Estizolobium spp.等拮抗植物被用于马铃薯根结线虫和孢囊线虫的防控[60]。
6.9 综合防控技术
由于马铃薯孢囊线虫是一种极难防治的土传有害生物,单一的控制技术很难达到理想的防治效果,因此必须通过抗性品种、轮作、诱集寄主等农艺措施和化学或生物杀线虫农药施用相结合,根据土壤中线虫基数和致病型的种类,选择合适的控制技术,才能有效地控制马铃薯孢囊线虫的危害。在美国通过严格的检疫,在控制区域内严禁种植马铃薯等寄主作物和化学药剂处理等措施,到2018年,马铃薯金线虫疫区面积缩减了85.4%,马铃薯孢囊线虫的危害得到有效的控制[61]。
7 展望
马铃薯孢囊线虫是马铃薯上最具有危险性和经济重要性的线虫种类,一旦传入,将造成严重的产量和经济损失。我国尚无马铃薯孢囊线虫的分布,因此必须加强检疫,防止该线虫从疫区传入我国。随着国际贸易的不断增长,该线虫传入我国的风险极大,因此我们必须提前开展相关的研究,做好技术储备,从而保证我国马铃薯生产的安全。
参考文献
[1] EPPO. PM 7/40(4) Globodera rostochiensis and Globodera pallida [J]. EPPO Bulletin, 2017, 47: 174-197.
[2] 中华人民共和国进境植物检疫性有害生物名录,中华人民共和国农业部第862号公告[EB/OL].(2007-05-29)http:∥www.moa.gov.cn/ztzl/gjzwbhgy/tjxx/201205/t20120506_2617764.htm.
[3] SUBBOTIN S A, MUNDO-OCAMPO M, BALDWIN J G. Systematics of cyst nematodes (Nematoda: Heteroderinae) [M]∥HUNT D J, PERRY R N, eds. Nematology monographs and perspectives, Volume 8A. Leiden, The Netherlands: Brill, 2010: 351.
[4] STONE A R. Heterodera rostochiensis. C.I.H.Descriptions of plant-parasitic nematodes. Set. 2. No.16[M]. Wallingford,UK: CAB international, 1973.
[5] COLIN C F, THOMAS O P. Potato cyst nematode diagnostics: morphology, differential host and biochemical techniques [M]∥MARKS R J, BRODIE B B. Potato cyst nematodes, biology, distribution and control. Wallingford, UK: CAB international, 1998: 91-114.
[6] JATALA P, BRIDGE J. Nematode parasites of root and tuber crops [M]∥LUC M R, SIKORA A, BRIDGE J. Plant parasitic nematodes in Subtropical and Tropical Agriculture. Wallingford, UK: CAB international, 1990: 137-180.
[7] BROWN E B, SYKES G B. Assessment of the losses caused to potato by the potato cyst nematode, Globodera rostochiensis and G.pallida [J]. Annals of Applied Biology, 1983, 103: 271-276.
[8] CABI. Datasheet report for Globodera rostochiensis (yellow potato cyst nematode) [EB/OL].(2019-09-25)https:∥www.cabi.org/isc/datasheet/27034.
[9] GRECO N, DI VITO M, BRANDONISIO A, et al. The effect of Globodera pallida and G.rostochiensis on potato yield [J]. Nematologica, 1982, 28(4): 379-386.
[10]MOXNES J F, HAUSKEN K. The population dynamics of potato cyst nematodes [J]. Ecological Modeling, 2007, 207(2-4): 339-348.
[11]EVANS K, BRODIE B B. The origin and distribution of the golden nematode and its potential in the U.S.A [J]. American Potato Journal, 1980, 57(3): 79-89.
[12]PHILIS I. Assessment of potato yield loss caused by the potato cyst nematode Globodera rostochiensis [J]. Nematologia Mediterranea, 1991, 19(2): 221-225.
[13]HARRISON J A C. Association between the potato cyst nematode, Heterodera rostochiensis Woll. and Verticillium dahliae Kleb in the early-dying disease of potatoes [J]. Annals of Applied Biology, 1971, 67(2): 185-193.
[14]STONE A R. Co-evolution of nematodes and plants [J]. Symbolae Botanicae Uppsala, 1979, 22(4): 46-61.
[15]TURNER S J, EVANS K. The origins, global distribution and biology of potato cyst nematodes (Globodera rostochiensis (Well.) and Globodera pallida Stone) [M]∥MARKS R J, BRODIE B B. Potato cyst nematodes, biology, distribution and control. Wallingford, UK: CAB international, 1998: 7-26.
[16]BALDWIN J G, MUNDOOCAMPO M. Heteroderidae, cyst and non-cyst forming nematodes [M]∥NICKLE W R, eds. Manual of agricultural nematology. New York, US: Marcel Dekker, 1991: 275-362.
[17]BRODIE B B,EVANS K, FRANCO J. Nematode parasites of potatoes [M]∥EVANS R, TRUDGILL D L, WEBSTER J M, eds. Plant parasitic nematodes in temperate agriculture. Wallingford,UK: CAB international, 1993: 87-132.
[18]EVANS K, STONE A R. A review of the distribution and biology of the potato cyst nematodes Globodera rostochiensis and G.pallida [J]. Proceedings of the National Academy of Sciences, 1977, 23(2): 178-189.
[19]EVANS K, FRANCO J, DE SCURRAH M M. Distribution of species of potato cyst nematodes in South America [J]. Nematologica, 1975, 21: 273-280.
[20]MORRIS R F. Distribution and biology of the golden nematode, Heterodera rostochiensis in new found land [J]. Nematologica, 1971, 17: 370-376.
[21]PHILLIPS J. Species of potato cyst nematodes from the Xylophagou area in Cyprus [J]. Nematologia Mediterranea, 1981, 12(2): 247-252.
[22]CABI. Datasheet report for Globodera pallida (yellow potato cyst nematode) [EB/OL]. (2019-09-25)https:∥www.cabi.org/isc/datasheet/27033.
[23]彭德良. 馬铃薯金线虫[M]∥中华人民共和国动植物检疫局农业部植物检疫实验所. 中国进境有害生物选编.北京:农业出版社, 1997: 49-53.
[24]SWARUP G. Cyst-forming nematodes of India and their management [M]∥MAQBOOL M A, eds. Advances in plant nematology, Karachi, Pakistan: National Nematological Research Centre, University of Karachi, 1988:181-201.
[25]JONES F G W. The control of the potato cyst nematode [J]. Journal of the Royal Society of Arts, 1970, 118(5164): 179-199.
[26]SULLIVAN M J, INSERRA R N, FRANCO J, et al. Potato cyst nematodes: Plant host status and their regulatory impact [J]. Nematropica, 2007, 37(2): 193-201.
[27]SENASICA. Nematodo dorado de la papa-Globodera rostochiensis-Mexico-Segarpa [J]. Ficha Técnica, 2013, 19: 1-24.
[28]EFSA. Scientific opinion on the risks to plant health posed by European versus non-European populations of the potato cyst nematodes Globodera pallida and Globodera rostochiensis [J/OL]. EFSA, 2012, 10(4): 2644. DOI:10.2903/j.efsa.2012.1644.
[29]FRANCO J. Effect of temperature on hatching and multiplication of potato cyst nematodes [J]. Nematologica, 1979, 25: 237-244.
[30]CHITWOOD B G, BUHRER E M. Summary of soil fumigant tests made against the golden nematode of potatoes (Heterodera rostochiensis,Wollenweber), 1942-1944 [J]. Proceedings of the Helminthological Society of Washington, 1945, 12: 39-41.
[31]GRAINGER J. Factors affecting the control of eelworm diseases [J]. Nematologica, 1964, 10: 5-20.
[32]钟国强, 郭权, 黎锦荣, 等. 广州口岸进境检疫截获的几种重要检疫性线虫[J].云南农业大学学报,1999, 14(S1): 42-46.
[33]张治宇, 刘爱华, 厉艳, 等. 青岛口岸截获的马铃薯白线虫[J]. 植物检疫,2007, 21(2): 127-128.
[34]王达龙, 沈培垠, 汪家庆. 江苏局在运输工具检疫中首次截获马铃薯金线虫[J]. 中国检验检疫, 2000(5): 37.
[35]沈培垠,朱宏斌,安榆林,等. 船检截获的检疫性线虫及传入我国的危险性[J]. 植物检疫, 2001, 15(1): 53-55.
[36]李浩, 郑安明, 毛福群. 马铃薯孢囊线虫的检疫及预防对策[J]. 检验检疫科学, 2001, 11(1): 16-17.
[37]李建中. 六种潜在外来入侵线虫在中国的适生性风险分析[D]. 长春:吉林农业大学, 2008.
[38]TRUDGILL D L, EVANS K, PHILIPS M S. Potato cyst nematodes: damage mechanisms and tolerance in the potato [M]∥MARKS R J, BRODIE B B, eds. Potato cyst nematodes, biology, distribution and control. Wollingford, UK: CAB international, 1998: 117-133.
[39]WINSLOW R D, WILLIS R J. Nematode diseases of potatoes. II. Potato cyst nematode, Heterodera rostochiensis [M]∥WEBSTER J, eds. Economic Nematology, New York, Academic Press, 1972: 18-34.
[40]LPEZ-LIMA D, SNCHEZ-NAVA P, CARRIN G, et al. 89% reduction of a potato cyst nematode population using biological control and rotation [J]. Agronomy for Sustainable Development, 2013, 33: 425-431.
[41]BLAIR G, DAUPHINAIS N, MIMEE B. Evaluation of cultural methods for the management of the golden nematode (Globodera rostochiensis) in Quebec, Canada [J]. Canadian Journal of Plant Pathology, 2016, 38(2): 209-217.
[42]CASTELLI L, BRYAN G, BLOK V C, et al. Investigation of resistance specificity amongst fifteen wild Solanum species to a range of Globodera pallida and G.rostochiensis populations [J]. Nematology, 2005, 7(5): 689-699.
[43]FRANCO J, GONZALEZ A. A new race of Globodera pallida attacking potatoes in Peru [J]. Revue de Nematologie, 1990, 13(2): 181-184.
[44]BRODIE B B, MAI W F. Control of the golden nematodes in the United States [J]. Annual Review of Phytopathology, 1989, 27: 443-461.
[45]HAYDOCK P P J, WOODS S R, GROVE I G, et al. Chemical control of nematodes [M]∥PERRY R N, MOENS M, eds. Plant nematology. 2nd edition. Wallingford, UK: CAB international, 2013: 259-279.
[46]LAINSBURY M A. The UK pesticide guide 2016 [M]. Wallingford: UK CAB International, 2016.
[47]HAGUE N G M, GOWEN S R. Chemical control of nematodes [M]∥BROWN R H, KERRY B R,eds. Principles and practice of nematode control in crops. Sydney: Academic Press, 1987: 131-178.
[48]TOBIN J, HAYDOCK P, HARE M, et al. Effect of the fungus Pochonia chlamydosporia and fosthiazate on the multiplication rate of potato cyst nematodes (Globodera pallida and G.rostochiensis) in potato crops grown under UK field conditions [J]. Biological Control, 2008, 46(2): 194-201.
[49]NORSHIE P M, GROVE I G, BACK M A. Field evaluation of the nematicide fluensulfone for control of the potato cyst nematode Globodera pallida [J]. Pest Management Science, 2016, 72(10): 2001-2007.
[50]DAVIDE R G, ZORILLA R A. Evaluation of a fungus Paecilomyces lilacinus (Thom.) Sampson for the biological control of the potato cyst nematode Globodera rostochiensis Woll. as compared with some nematicides [J]. Phillipines Agriculturalist 1983, 66: 397-404.
[51]CRUMP D H. Biological control of potato and beet cyst nematodes [J]. Aspects of Applied Biology, 1998, 52: 383-386.
[52]DANDURAND L M, KNUDSEN G R. Effect of the trap crop Solanum siymbriifolium and two biocontrol fungi on reproduction of the potato cyst nematode, Globodera pallida [J]. Annals of Applied Biology, 2016, 169(2): 180-189.
[53]KARSSEN G, WESEMAEL W, MOENS M. Root-knot nematodes [M]∥PERRY R N, MOENS M,eds. Plant nematology. 2nd edition. Boston: CAB international, 2013:73-108.
[54]VOVLAS N, GRAMMATIKAKI G. Occurrence of potato cyst nematodes (Globodera rostochiensis and G.pallida) on Crete and suggestions for control [J]. FAO Plant Protection Bulletin, 1989, 3(2): 92-95.
[55]NGALA B M, HAYDOCK P P, WOODS S et al. Biofumigation with Brassica juncea, Raphanus sativus and Eruca sativa for the management of field populations of the potato cyst nematode Globodera pallida [J]. Pest Management Science, 2015, 71(5): 759-769.
[56]HALFORD P D, RUSSEL M D, EVAN K. Use of resistant and susceptible potato cultivars in the trap cropping of potato cyst nematodes G.pallida and G.rostochiensis [J]. Annals of Applied Biology, 1999, 134: 321-327.
[57]WHITEHEAD A G, TURNER S J. Management and regulatory control strategies for potato cyst nematodes (G.rostochiensis and G.pallida) [M]∥MARKS R J, BRODIE B B,eds. Potato cyst nematodes: biology distribution and control. Wallingford, UK: CAB international, 1998: 135-152.
[58]TIMMERMANS B G H, VOS J, STOMPH T J, et al. Field performance of Solanum sisymbriifolium, a trap crop for potato cyst nematodes. II. Root characteristics [J]. Annals of Applied Biology, 2007,150: 99-106.
[59]SPARKES J. Potential trap crops for the control of potato cyst nematodes (PCN) [J]. Agriculture and Horticulture Development Board, 2013, 1: 1-19.
[60]ROBERT M. Alternative practices for managing plant-parasitic nematodes [J]. American Journal of Alternative Agriculture, 1998, 13(3): 98-104.
[61]DANDURAND L M, ZASADA I A, WANG Xiaohong, et al. Current status of potato cyst nematodes in north America [J]. Annual Review of Phytopathology, 2019, 57: 117-133.
(責任编辑:田 喆)
