戊二醛/壳聚糖交联复合材料的制备及其对3种染料的吸附性能及其机理
2020-12-28狄婧刘海霞郭金鑫姜永强赵国虎1
狄婧,刘海霞,郭金鑫,姜永强,赵国虎1,
(1.兰州交通大学化学与生物工程学院,甘肃 兰州 730070;2.兰州城市学院化学化工学院,甘肃 兰州 730070;3.兰州城市学院化学化工学院城市环境污染控制甘肃省高校省级重点实验室,甘肃 兰州 730070)
染料是一种被大量使用的化学产品,广泛应用于橡胶、农药、塑料、纺织品、化妆品、清漆、印染和食品工业.近年来,随着我国工业化进程的快速发展,工业废水的排放量也逐年上升.染料废水排放到自然水体中,其携带大量的显色基团和极性基团,对生物体具有潜在的致突变和致癌作用[1],危害水生生物群落和人类[2],因此,在其排入水体之前必须进行废水处理.目前,染料废水处理方法有生物法[3]、电化学法[4]、化学氧化法[5]、絮凝法[6]和膜分析法[7]等,这些方法中,吸附法由于具有简单快捷、成本低廉且不易造成二次环境污染等优点,在对多种废水处理方法中具有广泛的应用前景[8-9].
壳聚糖(chitosan,CS)是自然界生物合成量仅次于纤维素的第二大天然高分子化合物,是一种可带正电的碱性多糖[10],分子链上有大量的氨基和羟基,可与多种类型的染料分子通过氢键、范德华力、静电作用相互结合,达到吸附染料分子的作用.但是壳聚糖特有的晶态结构以及其在酸性或碱性溶液中存在降解缓慢的缺点[11],限制了壳聚糖的应用.通过化学改性,在壳聚糖分子链上引入新的活性基团,不仅能改善壳聚糖的溶解性,还增加了壳聚糖分子上吸附位点的数量,可提高吸附效率,拓宽壳聚糖的应用范围[12].交联剂戊二醛与壳聚糖通过席夫碱反应进行交联,可以解决壳聚糖在酸性溶液中易溶胀和机械性能低的缺点.本文制备了戊二醛/壳聚糖交联复合材料,并将其用于吸附模拟染料废水中的三种染料,为废水中染料去除的方法研究提供一定的参考.
1 材料与方法
1.1 试验材料
原料:壳聚糖(脱乙酰度≥95%),戊二醛(C5H8O2),乙酸(CH3COOH),甲基橙(C14H14-N3SO3Na),碱性品红(C2-OH2OClN3),酸性品红(C2OH17N3Na2O9S3),乙醇(CH3CH2OH),试剂均为分析纯,试验使用去离子水.
仪器:紫外分光光度计(UV-5500,上海元析仪器有限公司);恒温振荡器(SHZ-82A,常州国华电器有限公司);集热式加热搅拌器(DF-101S,常州普天仪器制造有限公司);电子分析天平(BSA124S,赛多利斯科学仪器有限公司);傅里叶变换红外光谱仪(NICOLET 5700,赛多利斯科学仪器有限公司);扫描电子显微镜(EVO18,日本电子光学公司);优普纯水/超纯水制造系统(VPHW-IV-907,四川优普超纯科技有限公司);同步热分析仪(TGA/DSC1,瑞士梅特勒托利多).
1.2 试验方法
1.2.1 G/CS制备 称取3.75 g壳聚糖加于250 mL 2%乙酸溶液中,搅拌溶解后静置24 h,再逐滴加入0.25 mL戊二醛,在303 K水浴中和400 r/min转速下搅拌30 min,制得G/CS溶液.量取15 mL溶液均匀浇铸在培养皿(内径为10 cm)中并在323 K的烘箱中干燥24 h,用0.1 mol/L的NaOH溶液浸泡4 h至复合材料与培养皿分离,并用超纯水洗涤复合材料至中性,干燥备用.
1.2.2 吸附试验 称取一定质量的G/CS,投加至含有一定浓度的AF/FB/MO溶液的10 mL的比色管中,并用0.1 mol/L的NaOH或HCl溶液调节溶液的pH至预定值,置于设置好温度的恒温振荡器中以一定速率振荡,吸附结束后,测定吸附液的吸光度值,计算去除率.
1.2.3 单因素试验 分别改变G/CS的质量、AF/FB/MO溶液的浓度、pH值、温度以及振荡速率,在吸附后测定吸附液的吸光度值,得到影响G/CS吸附因素及最佳吸附条件.
1.2.4 吸附-脱附循环再生试验 在盛装AF/FB/MO模拟染料废水的10 mL比色管中加入G/CS,在最优条件下吸附后,测定吸附液吸光度值,计算去除率W%,再在室温下的0.1 mol/LNaOH溶液中超声40 min,并用超纯水洗涤至中性,333 K下烘干,得到再生的G/CS.用再生G/CS重复吸附试验,循环5次,探究复合吸附材料的再生吸附性能.
1.2.5 正交试验 参考张喜峰[13]的方法,根据单因素对戊二醛/壳聚糖复合材料去除率的影响,分别在吸附时间10、40、40 min和震荡速率120、120、140 r/min的条件下,选择初始浓度(A)、G/CS用量(B)、pH(C)、吸附温度(D)为因素(表1),按L9(34)正交试验安排方案.

表1 正交试验因素与水平
1.3 材料表征
采用扫描电镜观察样品形貌;采用傅里叶变换红外光谱仪测定样品的官能团种类;采用电镜能谱分析测定不同材料C、N、O元素的含量;采用同步热分析仪测量物质在热反应时的特征温度及吸收或放出热量.
1.4 分析方法
使用紫外分光光度计,分别于545 nm/540 nm/463 nm处测量AF/FB/MO的吸光度[14-16],绘制标准曲线,求得回归方程.
酸性品红(AF):
y=0.037 17x-0.092 33R2=0.999 2
碱性品红(FB):
y=0.267 21x-0.079 56R2=0.999 3
甲基橙(MO):
y=0.084 20x-0.008 02R2=0.999 1
用式(4)计算其对染料废水的去除率[3]:
W(%)=(c0-ce)/c0×100%
式中:W为染料去除率(%);c0为溶液中染料初始浓度(mg/L);ce为吸附后溶液中染料浓度(mg/L).
1.5 吸附机理模型
1.5.1 吸附动力学 准一级动力学公式:
log(qe-qt)=logqe-0.434k1t
准二级动力学公式:.
t/qt=1/k2qe2+t/qe
其中qt和qe分别代表在t时间和吸附平衡时的吸附量(mg/g);k1为准一级吸附速率常数(min-1);k2为准二级吸附速率常数(g/mg/min).
粒子内扩散动力学模型方程式:
qt=kidt0.5+Ci
液膜扩散模型方程式:
-ln(1-F)=kadt+B
kid为粒子内扩散速率常数(mg·g·min-1/2);Ci为涉及到厚度、边界层的常数;kad为液膜扩散速率(min-1);t为吸附时间(min);F为吸附剂的吸附饱和度.
1.5.2 吸附热力学 计算吸附热力学参数吉布斯自由能ΔG、焓变ΔH以及熵变ΔS:
Kd=qe/ce
lnKd=ΔS/R-ΔH/RT
ΔG=-RTlnKd
式中:Kd为吸附分配系数(L/mg);R为气体摩尔常数(J/mol·K);T为温度(K);ΔS为熵变(J/mol·K);ΔG为吉布斯自由能(kJ/mol);ΔH为焓变(kJ/mol).
1.5.3 吸附等温模型 Langmuir吸附等温式和Freundlich吸附等温式分别如下式:
ce/qe=1/KLQ+ce/Q
ln(qe)=ln(Kf)+1/n*ln(ce)
其中KL为与吸附能有关的常数(L/mg);Q为单分子层吸附的饱和吸附量(mg/g);Kf为与吸附容量有关的常数;1/n是吸附强度的量度,反映吸附剂对吸附质束缚力的强弱.
2 结果与分析
2.1 戊二醛/壳聚糖复合材料的表征
2.1.1 SEM分析 扫描电子显微镜(SEM)是研究材料表面形貌最有效的方法之一.SEM图显示,G/CS(图1-B)主要呈现凹凸不平的片状层叠结构和颗粒堆积结构,这样的粗糙表面有利于吸附吸附质.
在EDS图中,交联剂戊二醛加入后,图1-B元素能量值增加,证明了戊二醛与壳聚糖成功交联.

A:CS膜;B:G/CS.图1 CS和G/CS的电镜图及EDS图Figure 1 Electron microscopy and EDX diagram of CS and G/CS films
2.1.2 FT-IR分析 用傅立叶变换红外光谱仪(FT-IR)对制备的CS膜和G/CS进行分析,图中3 416 cm-1处是CS膜的N-H键和O-H键伸缩振动的特征吸收峰,1 613 cm-1是-NH2的变形振动峰,1080 cm-1属于醚键C-O-C的振动范围,892 cm-1是-NH2的面内弯曲振动峰[17].通过对比CS和G/CS的红外谱图可知,CS膜基本骨架不变,重要的是在1669 cm-1出现C=N伸缩振动峰,证明戊二醛成功交联到了壳聚糖分子上.

A:CS膜;B:G/CS.图2 G/CS和CS的红外谱图Figure 2 Infrared spectrum comparison of G/CS membrane and CS membrane
2.1.3 热分析 为了研究G/CS的热稳定性,在N2氛围下进行了热重分析,如图3所示,G/CS主要有少量水汽化和有机物分解2个阶段组成.温度较低的部分(通常在100 ℃以下)曲线的第一次失重变化可能是因为脱去混合物中水分所致;200~460 ℃出现第2次失重,失重约为39.9%,可能是发生了N-O、C-N或C-O的断裂;然后超过450 ℃后,复合材料发生碳化反应,热降解在700 ℃结束.G/CS在氮气中热降解DTA曲线,在110~200 ℃,260~450 ℃,分别有2个放热峰,可能是热分解过程中糖苷键断裂,吡喃开环,同时伴随着氨基和羟基的脱去[18].综上可知,G/CS抗热氧性能强,热稳定性好.

图3 G/CS的TG和DTA曲线Figure 3 TG and DTA curves of G/CS
2.2 戊二醛/壳聚糖复合材料对染料吸附条件优化
2.2.1 复合材料G/CS的质量对染料AF/FB/MO去除率的影响 取6份50 mg/L的AF染料溶液于6支10mL比色管中,分别加入5、10、15、20、25、30 mg的G/CS,于恒温振荡器中在303 K、120 r/min下振荡40 min后,测定去除率;分别取4 mg/L和6 mg/L的FB和MO重复以上实验,结果如图4所示.随着吸附剂质量的增加,其中AF的去除率先上升,后趋于吸附稳定,这是因为随着吸附剂质量的增多,吸附结合位点增多[19],但与吸附剂结合的AF/MO/FB分子数量一定,故AF在20 mg时达到吸附平衡,即AF最佳吸附剂质量为20 mg.同样,FB吸附结果表明质量在15 mg处达到最佳,MO质量在20 mg处达到最佳.
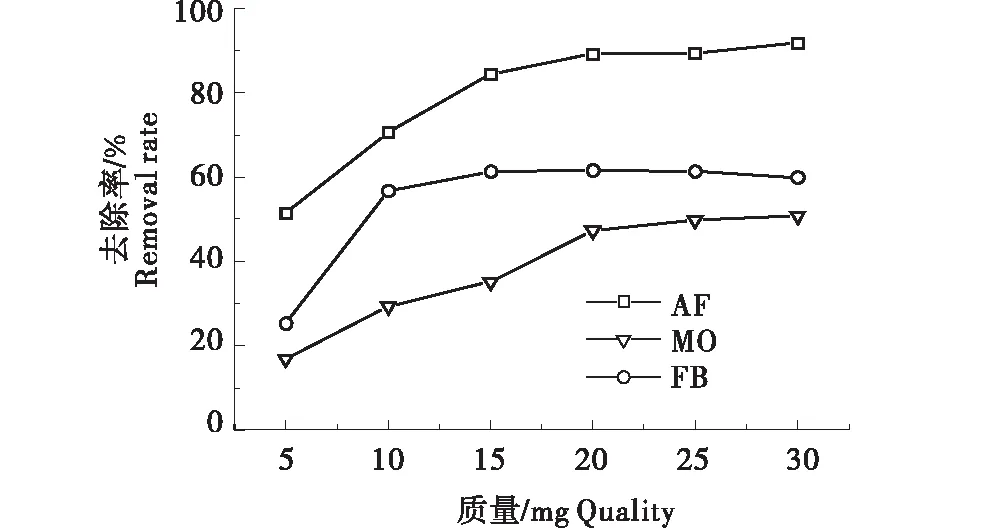
图4 G/CS的质量对AF/FB/MO去除率的影响Figure 4 Effect of G/CS membrane mass on the removal rate of AF/FB/MO
2.2.2 染料初始浓度对染料AF/FB/MO去除率的影响 取浓度分别为50、60、70、80、90、100 mg/L的AF染料溶液于6支10mL比色管中,加入2.2.1确定的最佳质量的G/CS,在303 K、120 r·min-1下振荡40 min后取出,测定吸附后的染料溶液的吸光度,计算去除率;用类似的方法,测定G/CS对不同浓度的FB和MO的去除率.结果表明,G/CS对90 mg/LAF具有最好的吸附效果,去除率达到94.59%;对2 mg/LMO去除率最佳,达到63.00%;对6 mg/LFB的去除率为58.91%.
2.2.3 pH对染料AF/FB/MO去除率的影响 pH是影响G/CS对染料吸附性能的主要因素,由图5可知,在酸性条件下,G/CS对AF/MO分别在pH为5和3的条件下吸附性能最佳,这是因为酸性条件下G/CS表面的伯胺基团容易质子化[20],正电荷密度增加.同时,在pH<7时MO的结构呈醌式结构带负电荷,AF的磺酸基也带有负电荷[16],与G/CS产生静电作用,增强吸附效果.FB表面具有正电荷基团,在酸性条件下与G/CS表面的正电荷相互排斥,不利于吸附.随着pH的升高,G/CS表面的负电荷增加,两者间静电吸引力增强,去除率升高,但是FB在强碱性下不稳定,故选择最佳pH为7.
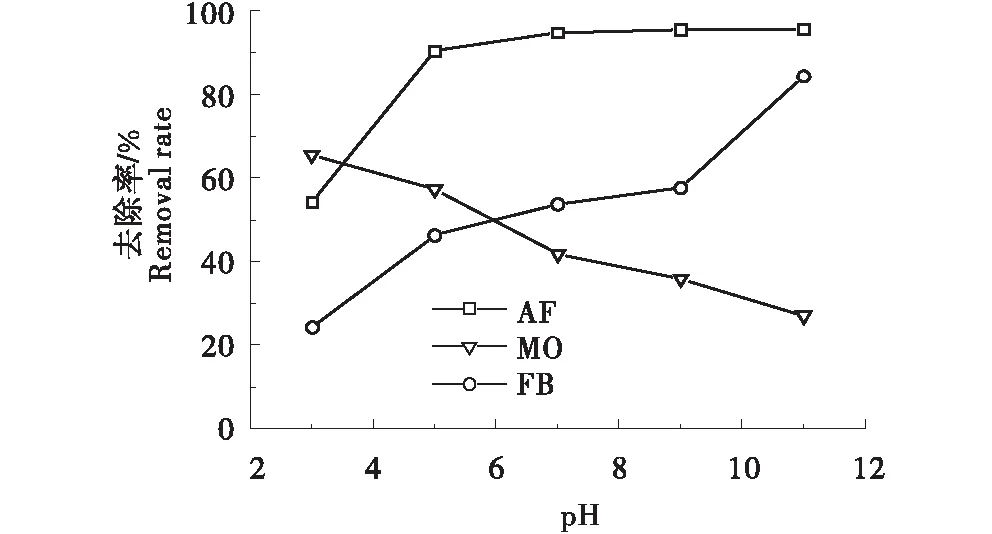
图5 pH对AF/FB/MO去除率的影响Figure 5 Effect of pH on the removal rate of AF/FB/MO
2.2.4 吸附时间对染料AF/FB/MO去除率的影响 吸附时间是影响染料去除率的因素之一[8],由图6可知,G/CS对AF的吸附速度很快,在10 min内就已经达到平衡,去除率达到93.91%.FB/MO去除率随时间的延长而递增,吸附时间达40 min时,去除率分别为59.36%和88.12%.40 min以后,MO趋于平衡,而FB去除率随时间延长而降低.考虑工作效率和去除率,使吸附进行的更加充分,确定G/CS吸附AF的最佳时间为10 min,吸附FB/MO的最佳时间为40 min.

图6 时间对AF/FB/MO去除率的影响Figure 6 Effect of time on the Removal rate of AF/FB/MO
2.2.5 吸附温度对染料AF/FB/MO去除率的影响 吸附温度对染料去除率的影响如图7所示,温度从293 K增大到313 K,G/CS对AF/MO的去除率上升,在313 K以后逐步趋于平稳.而对FB,在303 K之前去除率升高,在303 K后降低.综上可得AF/MO最佳吸附温度为313 K,FB在303 K时最佳.
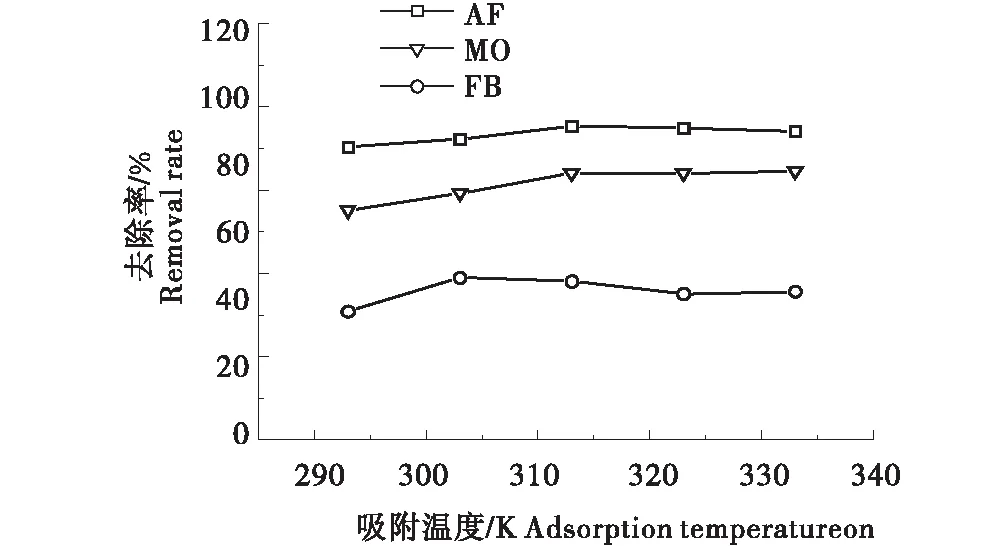
图7 吸附温度对AF/FB/MO去除率的影响Figure 7 Effect of adsorption temperatureon the removal rate of AF/FB/MO
2.2.6 振荡速率对染料AF/FB/MO去除率的影响 从图8可知,振荡速率分别为80、100、120、140、160、180 r/min时,随着振荡速度的增大,G/CS对3种染料的去除率呈现先增大后基本保持不变的趋势.这可能是随着振荡速度的增加,G/CS分子与染料分子之间的碰撞速率越来越快,当振荡速度到140 r/min后,去除率降低.因此最佳的振荡速度分别是120、120、140 r/min.
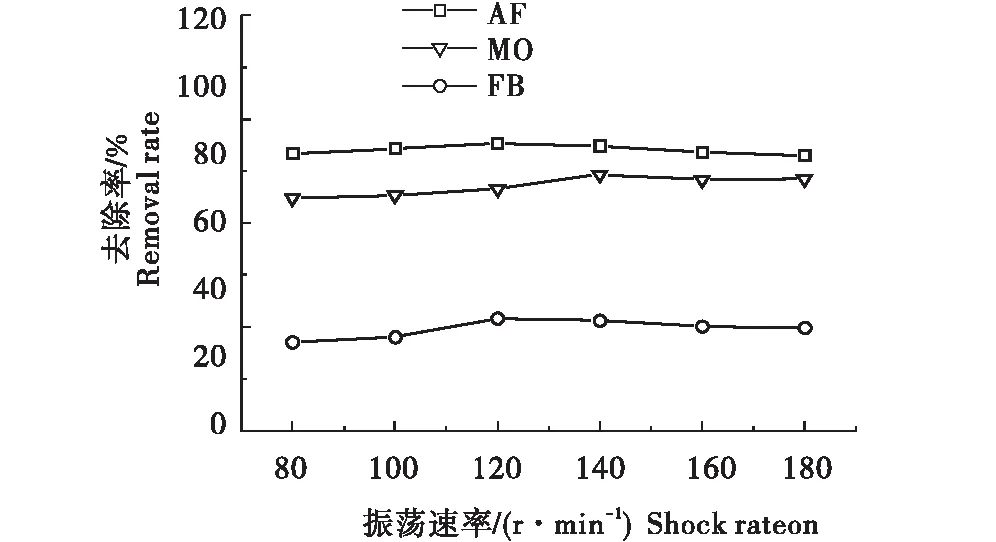
图8 振荡速率对AF/FB/MO去除率的影响Figure 8 Effect of shock rateon the removal rate of AF/FB/MO
2.2.7 脱附再生试验 染料吸附剂的循环再生利用是影响染料吸附是否实际应用的关键因素[19].G/CS对3种染料的脱附与循环再生利用如图9,随着G/CS循环利用次数的增加,对AF、FB、MO吸附效率改变不大.表明G/CS具有良好的循环再生性.多次循环利用后,去除率略有降低,原因可能与吸附剂在染料脱附和洗涤过程中部分产品损失有关.

图9 G/CS再生性能试验Figure 9 Regenerative adsorption property of G/CS
2.2.8 正交试验结果分析 通过表2的极差项可知:各因素对不同染料反应去除率的影响的主次关系分别为:B>A>D>C/C>B>D>A/D>A>C>B,即对AF吸附时pH对其影响最为显著,对FB吸附时G/CS用量对其影响最为显著,对MO吸附时吸附温度对其影响最为显著.三种染料的最佳反应条件分别为A3B2C3D3/A3B2C3D2/A3B2C3D3,即对AF吸附时初始浓度为110 mg/L、pH为5、吸附温度323 K、G/CS用量25 mg;对FB吸附时初始浓度为8 mg/L、pH为7、吸附温度303 K、G/CS用量20 mg;对MO吸附时初始浓度为3 mg/L,pH为3,吸附温度323 K,G/CS用量25 mg.
2.3 戊二醛/壳聚糖对染料吸附机理探究
2.3.1 吸附动力学 常用的吸附动力学有准一级吸附动力学和准二级吸附动力学[20],根据试验数据进行模拟得到表3,由表可知G/CS吸附AF/FB/MO的准二级动力学的R2值远大于准一级动力学的R2,且准二级动力学的拟合吸附量(qe,cal)与试验吸附量(qe,exp)非常接近,所以准二级动力学模型更适合描述G/CS吸附3种染料的动力学行为[7].

表2 正交试验结果与分析
根据粒子内扩散动力学模型和液膜扩散模型方程式计算得到表4,由表4可知,G/CS对AF/MO的吸附过程中,模型拟合R2值均大于0.95,说明同时存在粒子内扩散过程和液膜扩散,并且粒子内扩散作用相对较强.而对FB吸附过程R2值小于0.90,故不应该采用这两种模型拟合.同时发现,粒子内扩散模型和液膜扩散模型拟合的直线不通过原点,因此粒子内扩散和液膜扩散不是唯一的控速步骤[21].
2.3.2 吸附热力学 通过计算吸附热力学参数吉布斯自由能ΔG、焓变ΔH以及熵变ΔS[9],得到吸附反应是否自发进行,吸热还是放热.以lnKd对1/T作图,根据其拟合曲线斜率和截距求得ΔH和ΔS[22],热力学参数如表5所示,G/CS吸附AF/MO是一个吸热、熵增自发进行的过程,而FB是放热、熵减非自发进行过程.
2.3.3 吸附等温线 Langmuir吸附等温模型和Freundlich吸附等温模型是两种描述吸附过程中吸附常用模型.Langmuir模型描述的是在吸附时吸附位点被占据后不会再被其它被吸附物吸附,即单分子层的吸附,而Freundlich模型是基于非均相表面上的多层吸附[23].吸附平衡时,按Langmuir吸附等温式和Freundlich 吸附等温式进行拟合,得到表6.由表6可知,G/CS对AF/FB/MO的吸附过程中Langmuir吸附等温拟合曲线的线性比Freundlich吸附等温线的线性好,故AF/FB/MO的吸附过程更符合Langmuir吸附等温吸附模型.
对Langmuir公式进一步深入分析,分离常数RL=1/(1+KL*co),无量纲,可以用来说明吸附过程的性质以及与吸附体系的相符程度.RL有4种可能的情况:0 表3 戊二醛/壳聚糖动力学模型参数 表4 3种染料的粒子内扩散和液膜扩散模型参数 表5 戊二醛/壳聚糖热力学参数 表6 戊二醛/壳聚糖等温吸附模型参数 成功制备了戊二醛/壳聚糖交联复合材料,SEM显示具有较纯壳聚糖更加粗糙的表面,交联分子结构更稳定.G/CS对AF、FB、MO 3种染料都具有良好的吸附效果,吸附能力大小顺序为AF>MO>FB. G/CS对AF染料的最佳吸附条件是:pH=5,G/CS质量为25 mg,浓度为110 mg/L,温度为323 K,吸附时间为10 min振荡速率为120 r/min,最大去除率为95.83%;G/CS对FB染料的最佳吸附条件是:pH=7,G/CS质量为20 mg,FB染料浓度为8 mg/L,吸附温度为303 K,吸附时间为40 min,振荡速率为120 r/min,最大去除率为71.53%;G/CS对MO染料的最佳吸附条件是:pH为3,G/CS质量为25 mg,MO染料浓度为3 mg/L,吸附温度为323 K,吸附时间为50 min振荡速率为140 r/min,最大去除率为89.70%. G/CS对3种染料的吸附过程作吸附动力学模拟,结果都符合准二级动力学模型和Langmuir吸附等温吸附模型,且0 G/CS对AF、MO吸附过程中热力学参数吉布斯自由能ΔG<0、焓变ΔH>0和熵变ΔS>0,是一个吸热、熵增自发进行的过程.而吸附FB过程吉布斯自由能ΔG>0、焓变ΔH<0和熵变ΔS<0,则是放热、熵减非自发进行过程.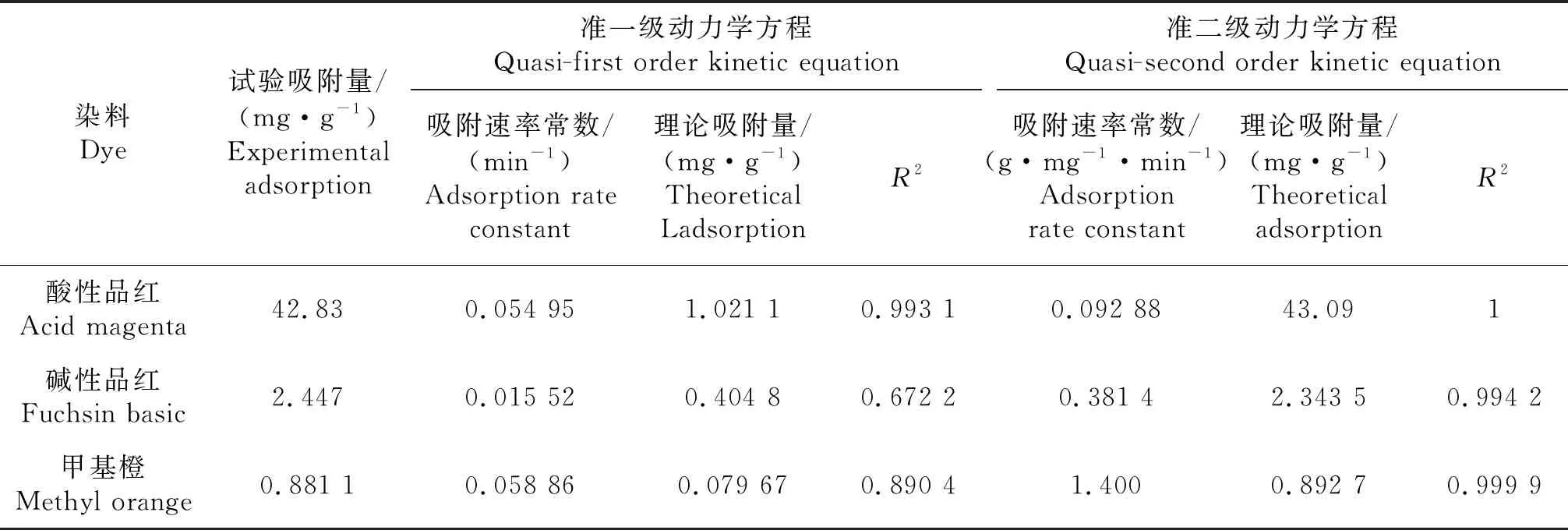



3 结论
