野生絮缘蘑菇ITS鉴定及其生物学特性
2020-12-28杨琴刘明军张桂香杨建杰王海峰
杨琴,刘明军,张桂香,杨建杰,王海峰
(1.甘肃省农业科学院蔬菜研究所,甘肃 兰州 730070;2甘南藏族自治州农业科学研究所,甘肃 合作 747000)
絮缘蘑菇Agaricussubfloccosus(Langs)Pilat在分类上隶属于伞菌目Agaricales、伞菌科Agaricaceae、蘑菇属Agaricus,与双孢蘑菇Agaricusbisporus同属于Duploannulatae组[1-2],作为一种食用菌,具有潜在的栽培价值[3-4],是进行种质资源收集和开发利用的理想材料.野生食用菌的分离鉴定、生物学特性研究是其开发运用的首要环节.传统的野生食用菌分类以形态观察为主,由于子实体形态易受到产地、环境和生长阶段等外界因素的影响,给鉴定增加了不小的难度.随着分子生物学的快速发展,野生食用菌的分类鉴定变得快速、准确,李赛飞等[5]通过形态鉴定和ITS鉴定将我国的蘑菇属真菌种类增加到57种,近年来发表的20余个真菌新属,绝大多数属的建立也均有分子证据支持[6].
絮缘蘑菇首次由真菌学家Lange对其进行了描述[7],而相关研究则到了20世纪90年代,Noble等[3]对不同来源的絮缘蘑菇菌株进行了比较,发现絮状蘑菇具有比双孢蘑菇更浓郁的气味、更复杂的菌环、更多的菌盖絮状物、更鲜明的伤变反应,菌盖边缘通常也会形成浅层放射状裂隙;絮状蘑菇不同菌株之间存在菌丝长速、产量方面的差异显著,但其孢子大小则表现出较高的一致性,比双孢蘑菇略小一些[8],可以作为分类的重要参考指标;Kerrigan等[9]从絮缘蘑菇子实体微观形态、平板菌丝生长情况以及基因型(采用RFLP技术)等角度入手研究了絮缘蘑菇复合群遗传结构,将絮缘蘑菇划分成低海拔群(≤200 m)和高海拔群(500~700、1 100~1 600 m).除此之外,絮缘蘑菇仅出现在蘑菇属不同种类的微观形态比较[10-11]和蘑菇属系统发育重建研究[8,12]之中,值得一提的是Buchalo等.[10]发现老化的菌丝体表面通常会形成棒状晶体,有时也会形成头发丝状晶体,而晶体的形成则是一些大型真菌的特有特征.我国有关絮缘蘑菇的报道仅有南岳山自然保护区分布记载[13],没有生物学特性相关研究.本文对采集于祁连山国家级自然保护区西水自然保护站大野口排露沟流域(N 38°16′~38°33′,E 100°13′~100°16′)海拔2 900 m青海云杉林地中的野生絮缘蘑菇进行分离,并对其分离纯化物进行ITS鉴定和生物学特性研究,旨在筛选适宜菌丝体生长的营养条件和环境条件,以期为絮缘蘑菇的开发利用提供参考资料.
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 采集祁连山国家级自然保护区西水自然保护站大野口排露沟流域海拔2 900 m青海云杉林地中的野生絮缘蘑菇,经组织分离、纯化获得,编号为XSLQ 12.
1.1.2 培养基葡萄糖20 g,蛋白胨2 g,KH2PO42 g,MgSO41 g,琼脂18 g,水1 000 mL.
1.2 试验方法
1.2.1 野生絮缘蘑菇的ITS鉴定 将菌株XSLQ12接种于PDA平板培养基中,25 ℃下暗光培养,待菌丝长满平板后,刮取菌落菌丝进行DNA提取、PCR扩增、纯化、测序、BLAST比对(此过程由苏州金唯智生物科技有限公司完成),下载相似性高的ITS序列,用Clustalx进行相似性多序列比对,用MEGA 5.05软件中的Neighbor-Joining法构建系统发育树,重复抽样1 000次分析系统树各分枝的置信度.
1.2.2 野生絮缘蘑菇生物学特性研究 在培养基组成如1.1.2、培养基pH值自然、培养温度25 ℃的特定条件下,保持其它因素不变,只改变培养基碳源、氮源、pH值、培养温度4个因素中的其中一个,观测不同培养下的菌丝生长情况.碳源筛选有葡萄糖、蔗糖、果糖、乳糖、麦芽糖、甘露醇、可溶性淀粉7种,氮源筛选有酵母膏、蛋白胨、黄豆粉、硫酸铵、亚硫酸钠5种,pH值筛选有4.0、5.0、6.0、7.0、8.0、9.0共6个,培养温度筛选有10、15、20、25、30、35 ℃共6个,以菌丝长速为主,综合考虑菌丝长势、菌丝形态,进行适宜碳源、氮源、pH值、温度的筛选,每试验重复3次.
1.2.3 测定方法 取生长良好的PDA平板菌落,用直径0.5 cm的打孔器取同一直径内的菌块,接入相应的培养基中央进行培养,菌丝萌发后,采用十字划线法测定菌落大小,每隔24 h测量1次,记录菌丝长势、菌丝形态,计算菌丝长速.
2 结果与分析
2.1 野生絮缘蘑菇的鉴定
菌株XSLQ 12的ITS1/ITS4引物区段序列扩增长度为709 bp(图1),测序结果登录NCBI与GenBank中已知菌株进行BLAST比对,覆盖度99%以上、相似性为99%的菌株有5个,分别为4个Agaricussubfloccosus、1个Agaricusagrinferus,覆盖度99%以上、相似性为98%的菌株较多,多数为Agaricusbisporus、个别为Agaricusdevoniensis.基于供试菌株及上述相似度高的ITS序列共计13个,采用NJ法构建系统发育树(图2).从系统发育树可看出,菌株XSLQ 12与Agaricussubfloccosus聚为一支,离Agaricusbisporus、Agaricusdevoniensis较远,结合菌株XSLQ 12与菌株RWK1441的最高相似比为695/704(99%),可以确定供试菌株XSLQ 12为絮缘蘑菇Agaricussubfloccosus.
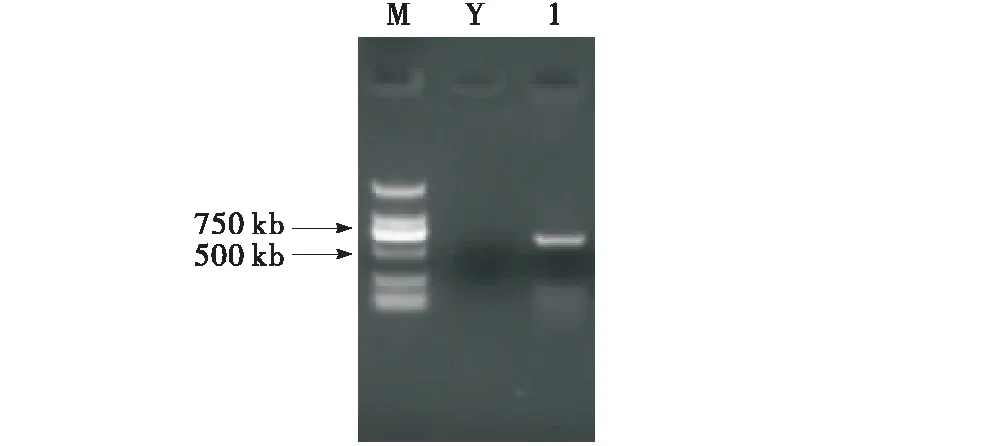
M:Marker;Y:阴性对照;1:以XSLQ12基因组DNA为模板的ITS扩增条带.M:Maker;Y:Negative control;1:Its amplified band using XSLQ12 genemic DNA as template.图1 ITS片段的扩增Figure 1 Amplification of ITS fragments

图2 野生絮缘蘑菇及其相似物种ITS序列构建的NJ系统发育树Figure 2 Phylogenetic tree of NJ based on ITS sequences of wild Agaricus subfloccosus and ITS analogs
2.2 不同碳源对野生絮缘蘑菇菌丝生长的影响
由表1、图3可知,野生絮缘蘑菇菌丝能够利用的碳源谱较为广泛,且不同碳源对菌丝长速的影响差异不大,其中果糖、蔗糖、可溶性淀粉三者的菌丝生长较快,长速均大于0.850 cm/d,三者之间无显著差异;葡萄糖、乳糖、麦芽糖的菌丝生长较慢,长速在0.757~0.769 cm/d之间.从表1、图4可知,葡萄糖、果糖作碳源时菌丝浓密、毛毡状,乳糖、甘露醇、可溶性淀粉作碳源时菌丝较密,而蔗糖、麦芽糖作碳源时菌丝稀疏、毛絮状.综合考虑菌丝长速、长势,可以确定果糖是野生絮缘蘑菇XSLQ 12菌株的适宜碳源.

表1 不同碳源对野生絮缘蘑菇菌丝生长的影响

图3 不同碳源野生絮状蘑菇菌丝生长曲线Figure 3 The curve of mycelium growth of Agaricus subfloccosus under different carbon source

图4 不同碳源野生絮缘蘑菇菌丝生长情况Figure 4 Mycelial growth of Agaricus subfloccosuse under different carbon compounds
2.3 不同氮源对野生絮缘蘑菇菌丝生长的影响
不同氮源对野生絮缘蘑菇菌丝生长的影响作用很大.从菌丝长速来看,菌丝在黄豆粉、酵母膏、硫酸铵上生长较快,平均长速大于0.832 cm/d,且三者之间无显著差异,其次为蛋白胨,平均长速为0.719 cm/d,菌丝在亚硝酸钠上生长较慢,平均长速为0.477 cm/d;菌丝长速在黄豆粉上提高最快,从24 h的最慢至48 h时已位居第一(表2、图5).从菌丝长势来看,酵母膏、蛋白胨为氮源时菌丝长势较好、气生菌丝密;硫酸铵,黄豆粉、亚硫酸钠作氮源时菌丝长势很差、气生菌丝稀疏(表2、图6).综合菌丝长速和长势,确定野生絮缘蘑菇XSLQ 12菌株的最适氮源为酵母膏.

表2 不同氮源对野生絮缘蘑菇菌丝生长的影响
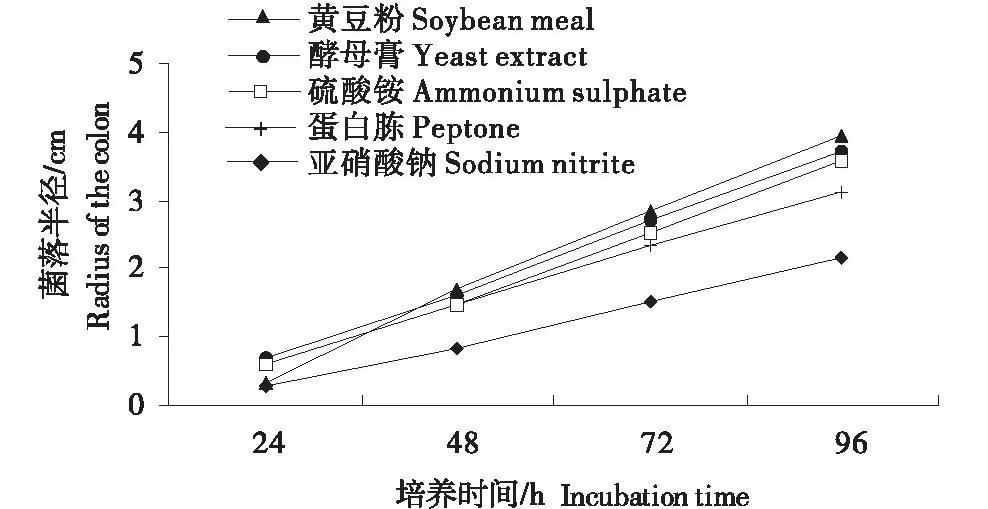
图5 不同氮源野生絮状蘑菇菌丝生长曲线Figure 5 The curve of mycelium growth of Agaricus subfloccosus under different nitrogen source

图6 不同氮源野生絮缘蘑菇菌丝生长情况Figure 6 Mycelial growth of Agaricus subfloccosuse under different nitrogen compounds
2.4 不同pH值对野生絮缘蘑菇菌丝生长的影响
从图7可知,不同pH值的野生絮缘蘑菇菌丝生长曲线可分为两组,第一组为pH 4、pH 5、pH 6,曲线迅速上升,第二组为pH 7、pH 8、pH 9,曲线平缓上升,且pH 6、pH 7两曲线的上升幅度差异很大,结合表3可知,菌丝平均生长速率从0.811 cm/d迅速降低至0.557 cm/d,说明酸性环境较中性偏碱环境更有利于菌丝生长;pH 4、pH 5两曲线贴合度高,菌丝平均长速分别为0.874 、0.866 cm/d,二者间无显著差异,此情况亦存在于pH 8、pH 9两曲线之间,说明野生絮缘蘑菇XSLQ 12菌株对过酸、过碱环境有一定的耐受力.从表3、图8可知,不同pH值对菌丝长势的影响较小,所有pH值的菌丝均呈毛絮状,其中pH5、pH6菌丝略显浓密些,因此,野生絮缘蘑菇XSLQ 12菌株的最适pH值为5.
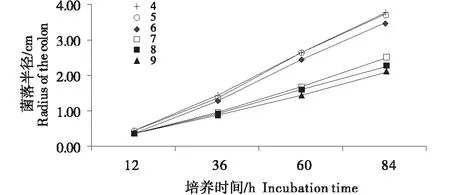
图7 不同pH值野生絮状蘑菇菌丝生长曲线Figure 7 The curve of mycelium growth of Agaricus subfloccosus under different temperture
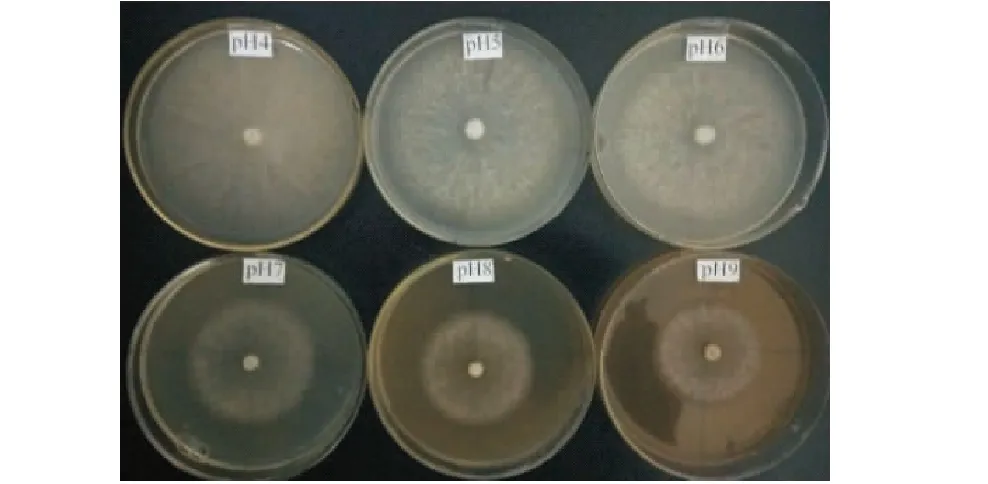
图8 不同pH值下野生絮缘蘑菇菌丝生长情况Figure 8 Mycelial growth of Agaricus subfloccosuse under different pH Value

表3 不同pH值对野生絮缘蘑菇菌丝生长的影响
2.5 不同温度对野生絮缘蘑菇菌丝生长的影响
不同温度下野生絮缘蘑菇XSLQ12菌株的菌丝萌发时间、菌丝生长曲线上升幅度差异均很大,说明温度对菌丝生长速率的影响较大.具体表现为:当温度≤20 ℃时,随着温度的升高,菌丝萌发速度、生长速度逐渐提高;当温度为25 ℃时,菌丝萌发时间缩短为24 h,菌丝长速提高到0.754 cm/d,虽与20 ℃下的菌丝长速相当,但其菌丝浓密、洁白;当温度>25 ℃时,随着温度的升高,菌丝萌发速度、生长速度迅速下降,30 ℃时菌丝萌发时间延长为96 h、长速降低为0.080 cm/d,35 ℃时菌丝停止生长(表4、图9~10),说明野生絮缘蘑菇菌丝适宜在中低温环境下生长,高温对菌丝的影响作用很大.菌丝长速(y)与温度(x)间的函数关系为:
y=-0.000 5x3+0.022 9x2-0.301 5x+1.461 7
R=0.999 8
3 讨论
在参与系统发育树构建的絮缘蘑菇菌株中,菌株RWK1441、RWK1994、RWK1993三者遗传距离近,菌株FS5、RWK1397二者遗传距离近,XSLQ 12则相对较远,这与其发生地海拔有很大关系,因为在森林生态系统中,海拔梯度的变化会导致温度、光照、水分等多种环境因子的变化[14],进而影响野生菌的生长发育.菌株FS5、RWK1397采集于低海拔[3],菌株RWK1441采集于海拔1 600 m[9],菌株XSLQ 12采集于海拔2 900 m.Kerrigan等[9]在研究絮缘蘑菇复合群遗传结构时发现,高海拔(500~700、1 100~1 600 m)、低海拔(≤200 m)两群体间形态差异小,但其培养特性、基因型差异很明显,此观点在后来的蘑菇属孢子繁育系统[15]以及蘑菇属系统发育重建和修订研究[8]中均得以证明.

表4 不同温度对野生絮缘蘑菇菌丝生长的影响

图9 不同温度对野生絮缘蘑菇菌丝长速的影响Figure 9 Effect of different temperture on mycelium growth of Agaricus subfloccosuse

图10 不同温度野生絮缘蘑菇菌丝生长情况Figure 10 Mycelial growth of Agaricus subfloccosuse under different temperatures
絮缘蘑菇菌株XSLQ 12在菌丝生长阶段最适碳源为果糖,最适氮源为酵母膏,最适培养温度为25 ℃,最适pH值为5.0,与梁倩倩[16]报道的絮缘蘑菇最佳碳源蔗糖、最佳氮源硝酸钾、最佳温度16 ℃,最佳pH 6不一样,但与同一采集地的双孢蘑菇[17]存在相似之处,二者的最适温度均为25 ℃、二者在pH4~5、8~9范围内都能生长,这一点与梁倩倩[16]报道的絮缘蘑菇、胡日瓦[18]报道的丁香蘑菇在pH>9的环境下停止生长不一样,均表现出了对过酸、过碱环境的耐受力,二者的自然发生地土壤为森林灰褐土、碱性、测定数pH为8.05[19-20].
絮缘蘑菇菌株XSLQ 12在适宜的条件下其菌丝长速为0.754~0.899 cm/d,比梁倩倩[16]报道的菌丝长速(0.124~0.150 cm/d)和Kerrigan等[9]报道的菌丝长速(高海拔,0.082~0.089 cm/d;低海拔,0.046~0.067 cm/d)均要快很多,也快于同一采集地的野生双孢蘑菇菌丝长速(0.350~0.459 cm/d)[17],菌株XSLQ 12在菌丝生长方面具有一定的优势.
4 结论
采集于祁连山国家自然保护区排露沟流域海拔2900 m青海云杉林中的野生子实体经组织分离、纯化得菌株XSLQ 12,此菌株的ITS1/ITS4引物区段序列扩增长度为709 bp,扩增产物经BLAST比对、系统发育树的构建确定XSLQ 12菌株为絮状蘑菇Agaricussubfloccosus.
絮缘蘑菇菌株XSLQ 12在菌丝生长阶段能够利用单糖、双糖、多糖及糖醇,以果糖为其最适碳源;能够利用复合氮、无机氮,以酵母膏为其最适氮源;嗜好酸性环境、最适pH值为5.0,对过酸、过碱环境有一定的耐受力;适宜在中低温环境下生长,最适培养温度为25 ℃;在最适培养条件下,菌株XSLQ 12在菌丝生长方面表现出一定的优势.
