影像组学在胃肿瘤诊疗中的应用进展
2020-12-28蔡一奇施明明许利斌陈孝冬章巍腾胡畅远朱冠保王鹏飞
蔡一奇,施明明,许利斌,陈孝冬,章巍腾,胡畅远,朱冠保,王鹏飞
(1.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015;2.温州医科大学附属第二医院 胃肠外科,浙江 温州 325027)
胃肿瘤是全球常见的消化道肿瘤,胃恶性肿瘤在我国的肿瘤发病率中居第2位,病死率居第3位[1-3]。术前精准的影像学检查能够准确地评估胃肿瘤的良恶性及肿瘤疾病的分期,协助临床医师制定个体化精准的治疗方案。经典的医学影像技术主要依靠上消化道造影、超声胃镜(endoscopic ultrasonography,EUS)、计算机断层扫描(computed tomography,CT)等图像中的形态学特征来鉴别胃肿瘤的良恶性及分期,由于存在医师经验的个体差异,因此在报告的结果上存在一定的主观性。随着医学诊断技术的不断发展,人们对肿瘤的诊疗模式逐渐向精准医疗过渡,传统的影像信息已经不能够完全适应精准医学的发展,需要探索和开发更系统、更全面和更精准化的图像诊断技术,自此影像组学(Radiomics)应运而生。在此,笔者对影像组学在胃肿瘤诊疗方面的临床研究现状进行综合分析并进行客观地评价,为今后影像组学在胃肿瘤诊疗中的应用提供研究思路。
1 影像组学概念的提出
影像组学这个概念最早由荷兰学者Philippe Lambin于2012年首次提出,指的是基于患者的影像图像通过高通量提取大量有关疾病的影像学特征,将医学图像转换成可获取的高维数据,从而能够量化疾病的影像学信息,通过分析和利用计算机软件挖掘成像参数来预测患者的特定结果[4]。应用于辅助诊断、肿瘤预测、治疗方案选择等领域发展个体化、精准化的治疗方式,在恶性肿瘤的分期、良性肿瘤危险因素的分级,肿瘤分子生物分型、肿瘤患者个体化治疗方案的判断和评估预后等方面表现出巨大的潜在优势,是目前乃至未来临床影像学和生物信息学研究的热点[5]。
2 胃肿瘤影像组学的研究流程
影像组学的流程主要分为:对原始影像图像的获取、感兴趣区域(region of interest,ROI)的勾画、定量特征的提取和量化、人工智能模型的建立及数据分析和临床辅助决策的应用[6]。其核心步骤是提取高维特征数据,定量分析ROI的属性(见图1)。
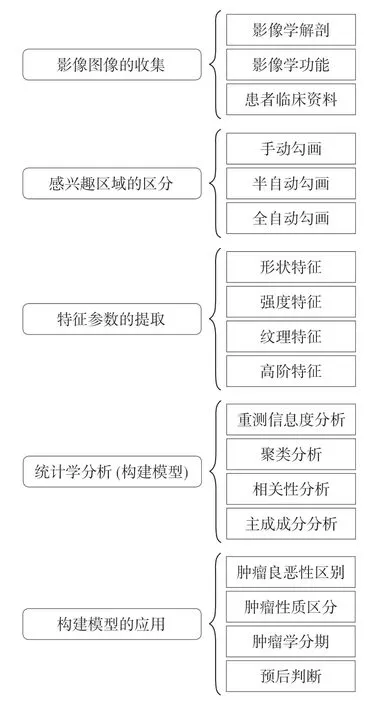
图1 与胃肿瘤相关的影像组学的流程
2.1 数据采集 胃肿瘤影像组学目前主要以CT、MR及PET等为媒介,获取优质的影像图像作为原始资料,构建成影像学资料库。由于胃为消化道的空腔脏器,不像肝脏、胰腺、肺结节这样的实质性结构,加之胃存在蠕动波,其脏器边界存在动态性,因此,在行影像学检查前,需要作充足的准备(例如:在行全腹CT前,需要口服发泡剂、普利卡因等药物,使得胃蠕动减慢,使胃扩张,充分显示胃壁结构),以得到较高质量的影像学图像资料[7]。同时,在采集胃肿瘤影像图像时应尽可能采用同种类型的设备,使前后对比具有相同的影像图像的层厚、像素等参数[5,8]。因此,影像组学对图像的品质以及标准化、统一化也提出了较高的要求。
2.2 图像分割 指分割、提取ROI图像(比如图像中的胃肿瘤或癌症区域),其精确分割是获取准确特征值的前提,是后续图像处理的关键步骤,这也是基于胃肿瘤影像组学的难点。目前对胃肿瘤ROI的分割方式主要有以下3种[5]:软件自动化分割(全自动)、由专业的影像医师或经验丰富的临床医师手动勾画(人工)和利用半自动化软件选择(半自动)[9]。手动勾画法(例如Photoshop软件)因依赖人的参与,对医师经验的依赖度高,有着准确度高,对复杂肿瘤边界精确勾画的优势,但也因其受人为主观因素影响较大,存在着可重复性低,费时费力等缺点[10]。软件自动化分割(全自动,例如CAD自动分割软件)则是一种完全由计算机软件控制的分割技术,工作效率高,受人为因素干扰小,但对于胃这种空腔脏器而言,自动分割算法性能差,分割准确性低,难以在临床实践中得到普及。而半自动分割技术(例如ITK SNAP软件)介于两者,有着兼顾前两者的优缺点,也是目前在胃肿瘤影像组学的研究中应用较多的分割方法[11]。目前基于ROI的高精确自动图像分割软件的研究将是胃肿瘤影像组学图像分割研究的一个重点。
2.3 特征提取 指从前面已分割的胃肿瘤影像学图像中提取图像结构的特征向量及特征性的参数,比较数据之间的异同点。再通过计算机软件(例如Python软件)分析参数内容,找到影像学图像中存在与肿瘤良恶性或分期显著相关的各类参数,即将二维ROI通过分割,然后重构为三维感兴趣区域(voxel of interest,VOI)图像,从生成的三维图像中,提取高维数据[6]。目前,提取的胃肿瘤的特征数据按图像特征的不同主要分为以下两类[12]:一类是传统影像学的定性特征,如影像强度(包括肿瘤的大小、直径的标准差、能量等,约40余种),影像形态(包括肿瘤的密度、体积等,约30余种);另一类属于不可视的肿瘤异质性,如影像纹理(包括灰度、熵值、共生矩阵特征等,约200余种)、影像高阶特征(包括边界、粘面自由比值,约300余种)等。此外,所应用的特征提取算法在特征命名、参数定义、方法和软件实现等方面均存在差异[13-15]。在对胃的成像中,在多个时间点成像,因器官运动或扩张或收缩使影像组学特征可能具有有限的适用性,因此重测数据可用于提高影像组学特征的稳定性[10,16-17]。
2.4 分析、建模及验证 胃肿瘤影像组学分析的方法,按监督形式的不同,可分为无监督分类器数据分析和有监督分类器数据分析[6]。有监督的分类器需要有明确的输出作为分类的依据,根据影像图像特征建立患者与胃肿瘤之间的相关性并进行自动分类,验证临床的分析判断的准确性。无监督的分类器通过计算特征自身的间距进行分类,将间距作为判定规则来进行样本图像数据的种类划分[18]。最后,对所建立的模型进行验证,才能肯定模型的应用及价值,也是影像组学的根本目的。目前在胃肿瘤影像组学应用最多的领域包括肿瘤分类、分期,淋巴结的转移和预后预测等[19-20]。现在最常用的统计学分析方法为根据受试者工作特性(the receiver operating characteristic,ROC)曲线或ROC曲线下面积(the area under the ROC curve,AUC)确定识别范围,AUC值的大小直接量化了模型的敏感性和特异性,所得到的结果被认为更客观,更独立[21-22]。
3 影像组学在胃肿瘤领域的临床应用
3.1 在胃肿瘤的筛查和诊断中的应用 由于受到早期胃肿瘤瘤体的限制,及增强CT影像学直观性较差,目前影像组学在胃肿瘤早期诊断的研究甚少,更多的是基于进展期胃肿瘤中的应用,尤其在鉴别诊断上的应用[23]。MA等[24]回顾性分析了40例Borrmann IV型胃癌患者和30例原发性胃淋巴瘤患者,从门静脉期的CT图像中选择了485个放射学特征,以建立放射影像学特征模型。通过多变量分析将放射学特征、主观CT表现、年龄和性别整合到一个组合模型中。利用ROC曲线及AUC对构建好的三种模型进行诊断性能的评估。结果发现主观发现模型、放射学特征和组合模型显示出的诊断准确性没有显著差异。这表明通过影像组学能够准确地区分Borrmann IV型胃癌和原发性胃淋巴瘤。SUN等[25]通过回顾性分析经术后病理证实的60例胃癌和40例胃间质瘤的CT增强扫描数据,包括胃周脂肪浸润、胃周淋巴结肿大,胃肿瘤的增强和生长方式。其次,根据CT图像对胃肿瘤进行手动分割,通过ITK-SNAP软件提取放射学特征,并构建放射学特征模型。使用ROC曲线比较了影像组学特征参数在区分胃癌和胃间质瘤中的诊断效力。结果发现组合了影像组学模型的AUC值(0.903)、特异性(93.33%)和准确性(86.00%)均达到最高值。说明结合主观CT征象和影像组学征象的诊断模型可以提高胃肿瘤的诊断准确性。
3.2 在胃肿瘤分级和分期中的应用 在临床工作中,对于胃肿瘤的分期和分级的认定,关系着疾病的治疗方案,LIU等[26]通过对233例进展期胃癌患者的术前CT图像进行回顾性分析,在静脉期CT图像上沿着病变边缘手动绘制ROI,并自动提取了539个量化特征,在队列的基础上构建了多元回归模型,测试并验证了模型的可靠性。结果发现在有和没有腹膜转移的进展期胃癌患者之间,六个放射学特征(ID_Energy、LoG(0.5)_Energy、Compactness2、最大直径、方向和表面积密度)存在统计学差异,并且在区分进展期胃癌人群是否有腹膜转移方面表现良好(AUC=0.618~0.658)。影像组学所建立的模型的准确性与临床病理模型相当(AUC,0.724vs.0.762)。WANG等[27]为了探讨CT在胃癌术前预测淋巴结转移中的作用,回顾性分析了247例经手术证实为胃癌的患者(对照组197例,实验组50例),通过Radiomics软件在术前动脉期(AP)CT图像上分割病变并提取特征图像,通过使用随机森林(RF)算法,构建了一个影像组学模型来预测淋巴结转移。结果发现通过CT影像组学所构建的模型在预测胃癌患者是否存在淋巴结转移方面能力出众,AUC达到了0.886(95%CI=0.808~0.941),有利地说明基于CT的影像组学,有望作为一种非侵入性工具,用于个体预测胃癌LN转移的诊疗手段。
3.3 在胃肿瘤治疗和预后中的应用 胃肿瘤患者的个体化治疗对诊疗技术及诊疗信息的获取有着更高水平的要求,而影像学技术正是临床工作中缺一不可的重要技术手段。JIANG等[28]应用影像组学的方法验证了一种用于预测胃癌患者化疗后疗效的影像组学特征,构建了整合影像组学特征的命名图,验证了影像组学特征对传统分期系统个性化生存评估的增量价值,从校验、鉴别和临床应用性等方面评价了这些图像的性能。该研究将得到19个影像组学特征纳入基于放射组学的命名图中,与临床病理和TNM分期系统相比,对DFS和OS的估计具有更好的性能,提高了生存结果分类的准确性。
4 影像组学在胃肿瘤诊疗中面临的挑战与未来发展
4.1 影像组学在胃肿瘤诊疗中面临的挑战 胃肿瘤影像组学是计算机信息技术与医学信息技术相结合的产物,临床医师具有专业的临床知识却缺乏计算机知识,而计算机软件工程师具有软件专业知识,却没有医学知识背景,因此,两者需要进一步地融合各自地专业知识,对研究者有更高层次地要求。目前国内外对胃肿瘤的影像图片的ROI的勾画,没有技术上的统一,胃肿瘤ROI的分割多采用手动或半自动的方法,需要消耗较多高级人力,同时还存在主观性的差异;胃肿瘤的形态不固定,尤其早期胃癌其与正常组织边界判断的准确性、标注稳定性和一致性较低,将影响模型效能[24]。国内外不同研究中心获取和重建图像方法、图像的质量、图像处理没有统一的标准;采用不同的影像仪器所获研究结果也存在差异;对于造影剂的浓度、增强时相、扫描参数剂量及噪声指数等,更是遵循不同的标准,各方面的不一致将成为后续构建准确模型的潜在干扰[24]。目前与胃肿瘤相关的影像组学研究多基于特定成像参数的回顾性数据采集,其测量参数不同,模型的可重复性也将存在一定的差异[29]。影像组学已展现其病变定量表征能力,但许多胃肿瘤影像学纹理特征与肿瘤生物学特性间的关联尚未建立,其影像组学与预后的关系是统计相关性而非因果关系,这降低了影像组学的说服力,使其在临床应用受到阻碍[24],需要后续进一步依靠基础医学的研究。
4.2 对影像组学的展望 影像组学在胃肿瘤的诊断和早期筛查方面有着广阔的应用前景。肿瘤的异质性表现在空间与时间上,这也一直被认为是肿瘤治疗失败的主要原因[30]。胃黏膜活检是目前诊断胃癌的金标准,但取材范围有限、诊断的准确性有限且不能评估肿瘤的扩散与转移,种种条件的限制使得影像组学在胃肿瘤上的应用尤为重视[31-32]。与以往侵入性活检相比,影像组学技术可以更好地评估整个肿瘤与其周围组织,更好地把控肿瘤在时间和空间上的异质性。影像组学能提供肉眼无法辨别的图像的客观信息,力求能从细微的纹理特征中有所突破。同时,影像组学具备了无创性与易反复操作性的优势,且其定量化的影像学参数在一定程度上减小了临床医师主观判断的局限性。影像组学作为一种新的“虚拟活检”技术,能为传统活检提供重要的补充信息,但不是完全替代传统活检技术[30]。目前基于胃肿瘤得影像组学多为单中心的回顾性研究[33],今后多中心临床研究是将逐渐成为趋势,通过多样化的研究,找到通用的特征值,可有力地支持影像组学研究,更好地服务于临床。
总之,由于影像组学图像数据的复杂性、影像信息量的庞大,相比传统的影像学分析模式,影像组学通过计算机软件来挖掘影像图像中的信息,从理论上能够更加客观、更准确地来提高对影像图像信息利用度,并且能够减少放射影像科医师的工作负担,具有很大的临床运用前景。
