转色期葡萄果肉代谢组变化对土壤水分的响应
2020-12-28张坤王玉安郝燕
张坤,王玉安,郝燕
(1.潍坊学院生物与农业工程学院,山东潍坊261061;2.甘肃省农业科学院林果花卉研究所,兰州730070)
0 引言
【研究意义】红地球葡萄(VitisviniferaL.cv.Red Globe),欧亚种,1986年和1987年先后由郑州果树所、沈阳农业大学引入中国[1],是我国种植面积最大的葡萄品种之一,近年来其种植面积呈下降趋势。积温低的地区,如西北地区的高海拔区域,东北地区等,很难满足其正常成熟[2],不适宜在该区种植区。但利用设施,加上红地球葡萄晚熟的品种特性和可延迟采摘的特点,西北地区设施延迟栽培[3]的红地球葡萄销售时间一般可延迟至12月以后,经济效益很高[4],因此设施葡萄延迟栽培有广阔的发展前景。影响葡萄成熟的因素很多,水分是其中一个主要因素,同时也是设施环境中最易控制的因素,葡萄成熟前降雨多,葡萄的成熟时间会被明显延后[5],表现为可溶性固形物积累减少,因此葡萄成熟前要严格控水,但在设施延后栽培模式下,适当增加灌溉可能对其种植效果有益。葡萄不同生育期的发育特征不同,研究葡萄各阶段代谢途径的开启或关闭,将有助于解释果实发育的调控机制。
【研究进展】葡萄进入成熟期后最显著的变化是果实由硬、酸,向软、富糖转变,且同一代谢途径的代谢产物在果实发育中表现出协调变化[6],而碳水化合物的代谢变化对果实最终成分形成起着重要作用[7]。采用代谢组学可解释不同发育阶段葡萄浆果的成分差异[8],不同品种的生长季节差异以及不同地区间的差异[9]。转色期葡萄果实新陈代谢产生明显变化,糖酵解中间产物和糖磷酸酯在转色前下降,但在转色后保持稳定[10],果实成熟期水分亏缺主要对苯丙酸、ABA、氨基酸、异戊二烯、类胡萝卜素和脂肪酸代谢等产生较大影响,导致花药黄素、黄酮醇和香气挥发物增加,葡萄成熟进程被加速[11]。监测代谢物的变化将有助于更好地解释转色前增加土壤水分诱导的果肉发育代谢变化,而这些变化最终构成和确定了水果化学成分[12]。【切入点】延迟栽培与延迟采摘的区别在于葡萄成熟期时间不同,葡萄转色意味着正式进入熟期,转色前增加土壤水分,维持树体较高水平的营养生长可能延缓这个过程,生产中实现设施葡萄延迟栽培整个物候期后移,对保持葡萄成熟和销售期间的品质将有重要意义。【拟解决的关键问题】本研究在葡萄转色前期,通过增加灌溉的方式延缓葡萄成熟,比较不同处理间葡萄可溶性固形物及代谢组差异,为解释转色期葡萄果肉代谢特征及生产中实现对葡萄产期调控提供依据。
1 材料与方法
1.1 研究区概况
2018年,试验在河西走廊中部的张掖市甘州区乌江镇(E:100°23′23.7″,N:39°6′41.4″)进行,当地海拔1 450 m,年均气温7℃,≥10℃的年积温2 140℃。选用我国西部广泛使用的一种日光温室,主体结构为土夯墙体、钢架支撑和棚膜,长×宽为50 m×8 m。试材为4 a 生红地球葡萄,株行距0.8 m×1.5 m,独龙蔓整形。
1.2 土壤水分控制
土壤水分控制在葡萄转色前20 d 左右(8月下旬)开始实施,每行8株葡萄为1个小区,单独控制,重复3次,利用探头定点持续监测(CS655,Campbell Scientific,USA)、采集(CR1000,Campbell Scientific,USA)土壤20 cm 深度处水分状况,当水分低于控制值时,自动灌溉系统中直流继电器控制模块(SDM-CD16S,Campbell Scientific,USA)控制电磁阀(150-PGA,Glendora,California,USA)开启滴灌5 min,直至3个处理20 cm 处土壤深度的体积含水率分别达到0.15 m3/m3(低水分处理)、0.18 m3/m3(中水分处理)和0.24 m3/m3(高水分处理),其中高水分处理为对照。
1.3 样品采集
葡萄进入转色期时开始采样(9月中旬),选择的树体生长位置、长势一致,每个处理采样的葡萄位置、大小及颜色一致。采样前每个小区取20粒葡萄进行调查,重复3次,不同水分处理下果肉可溶性固形物量及编号,(表2),每个处理在10个果穗上随机摘20个果粒,每个果粒切取2 g 果肉,混合后用锡箔纸包好,重复3次,放置液氮中,送样测定葡萄果肉的代谢组。
1.4 测定与分析方法
取10 g 果肉组织液氮研磨,吸100 µL 液样于EP 管,加400 µL 80%的甲醇后涡旋振荡,于-20℃静置60 min,14000 g、4℃离心20 min,取上清于1.5 mL离心管,真空冷冻干燥,残留物以100 µL的复溶剂溶解,涡旋振荡,14000 g、4℃离心15 min,取上清液进样LC-MS 分析。
色谱条件:色谱柱为Accucore HILIC column(Thermo Fisher Scientific,USA),柱温40℃,流速0.3 mL/min。正模式下流动相A为甲酸(0.1%),乙腈(95%),醋酸铵(10 mM),流动相B为甲酸(0.1%),乙腈(50%),醋酸铵(10 mM);负模式下流动相A为乙腈(95%)和醋酸铵(10 mM,pH值9.0),流动相B为乙腈(50%),醋酸铵(10 mM,pH值9.0),色谱梯度洗脱程序见表1。

表1 色谱梯度洗脱程序Table1 Gradient elution procedure
质谱条件:扫描范围为m/z 100-1500;ESI 源设置:Spray Voltage:3.2kV;Sheath gas flow rate:35arb;Aux Gas flow rate:10arb;Capillary Temp:320℃。Polarity:positive,negative;MS/MS 二级扫描为data-dependent scans。
信息分析:将下机数据(.raw)导入CD 搜库软件,先筛选保留时间、质荷比等参数,然后峰对齐(保留时间偏差为0.2 min,质量偏差为5 mg/kg),随后峰提取(质量偏差5 mg/kg,信号强度偏差30%,信噪比3,最小信号强度100000,加入离子等信息),同时定量峰面积,并整合目标离子,预测分子式,比对mzCloud 数据库,用blank 样本去背景离子,QC样本对定量结果归一,得到鉴定和定量结果。
采用偏最小二乘法分析模型,第一主成分变量重要性投影(VIP),结合T-test的P值确定差异代谢物,阈值为VIP>1.0,差异倍数FC>1.5 或FC<0.667 且P<0.05。
2 结果与分析
2.1 样品分析
设施延迟栽培模式下,转色前降低土壤水分可明显加速葡萄的成熟过程。由表2可知,果皮开始转色时,低水分处理与中水分处理的果肉可溶性固形物含量已经达到11%和9%左右,而高水分处理果实可溶性固形物量达到7.5%左右。说明控制土壤水分是调控葡萄熟期的一个有效途径。

表2 样品基本情况Table2 Basic information of samples
QC 样本相关性可评价整个测定过程中系统的稳定性,其相关性越高,说明测定方法的稳定性越好,即数据质量越高。由图1可知,不同样本间的相关系数均在0.99 左右,表明该测试系统能提供科学准确的试验数据。由图2可知,将所有试验样本和QC 样本进行PCA 分析,QC 样本的分布趋向聚集(红色),QC 样本差异较小,说明整个方法稳定性和数据质量较高,其中第一和第二、第三主成分分别为27.88%、15.33%和13.09%。
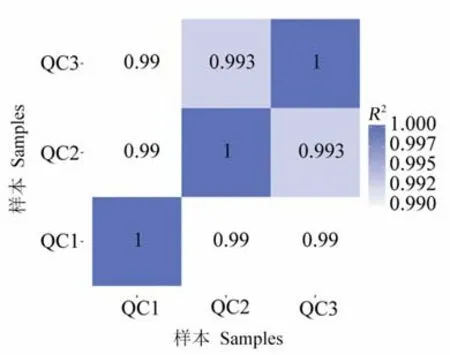
图1 总样本相关性分析Fig.1 Pearson correlation between pos QC samples

图2 总样本PCA 分析Fig.2 PCA analysis of total samples
2.2 果肉差异代谢物分析
2.2.1 偏最小二乘法判别分析(PLS-DA)
运用PLS-DA 方法,建立不同对比组与其代谢物表达量间关系模型,如图3所示。参数R2和Q2越接近1,模型可信度越高。正模式下,3个对比组高水分对比低水分(A),高水分对比中水分(B),低水分对比中水分(C)的R2值达到0.99、1.00和0.98,表明所建模型的拟合度很高,Q2反应模型预测能力,比较组A、B的值分别为0.44 和0.75,表明高水分对比中水分组与样品间相关性最高,而低水分对比中水分组的Q2值为负,可能二者的差异性较小,导致所建模型的预测能力低。

图3 3个对比组PLS-DA 分析Fig.3 PLS-DA analysis of three comparison groups
2.2.2 差异代谢物
3个比较组共鉴定了839个化合物,其中正模式下出现的差异代谢物数量最多,因此本文只对正模式下产生数据进行分析,见表3。低水分对比高水分组出现了27个差异代谢物,其中11个代谢物显著上调,16个代谢物显著下调。上调倍数最大的主要为色素类代谢物,包括鸢尾苷、乙酰丙酸、还原黄4、芍药色素等;下降倍数最大的依次为丁醛、2-羟基戊二酸、吡咪唑以及全氟己烷等。

表3 低水分对比高水分处理的差异代谢物(POS)Table3 Differential metabolites of low moisture treatment compared with high moisture treatment(POS)
与高水分处理比较,正模式下中水分处理筛选出差异代谢物有13种表现为上调,20种下调,结果见表4。上调倍数较大的依次为西那司特(丁酸类)、苯磺酰胺和铬-4-酮等代谢物,下调倍数较大的依次为甲酮、白藜芦醇二聚体、铬-6-酮、(+/-)-2-羟基戊二酸和全氟己烷等。

表4 中水分对比高水分处理的差异代谢物(POS)Table4 Differential metabolites of medium moisture treatmentcomparedwith high moisture treatment(POS)
正模式下低水分对比中水分间出现的差异代谢物较少(表5),其中表现为上调的差异代谢物有4种,表现为下调的差异代谢物只有2种。

表5 低水分对比中水分处理的差异代谢物(POS)Table5 Differential metabolites of low moisture treatmentcomparedwithmedium moisture treatment(POS)
2.3 KEGG 富集分析
只分析差异代谢物中显著性富集的Pathway,与各代谢通路相关的差异代谢物的数目普遍较少,为1个或2个。低水分处理对比高水分处理组和中水分处理对比高水分处理组富集的代谢途径中有8个相同,且富集到的差异代谢物均指向丙酮酸(表6)。与其他组合比较,低水分处理对比高水分处理组特有代谢途径为抗坏血酸和醛糖酸盐代谢和苯甲酸盐降解途径,且代谢途径中的差异代谢物也指向丙酮酸。中水分处理对比高水分处理组特有代谢途径为苯丙氨酸代谢(差异代谢物指向3-苯丙酸和丙酮酸)和细胞色素P450 对外源物质代谢的影响代谢途径。低水分处理对比中水分处理组中富集到的代谢途径为糠醛降解(差异代谢物为5-羟甲基-2-糠醛)和不同环境中的微生物代谢途径(差异代谢物为5-羟甲基-2-糠醛和对氯苯乙酮)。

表6 KEGG 富集结果Table6 Enrichment results of KEGG
3 讨论
葡萄发育过程中生理代谢与农艺措施关系密切[13],环境因素、营养状态、水分供应、生物应力、阳光照射和温度等,均能影响葡萄发育过程中的成分组成[14]。转色是葡萄正式进入成熟的标志,此期葡萄遇土壤缺水,花色苷、糖与香气物质的合成会增加,有机酸与果胶物质量下降,总体表现为葡萄成熟加速。土壤水分环境不同,果实的成熟进程也不一致。本研究显示,葡萄转色期低水分处理与高水分处理的代谢组相比,除与果实色素积累相关的代谢物外,低水分处理下乙酰丙酸的FC值上调倍数较大,它是木质纤维素生物质的脱水产物[15],而纤维素分子决定细胞壁骨架[16],所以乙酰丙酸上调意味着浆果向变软的方向发展,即低水分处理加速果实成熟,因此生产中可喷施乙酰丙酸类物质可促进果实着色、软化[17]。低水分处理与高水分处理差异代谢物比较,FC值下调较大的是丁醛类化合物,其易产生青草香气,是果实不成熟的特征,可见当土壤水分很低时葡萄成熟进程加快,香气物质积累增多。转色期,中水分处理与高水分处理相比,甲酮和白藜芦醇二聚体FC下调较大,表明进入成熟期两者的生成量迅速下降[18]。转色期,低水分和中水分处理下的果肉差异代谢物很少,可能与其处于相近的发育过程有关,二者相比,低水分处理下,果肉的还原黄4、β-D-半乳吡喃糖苷类和对氯苯乙酮代谢物上调,有助于葡萄着色和香气表达,而异抗坏血酸与抗坏血酸功能相似,在葡萄浆果中,抗坏血酸作为酒石酸的前体,在果实发育过程中逐渐升高,并在果实成熟期达到最大值[20],这些现象也证实较高的土壤水分有助于延缓果实成熟。同时也发现低水分处理与中水分处理相比,果肉中差异代谢物5-羟甲基-2-呋喃甲醛(HMF)下调,这是因为葡萄进入成熟期后,蔗糖会降解成葡萄糖和一个非常活跃的呋喃果酰基阳离子,这种阳离子可以有效地直接转化为HMF,因此受水环境影响造成的蔗糖量降低可能是造成HMF代谢物下调的主要原因[21]。
植物果实成熟期间,丙酮酸作为葡糖异生作用的前体,转化为糖及能量[22],本研究表明,低水分、中水分处理下的差异代谢物丙酮酸均显著下调,且显著富集于糖酵解/糖异生、磷酸盐与磷酸盐代谢、D-丙氨酸代谢、丙酮酸代谢等8个主要途径,说明葡萄转色期丙酮酸是最活跃的代谢物,这在多项研究中得到证实[23-24]。本研究在低水分对比高水分对比组中发现差异代谢物丁酸显著上调,可能是丙酮酸经氧化脱羧产生的乙酰CoA 与磷酸作用,生成乙酰磷酸,再在乙酸激酶催化下产生的乙酸造成。与低水分处理不同,中水分对比高水分中差异代谢物3-苯丙氨酸首先显著富集于苯丙氨酸代谢途径,苯丙氨酸可作为果实中酚类合成的前体,合成葡萄2-苯乙醇[25],表明转色初期中水分处理下葡萄有关香气的物质会大量产生。
4 结论
1)在西北地区,延迟栽培模式下,采用增加土壤水分措施能明显延迟葡萄成熟时间,缩短葡萄成熟与采摘的时间间隔,更能体现“鲜”的特色,效益更高。
2)葡萄转色前增加土壤水分能降低葡萄合成糖、香气、色素的一些代谢物,增加有机酸与保持细胞壁结构的一些代谢物量,延缓了葡萄成熟进程。
3)丙酮酸是葡萄转色期最活跃的代谢物。
