镉胁迫对南瓜植株镉吸收积累及光合特性的影响
2020-12-28陈碧华郭卫丽孟凡茹周俊国李新峥申可
陈碧华,郭卫丽,孟凡茹,周俊国,李新峥,申可
(1.河南科技学院园艺园林学院,河南新乡453003; 2.新乡市牧野区农业农村局,河南新乡453003)
0 引言
【研究意义】土壤镉(Cd)污染目前已经成为农业面源污染热点问题之一,Cd 主要来源于汽车尾气、工业排放、农业生产中农药及化肥残留等[1-2]。徐笠等[3]研究显示设施蔬菜基地土壤中重金属迁移能力最强和危害系数最大的是Cd。大棚菜田土壤中Cd 已构成了严重污染[4]。当Cd 进入植物的组织、细胞中,会干扰细胞的正常生理代谢[5],破坏植物叶绿素与蒸腾作用[6],导致生长紊乱甚至死亡。当Cd 超过一定质量浓度后,会影响蔬菜的食用安全[7]。【研究进展】Cd 在植物体内的分布趋势为根>茎>叶>籽实,根对Cd的累积占总量的70%~80%,籽实只占1%~10%,但是烟草及某些蔬菜如胡萝卜叶片含Cd 量高于根部[8]。Cd 在植株中亚细胞分布顺序为:细胞壁>可溶部分>细胞核[9-10]。Cd 在花椰菜叶片中亚细胞分布顺序为:细胞质>细胞壁>叶绿体和线粒体[7]。可见Cd 集中分布在细胞壁和细胞质中就可能避免重金属损害植物功能性相对重要的组织如细胞器,这正是重金属植物能解毒的原因[8]。植物细胞壁的固定和细胞液的区间隔化作用能使重金属在植物体内积累,而蛋白质和多肽等物质也能与重金属结合,也使重金属滞留植物体内[11]。所以研究重金属元素在植物体内的亚细胞分布,有助于解释植物对重金属富集和解毒机制[9]。
【切入点】目前设施蔬菜主要是通过嫁接克服连作障碍问题[12-15]。大棚黄瓜栽培中常用的嫁接砧木是南瓜,可有效地防止土传病害的发生,而针对南瓜的耐镉性研究少见报道。【拟解决的关键问题】本试验旨在研究镉胁迫下南瓜植株中镉的积累、转运、亚细胞分布以及光合特性分析,进一步揭示南瓜对重金属镉的富集特征和毒性机理,为大棚黄瓜耐镉砧木的筛选提供科学依据。
1 材料和方法
1.1 试验材料
供试材料为大棚黄瓜嫁接砧木‘盐砧一号’(由河南科技学院南瓜课题组提供)。试验时间为2018年9月,试验地点为河南科技学院园艺植物栽培实验室。试验采用基质栽培,基质按草炭、蛭石、珍珠岩质量比为3∶1∶1的比例配置,加三元复合肥 1kg/m3,多菌灵0.2kg/m3对基质进行消毒,使基质含水率达到70%,基质中含镉量为0 mg/L。
试验设置4个处理,分别加不同量的Cd(以CdSO4的形式加入):0(对照)、2、4、6 mg/L,每个处理设置4次重复,每个塑料小黑方(7cm 口径)装配好基质0.00027m3。将催过芽的南瓜种子播种于基质中,覆膜保温保湿。在种子出苗2 片子叶展平并露出真叶时,添加不同质量浓度Cd 进行胁迫处理,分别用移液枪浇到植株根系附近10mL,每5 天处理1次,共处理4次,植株长至4 片叶收获。将南瓜植株分为根系、茎、叶片分别洗净、晾干。为了除掉南瓜根系表面吸附的Cd,将南瓜根系先用纯水冲洗干净,再用20mmol/LNa2-EDTA 交换处理20min,然后用去离子水清洗干净,并吸干表面水分。植物鲜样置于-20℃冰箱中保存备用。试验用水均为超纯水。
1.2 测定分析方法
1.2.1 南瓜植株中Cd 质量浓度的测定
采用微波消解-ICP-AES 技术测定,将南瓜植株的根系、茎、叶片干样分别剪碎,称取0.2g 烘干样品于聚四氟乙烯消解罐中,依次加入硝酸8 mL、高氯酸2 mL,混合均匀加密封盖后至于MAS 微波消解仪(美国CEM 公司)内,设置最佳微波消解程序进行消解。消解结束后消解液为无色澄清透明,无沉淀,样品消解完全。待消解罐冷却后,把消解液用0.2%的稀HNO3转移到50 mL 聚四氟乙烯烧杯中,置于电热板170℃赶酸至近干。以除去多余的氮氧化物,加入2 mL 0.2% HNO3溶解残渣,最后转移到25 mL 容量瓶中(GG-17 玻璃),定容摇匀后转移到聚乙烯塑料瓶中,用Optima 2100 DV 电感耦合等离子体发射光谱仪(美国Perkin Elmer 公司)测定重金属Cd 全量。试验结果为3次重复试验的平均值。
1.2.2 南瓜植株中亚细胞组分分离与分析
按照侯明等[16]的方法,分别称取南瓜植株根系、茎、叶片等鲜样2.0g,分别加入20mL 提取液[0.25 mmol/L 蔗糖、50 mmol/LTric-Hcl 缓冲液(pH7.5)和1 mmol/L 二硫代苏糖醇],在冰浴中用玛瑙研钵研磨成匀浆,匀浆液放置在超速冷冻离心机中,将离心机温度设定为4℃,600 转速下离心10min,下层沉淀碎片为细胞壁以及未破碎残渣。移取上层悬浮液放置4℃超速冷冻离心机中,1000 转速下离心15min,沉淀为细胞核,上清液在10000 转速下离心20 min,沉淀为细胞器(线粒体和叶绿体);上清液为细胞质(核蛋白和可溶性组分)。采用ICP-AES 技术测定各组分Cd 质量浓度。
1.2.3 Cd 胁迫下南瓜植株叶片光合特性
使用LI-6400 型便携式光合仪进行测定。选择晴朗无风天气,于上午09:00-10:00 测定叶片气体交换参数。每小区选取3株生长均匀健康的植株,每株选取自顶端向下的叶片,重复3次,取平均值。设定光合有效辐射为1000μmol/(m2∙s),使用开放式气路,空气流速为500μmol/s,测定南瓜的净光合速率、气孔导度、蒸腾速率和胞间CO2量。
1.3 数据处理
转运系数(Translocation factor,TF)是指植物地上部与根部重金属量的比值,用来表示植物体对重金属从根部到地上部的有效转移程度[17],计算公式参照Tanhan et.al的方法[18]:TF=地上部Cd 质量浓度(μg/g)/地下部Cd 质量分数(μg/g)。根系对重金属的富集系数(Bioconcentration factor,BCF)=根部Cd 质量分数(μg/g)/土壤中Cd 质量分数(μg/g)[19]。试验结果运用SPSS 和Excel 2010 进行数据统计与分析。采用Duncan 多重比较法对显著性差异(p<0.05)进行多重比较。
2 结果与分析
2.1 Cd 在南瓜植株各器官中的积累和分布
南瓜植株不同器官中Cd 质量浓度见表1。由表1可知,当Cd 质量浓度从2 mg/L 增加到6 mg/L,Cd在南瓜植株根中质量浓度增加幅度远大于茎和叶,从1.86mg/kg 增加到5.95 mg/kg,与对照相比存在显著差异(p<0.05)。Cd 在茎和叶中的质量浓度随着Cd处理质量浓度的增加逐渐增加,茎和叶中富集的Cd较少;Cd 胁迫质量浓度愈高,南瓜植株根部积累的Cd 就愈多。
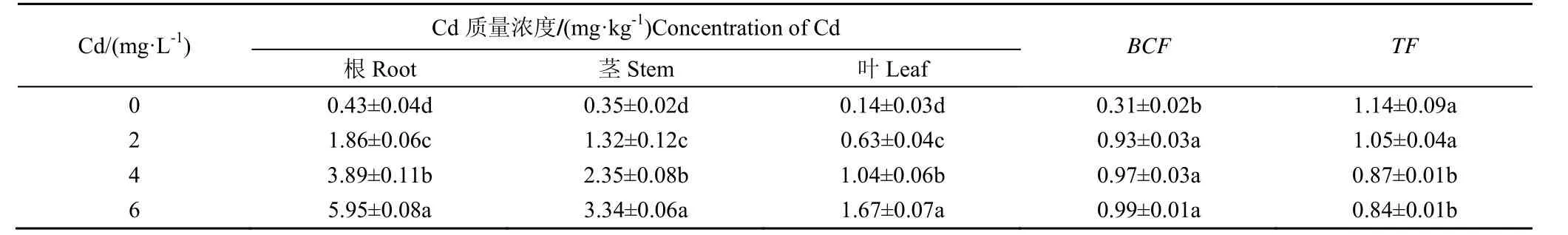
表1 南瓜植株不同器官中Cd 质量浓度Table1 Cd mass concentration in different organs of pumpkin
随着Cd 胁迫质量浓度增大,根富集系数BCF值呈上升趋势。当Cd 胁迫质量浓度达6mg/L,南瓜植株中Cd的BCF值最大为0.99。说明随着Cd 质量浓度增大,南瓜植株富集Cd的能力增强,也就是说当环境中Cd 质量浓度越高,向南瓜植株根部迁移的能力越强,使根部吸收富集能力增强,从而导致在高质量浓度Cd 胁迫下南瓜植株的富集系数BCF较高。随着镉胁迫质量浓度的增大,转运系数TF值从2 mg/L的1.05 逐渐降低到6mg/L的0.84,表明随着Cd 胁迫质量浓度的增大南瓜植株把Cd 从根部转移到茎和叶的能力逐渐减弱。

图1 南瓜植株根茎叶中Cd所占比例Fig.1 Proportion of Cd in roots,stems and leaves of pumpkin
根据Cd 在南瓜植株不同器官中的质量浓度,计算出Cd 在南瓜植株各器官中所占比例,如图1所示。由图1可知,随着Cd 胁迫浓度的升高,Cd 在南瓜根系中的质量浓度显著升高,在茎和叶中的质量浓度随着Cd 胁迫质量浓度的增加而下降,表明南瓜植株吸收的Cd 大部分积累在根部,转移到茎和叶中的较少,这有利于减轻土壤Cd 对植株特别是叶片的毒害效应。Cd在南瓜植株不同器官中的质量浓度分布为根>茎>叶。
2.2 Cd 在南瓜植株不同器官中的亚细胞分布
表2为各处理南瓜植株不同器官亚细胞Cd质量浓度。由表2可知,Cd在不同器官的亚细胞分布呈不均匀状态,其中根系中以细胞壁中质量浓度最高,占总量的47.63%~57.69%;其次为细胞质;细胞器中的Cd质量浓度最少,仅占1.93%~4.59%。Cd胁迫质量浓度增加,叶片中Cd质量浓度和各亚细胞的Cd质量浓度显著增加,其中,叶片Cd质量浓度比低质量浓度增加了1.19倍,细胞壁Cd质量浓度增加了1.31倍,细胞质Cd质量浓度增加了1.43倍,细胞器Cd仅增加0.25倍。说明随着Cd胁迫质量浓度提高,表现为Cd向细胞壁积累增加,而向其余组分积累相对减少。

表2 不同Cd胁迫南瓜植株不同器官亚细胞中Cd质量浓度及分配率Table2 Cd mass concentration and percent distributions of different concentrations of Cd in subcellular fractions of pumpkin

表3 南瓜叶片中总Cd质量浓度与各亚细胞组分之间的相关性Table3 Correlation analysis between the mass concentration of total Cd in pumpkin leaves and subcellular fractions
2.3 南瓜叶片中总Cd 质量浓度与各亚细胞组分之间的相关性
表3为叶片中总Cd 质量浓度与各亚细胞组分Cd质量浓度间的相关分析。由表3可以看出,在0~6mg/LCd 处理范围内,南瓜叶片总Cd 质量浓度与细胞壁Cd 质量浓度极显著正相关,与细胞质Cd 质量浓度显著正相关,与细胞器Cd 质量浓度、细胞核Cd质量浓度呈正相关,但相关性不显著;细胞壁Cd 质量浓度与细胞质Cd 质量浓度之间存在显著正相关,与细胞器、细胞核Cd 质量浓度之间呈正相关,但相关性不显著;细胞质Cd 质量浓度与细胞器、细胞核Cd 质量浓度之间呈正相关,但相关性不显著;细胞器Cd 质量浓度与细胞核Cd 质量浓度之间呈正相关,但相关性不显著。
2.4 Cd 胁迫下南瓜植株光合特性分析
南瓜植株光合指标见表4。由表4可知,Cd胁迫没有对南瓜植株净光合速率(Pn)造成显著抑制作用。2 mg/L处理抑制了气孔导度(Gs)和蒸腾速率(Tr),限制了光合作用的过程,但是由于处理时间比较短,并未影响净光合速率,4 mg/L和6 mg/L处理叶片气孔导度分别降为0 mg/L处理的64.20%和39.51%,而蒸腾速率降为0 mg/L处理的60.25%和45.34%,差异显著;但各处理胞间CO2摩尔分数(Ci)未见显著差异。

表4 不同Cd 胁迫下南瓜植株光合指标Table4 Effects of different mass concentration Cd stress on pumpkin photosynthesis
3 讨论
3.1 南瓜植株体内Cd 运转及抗性
Cd 在南瓜植株不同器官的分布表明,Cd 在南瓜植株根中质量浓度远大于茎和叶,而Cd 在南瓜茎和叶片中的质量浓度随着Cd 胁迫质量浓度的增加逐渐增加,南瓜茎和叶中Cd 富集较少;这在辣椒[20]、生菜[21]等蔬菜早已得到证实。当环境中Cd 胁迫质量浓度愈高,南瓜植株根部积累的Cd 就愈多。根富集系数BCF值呈上升趋势,当环境中Cd 质量浓度越高,向南瓜植株根部迁移的能力越强。转运系数TF值逐渐降低,表明随着Cd 胁迫质量浓度的增大南瓜植株把Cd 从根部转移到茎和叶的能力逐渐减弱。这为解释Cd 在南瓜植株叶片中质量浓度较低提供了有力证据。
3.2 Cd 胁迫下南瓜植株光合作用的亚细胞水平分析
相关分析显示,叶片细胞壁Cd 质量浓度与叶片总Cd 质量浓度之间呈显著正相关关系,说明根吸收的Cd 向上运输至叶片细胞壁中累积。其中2 mg/L 处理显著抑制了气孔导度(Gs)和蒸腾速率(Tr),从而影响到光合作用,但由于Cd 胁迫时间较短,未能影响净光合速率,4 mg/L 和6 mg/L 处理叶片气孔导度(Gs)和蒸腾速率(Tr)显著下降。从亚细胞水平分析,Cd 胁迫没有导致南瓜的光合作用降低,是因为Cd 在细胞壁中大量累积造成的。植物对Cd 胁迫有一定的适应机制,可能通过调整Cd 在亚细胞组分中的分配实现[23]。细胞壁中Cd 质量浓度占绝对优势,而细胞器和细胞核中Cd 质量浓度最低,Cd 胁迫质量浓度增加,Cd 在细胞壁中增加幅度大于细胞质。
4 结论
1)Cd 在南瓜植株中的富集特征表现为:根中Cd质量浓度远大于茎和叶并且随着Cd 胁迫增强,根富集系数BCF值呈上升趋势,转运系数TF值逐渐降低。
2)根系中亚细胞分布特征为:细胞壁中Cd 质量浓度占总量的47.63%~57.69%;其次为细胞质;细胞器中仅占1.93%~4.59%。
3)Cd 胁迫没有对南瓜植株净光合速率(Pn)造成显著抑制作用。
