小黄鱼♀与大黄鱼♂杂交子代及其双亲IGF-1基因的表达差异分析
2020-12-26高松柏
高松柏,刘 峰,2,詹 炜,2,楼 宝,2
(1.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021;2.浙江省农业科学院水生生物研究所,浙江杭州 310021)
类胰岛素样生长因子(insulin-like growth factor,IGFs)是一类进化上保守的多肽,因其在结构功能上与胰岛素类似被称为IGFs[1]。IGFs 在许多组织中都可以合成,在生物体中具有调节合成代谢、促进细胞的分化和分裂、抑制细胞凋亡以及调控生长发育和生殖过程等多种功能[2-5]。在鱼类中,IGF 主要在肝脏中合成,在其他的一些组织器官中也有表达,通过自分泌和旁分泌方式释放[6]。研究表明,IGF-1 对鱼类具有生长调节的作用,并且通过影响血浆渗透压、离子浓度、鳃丝Na+/K+-ATP 酶活性等参与渗透压调解[7]。近几年来,IGFs 基因的研究已经在许多鱼类中进行,如大黄鱼Larimichthys crocea[8]、哲罗鲑Hucho taimen[9]、金鱼Carassius auratus var.[10]、大西洋鲑Salmo salar[11]、大菱鲆Scophthalmus maximus[12]、金钱鱼Scatophagus argus[13]、黄颡鱼Pelteotagrus fulodraco[14]等。
大黄鱼L.crocea 和小黄鱼L.polyactis 是我国重要的海水经济鱼类,营养丰富,肉质鲜美,深受广大消费者喜爱。但是,由于过度捕捞、环境变化等原因,大黄鱼的野生资源极其稀少,其养殖群体品质下降,经济效益明显降低[15];小黄鱼性早熟、日趋小型化现象日益明显[16,17],在小黄鱼的养殖过程中,发现养殖群体同样存在个体小型化的现象。因此,对两种鱼进行遗传改良意义重大。杂交育种是一种重要的遗传改良技术手段之一[18],我们实验室通过人工控温、控光及营养强化等方法促使小黄鱼和大黄鱼亲鱼性腺发育同步,采用人工催产授精的方式进行小黄鱼雌鱼与大黄鱼雄鱼的种间杂交,成功获得杂交F1 代个体[19]。研究发现,15 月龄时,生长速度大于小黄鱼而小于大黄鱼,由此可知,在生长方面,杂交子代表现出了杂种优势[20]。虽然杂种优势的形成很大程度上取决于杂交F1 代的基因及其互作,但必须经过转录和表达为蛋白质后才能对性状起作用。SUN Ying,et al[21]研究指出GH/IGF 生长轴与杂交F1 优势性状的形成具有明显联系。
为探讨小黄鱼与大黄鱼杂交子代与双亲在生长相关性状的基因差异表达,本次研究通过荧光定量PCR 技术检测了IGF-1 基因在3 种鱼15 月龄时不同组织中mRNA 表达差异情况,从分子水平上研究杂交子代与亲本之间在生长性状上的变化,进而探讨IGF-1 基因与杂交F1 表现出的杂种优势的相关性。本次研究将为杂交F1 杂种优势研究提供基础数据,也为从基因水平的遗传育种提供参考。
1 材料与方法
1.1 实验材料
实验所用大黄鱼、小黄鱼和杂交子代个体取自浙江省海洋水产研究所试验场。3 种鱼在相同的养殖环境下进行培育。养殖至15 月龄时,选取形态、体色均正常、健康无伤的3 种鱼,雌雄个体各5 尾,测定体质量(g)后,冰冻致死,快速解剖取脑、肝脏和肌肉组织置于RNA 保存液保存,备用。
1.2 实验方法
1.2.1 总RNA 提取和cDNA 第一链合成
采用TransZol 法提取各组织总RNA。利用NanoDrop 2000 测定RNA 浓度以及OD260/280,并通过1.5%琼脂糖凝胶电泳检测其完整性。利用gDNA Remover(全式金,中国)去除基因组DNA,cDNA 第一链合成利用5×TransScript All-in-One SuperMix for qPCR 反转录酶(全式金,中国) 在eppendorf nexus PCR 仪(Eppendorf,德国)完成。反应程序85 ℃15 min,10℃5 min。
1.2.2 引物设计
参考大黄鱼(登录号:NM_001303334.1)、小黄鱼(小黄鱼基因测序结果注释获得)的IGF-1 CDS 序列,以β-actin 作为内参,用Primer Premier 6 软件设计荧光定量特异性引物,所用引物由金维智生物技术有限公司合成,引物序列见表1。

表1 IGF-1 qPCR 引物序列Tab.1 qPCR primer sequences of IGF-1
1.2.3 PCR 产物测序和分析
利用用于荧光定量的引物对3 种鱼进行PCR 扩增,验证扩增产物的差异性,使用2×EasyTaq PCR SuperMix (+dye)试剂(全式金)分别以3 种鱼的肝脏组织cDNA 为模板,反应体系按照试剂说明配置,反应程序为94 ℃预变性5 min;94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸1 min,循环35 次;72 ℃延伸5 min;10 ℃保存。PCR 产物送至金维智生物科技公司进行测序获得3 种鱼的目的片段。
利用Clustalx 软件对杂交子代与大黄鱼和小黄鱼的PCR 产物序列进行比对分析,使用DNAMAN 8 软件预测氨基酸序列并进行序列同源性分析。
1.2.4 IGF-1 基因的表达量测定
使用实时荧光定量PCR 方法测定IGF-1 基因表达量,反应体系25 uL,包括2×TransStart Tip Green qPCR SuperMix(全式金)12.5 μL、正反向引物各0.5 μL、cDNA 模板2 μL、ddH2O 9.5 μL。反应条件为:94 ℃预变性30 s,94 ℃变性5 s,60 ℃退火30 s,循环40 次,10 ℃保存。
1.3 数据处理
荧光定量实验结果利用Step-one software 软件读取(包括目的基因与内参基因β-actin),用2-ΔΔCT法表示目的基因的相对表达量,数值均用平均数±标准差(Mean±SE)表示。利用SPSS 20.0 软件对各组中基因相对表达量进行单因素方差(One way ANOVA)分析,以P<0.05 为差异显著。
2 结果
2.1 15 月龄3 种实验鱼体质量比较分析
对取样实验鱼体质量进行了统计分析,结果列于表2。如表所示,15 月龄时,3 种鱼体质量由高到低为大黄鱼>杂交子代>小黄鱼。大黄鱼和杂交子代雌雄性之间体质量差异显著(P<0.05);小黄鱼雌雄性个体之间差异不显著(P>0.05)。

表2 15 月龄3 种实验鱼体质量比较分析Tab.2 Comparison of body weight for the three fish at 15 months of age
2.2 扩增产物序列的生物信息学分析
2.2.1 杂交子代和亲本PCR 产物对比分析
PCR 扩增产物经测序和序列拼接后,使用Clustalx 和DNAMAN 8 软件比对杂交子代和亲本PCR 扩增获得的DNA 序列,结果显示,小黄鱼和大黄鱼IGF-1 基因序列同源性100%,说明IGF-1 基因在近亲物种中具有非常强的保守性;杂交F1 与两者的同源性均为96.29%,说明所用特异引物在杂交子代中扩增获得的确实为IGF-1 基因序列,同时也可发现两种物种杂交产生的后代存在一定的遗传变异(图1)。

图1 杂交鱼与亲本IGF-1 基因cds 序列对比Fig.1 Comparison of nucleotides between hybrid fish and parent IGF-1 gene CDs sequence
2.2.2 IGF-1 基因表达的氨基酸序列对比
通过DNAMAN 8 软件预测PCR 产物序列编码氨基酸序列,结果显示,大黄鱼和小黄鱼PCR 扩增产物序列编码氨基酸数量均为124 个,杂交子代中编码氨基酸123 个。通过比对分析得知,小黄鱼和大黄鱼PCR 扩增产物序列编码氨基酸序列相似度100%,杂交F1 与大黄鱼、小黄鱼的PCR 扩增序列编码的氨基酸残基共有9 个不相同,序列相似度为92.74%,说明IGF-1 基因氨基酸序列在鱼类中具有一定的保守性,同时也可发现两个物种的杂交子代出现了一定的遗传变异,此结果与DNA 序列分析结果相一致(图2)。
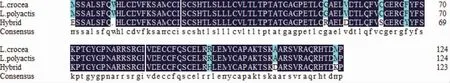
图2 IGF-1 基因表达的氨基酸序列对比Fig.2 Comparison of amino acid sequences expressed by IGF-1 gene
2.3 IGF-1 基因表达量分析
2.3.1 同种鱼不同组织中IGF-1 基因mRNA 表达量的比较分析
为了比较IGF-1 基因在雌雄个体之间的表达差异,以雄性个体为参照,对3 种鱼3 个组织的IGF-1基因表达量进行统计分析并作图3。从图中可以看出,大黄鱼肌肉组织中IGF-1 基因表达量在雌雄个体之间差异不显著;脑和肝脏中IGF-1 基因表达量表现为雌性显著大于雄性。小黄鱼和杂交鱼的肌肉、脑和肝脏组织中IGF-1 基因表达量均表现为雌性个体显著大于雄性个体。
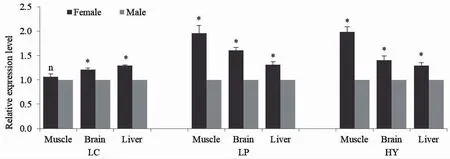
图3 IGF-1 基因在大黄鱼(LC)、小黄鱼(LP)和杂交子代(HY)中的雌雄表达差异Fig.3 IGF-1 expression differences between male and female in L.crocea (LC),L.polyactis(LP) and hybrids (HY)
为了比较不同组织之间IGF-1 基因表达差异,以肝脏组织表达量为对照,分别比较大黄鱼、小黄鱼和杂交F1 个体3 种组织中IGF-1 基因的表达差异,结果如图4 所示。从图中可以看出,3 种鱼不同组织间IGF-1 基因mRNA 表达量差异显著(P<0.05),均表现为:肝脏>脑>肌肉。其中,大黄鱼雌性个体中,3 种组织均存在显著差异,而雄性个体中肌肉与肝脏组织表达量差异显著(P<0.05),脑组织与肌肉和肝脏差异均不显著(P>0.05);小黄鱼雌性个体中肝脏和脑组织中IGF-1 基因mRNA 表达量差异不显著,两者显著大于肌肉,雄性个体中3 个组织之间差异显著;杂交子代雌性和雄性个体不同组织中IGF-1 基因表达量呈显著差异(P<0.05)。
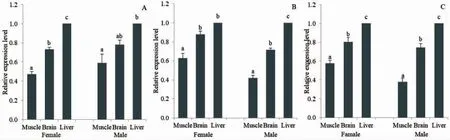
图4 大黄鱼(A)、小黄鱼(B)和杂交F1(C)不同组织中IGF-1 基因mRNA 表达量的比较分析Fig.4 Comparative analysis of IGF-1 gene expressions of L.crocea,L.polyactis and their hybrids in different tissues
2.3.2 3 种鱼同一组织IGF-1 基因表达量的比较分析
以杂交F1 的组织表达量作为参照,分析3 种鱼相同组织中IGF-1 基因表达量差异,结果如图5 所示。从图中可以看出,3 个组织中3 种鱼的IGF-1 基因表达量均存在显著差异,其中,小黄鱼的表达量均为最高,杂交子代表达量次之(除了雄性个体的肌肉组织)。两两比较发现,肌肉中,杂交子代雌性基因表达量显著小于小黄鱼,显著大于大黄鱼(P<0.05);雄性个体中小黄鱼和大黄鱼基因表达量差异不显著,均显著大于杂交子代(P<0.05)。脑中,杂交子代雌性个体基因表达量与大黄鱼差异不显著,均显著小于小黄鱼(P<0.05);雄性个体中,杂交子代基因表达量显著低于小黄鱼,但是显著高于大黄鱼(P<0.05)。肝脏中,杂交子代雌性个体基因表达量显著低于小黄鱼,但是显著大于大黄鱼(P<0.05);雄性个体中,小黄鱼基因表达量显著高于大黄鱼(P<0.05),而杂交子代介于两者之间且差异均不显著。
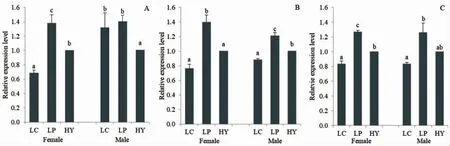
图5 3 种鱼肌肉(A)、脑(B)和肝脏(C)IGF-1 基因表达量的比较分析Fig.5 Comparative analysis of expression of IGF-1 gene in muscle,brain,and liver of three fish
3 讨论
IGF-1 基因在脊椎动物中广泛存在[22-23],具有调节分裂分化、胚胎发育、生长等功能[24-25]。本次研究对小黄鱼、大黄鱼及其杂交子代的IGF-1 基因cDNA 序列PCR 扩增获得的序列进行了对比分析,结果显示,大黄鱼和小黄鱼的产物序列完全一致,而杂交子代与双亲的同源性均为96.29%,表明近缘物种之间IGF-1基因的同源性较高,具有一定的保守性的同时也存在部分变异。此结果在其他鱼类中也有相关报道,如黄鳍鲷Acanthopagrus latus 与牙鲆Paralichthys olivaceus 的同源性为86.5%,与黑鲷Acanthopagrus schlegelii的同源性为100%[26],岩原鲤Procypris rabaudi 与鲤鱼Cyprinus carpio、鲮鱼Cirrhinus molitorella、黑鲷及斑马鱼Barchydanio rerio 的同源性均在95%以上[27]。报道指出,对于不同的物种的不同组织,IGF-1 基因表达量存在一定的差异[28-29]。在本次对15 月龄的小黄鱼、大黄鱼及其杂交子代IGF-1 基因表达量进行了测定分析中,同样得出,3 种鱼的IGF-1 基因表达量存在显著差异,其中,小黄鱼的IGF-1 基因表达量高于大黄鱼,除了雄性个体的肌肉组织,其余组织均达到显著水平。
鱼类IGF-1 主要由肝脏合成,在其他的一些组织器官中也有表达[30,31]。陶敏等[32]研究日本白鲫Carassius cuvieri IGF-1 基因组织表达发现,在肝脏、肌肉和脑3 个组织中,肝脏中基因表达量最高,其次是肌肉和脑。钱焜等[33]研究发现花鲈Lateolabrax japonicus 的肝脏是IGF-1 基因表达量最高的场所,肌肉和脑次之。本实验通过对3 种鱼的肌肉、脑和肝脏组织进行IGF-1 基因表达量测定,发现IGF-1 基因在3 个组织中均有一定量的表达,不同组织之间表达量具有明显的差异,其中,肝脏是3 种鱼体内IGF-1 含量最多的组织器官,其次是脑和肌肉,研究结果与上述报道结果相一致。比较3 种鱼可得出,小黄鱼各组织IGF-1 基因表达量均最高,杂交F1 的表达量除了雄性肌肉中的表达量之外,均大于大黄鱼的基因表达量。基因表达量的分析结果与体质量的分析结果对比发现,基因表达量的排序(小黄鱼>杂交子代>大黄鱼)与本次研究中体质量的排序(大黄鱼>杂交子代>小黄鱼)以及刘峰等[20]报道的结果,均存在较大差异,即3 种鱼的生长速度与IGF-1 基因表达量不成正相关关系,主要原因可能是生长性状除了受到IGF-1 基因的影响,还受到其他生长相关基因的调控,并且IGF-1 基因本身也还受到GH/IGF 轴的调控[34-36]。本次研究结果再次证明了基因与性状不是一一对应的关系[37-38],因此,除了在DNA 水平上探讨位点杂合性及互作方式与杂种优势的关系外,还应从杂交种与亲本在基因表达调控等方面来探讨杂种优势的遗传机理。
