高海拔头痛发生与其生理、生化指标变化的相关性研究
2020-12-25刘小书
刘小书
(成都市温江区妇幼保健院检验科,四川成都 611130)
高原地区空气稀薄,当人体急速进入海拔3 000 m以上高原时,易产生头痛、失眠等不适症状,严重者伴有呼吸困难,在初入高原地区人群中非常常见[1-2],严重影响了人民生活、地方建设及国防保障等。头痛是高原反应最常见的症状,常为前额和双颞部跳痛,夜间或早晨起床时疼痛加重[3-4]。国际头痛协会将高海拔头痛(HAH)定义为进入高海拔地区24 h内出现,且在离开高海拔地区后8 h内自动消退的头痛[5]。报道显示,当人体突然进入到海拔2 500 m以上地区后,24 h内HAH的发生率为20%~90%[6]。HE等[7]发现HAH与海平面网织红细胞和中性粒细胞计数有关。红细胞作为循环系统中氧气的主要载体,在血液的带动下,可将氧分输送到全身各处,在维持机体氧分平衡过程中发挥着重要作用,因此,血液学参数可为HAH的防控与诊断提供参考。为此,本研究对比观察44例健康志愿者3 d内由低海拔地区上升至3 890 m的高海拔地区后的生理、生化指标变化,以探索血液生理、生化指标与HAH的关系,为HAH预防新策略提供参考。
1 资料与方法
1.1一般资料 选取2018年1月1日至2019年8月31日长期居住于低海拔地区(≤1 000 m)的44例健康志愿者作为研究对象,其中男25例,女19例;平均年龄(21.87±3.33)岁;所有研究对象均在3 d内搭乘汽车进入高海拔地区(3 890 m),以是否确诊HAH为标准,分为HAH+组(33例)与HAH-组(11例),对比其进入高海拔地区前后生理、生化指标。本研究中,所有研究对象均签署知情同意书,且本研究通过医院伦理审查。HAH的诊断按国际头痛分类第三版进行。纳入标准:年龄18~26岁,性别不限,经健康体检无外伤、无疾病人群。排除标准:年龄>26岁或<18岁者;临床资料不全者;患有心脑血管、神经或精神疾病,发作性或慢性偏头痛疾病,自身免疫性疾病,呼吸系统疾病,肿瘤,肝肾功能异常,活动性感染或重感冒的人群。
1.2方法 在进入高海拔地区前后,对所有研究对象生命体征进行密切观察。生理指标检测:由2名独立的专业医生重复测量2次,收集研究对象静息时的心率(HR)、收缩压(SBP)、舒张压(DBP)和血氧饱和度(SpO2),并计算平均值。使用标准的水银血压计测量SBP和DBP,使用Nellcor NPB-40(美国)测量SpO2。生化指标检测:采用肝素钠真空分离采血管抽取清晨空腹静脉血4 mL,通过全自动生化仪(日立-7020,日本)及其配套试剂进行血液生化指标检测,2 h内完成检测。生化参数包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、血尿素氮(BUN)、血清肌酐(Cr)、总血清胆红素(TBIL)、直接血清胆红素(DBIL)和间接血清胆红素(IBIL)。抽血过程中注意操作规范,保证血液标本无溶血、凝血等情况。实验所有检测项目参考值均参照国家统一标准。
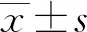
2 结 果
2.1进入高海拔地区前后受试者生理、生化指标比较 急性暴露于高海拔地区后,大多数受试者生理、生化指标发生了明显变化。生理检测中,SpO2从98.20%(97.80%~98.20%)降至88.00%(85.20%~90.10%),差异有统计学意义(P<0.001),而HR、SBP和DBP明显升高,差异有统计学意义(P<0.001)。从生化指标检测结果来看,ALT、AST、Cr、TBIL和DBIL水平明显升高,IBIL水平明显降低,差异均有统计学意义(P<0.05),而BUN水平差异无统计学意义(P>0.05)。见表1。

表1 高海拔地区和低海拔地区受试者生理、生化指标比较(n=44)
2.2HAH+组和HAH-组受试者生理、生化指标比较 在低海拔地区时,HAH+组与HAH-组比较,除BUN指标外,其余指标差异均无统计学意义(P>0.05)。进入高海拔地区后,44例受试者中有75%发生HAH,生理、生化指标分析表明,HAH+组中的SpO2、SBP、BUN水平均低于HAH-组,而HAH+组的HR明显高于HAH-组,差异有统计学意义(P<0.05)。DBP、ALT、AST、Cr、TBIL、DBIL、IBIL水平等指标差异均无统计学意义(P>0.05)。见表2。
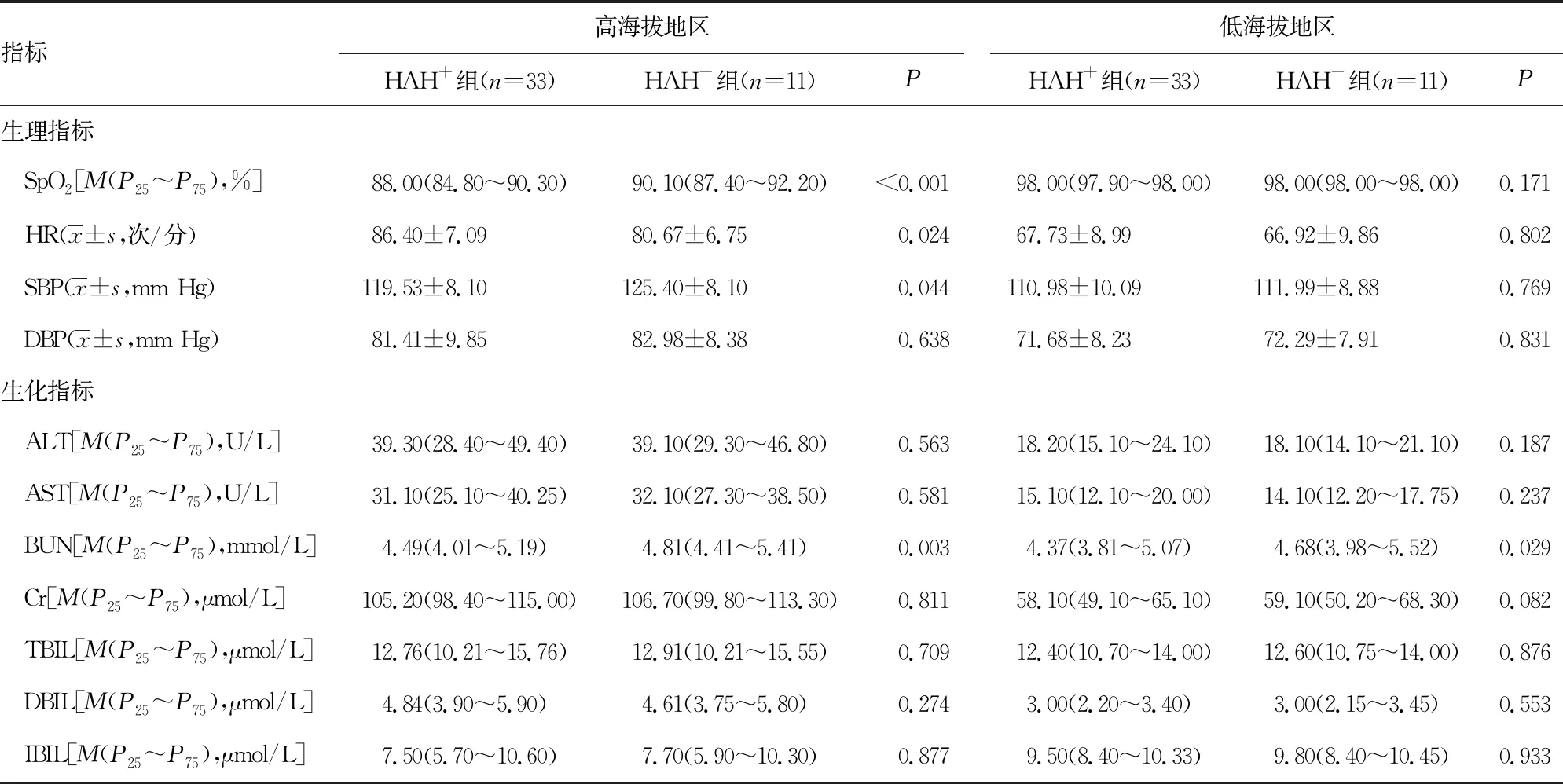
表2 HAH+组和HAH-组受试者生理、生化指标比较
2.3低海拔和高海拔地区影响HAH发病的单因素及多因素分析 在低海拔地区的结果中,单因素分析显示,只有BUN与HAH明显相关(OR=0.77,95%CI:0.60~0.98,P=0.044)。在高海拔地区的结果中,SpO2(OR=0.83,95%CI:0.76~0.90,P<0.001)、HR(OR=1.04,95%CI:1.02~1.07,P=0.004)及BUN(OR=0.71,95%CI:0.54~0.92,P=0.012)均与HAH明显相关,见表3。对所有参数进行多因素Logistic回归分析,结果表明,在高海拔地区,SpO2(OR=0.85,95%CI:0.77~0.94,P<0.001)、HR(OR=1.04,95%CI:1.01~1.08,P=0.041)及BUN(OR=0.64,95%CI:0.46~0.88,P=0.007)均与HAH明显相关,SpO2、HR 和BUN均是HAH的危险因素,见表4。
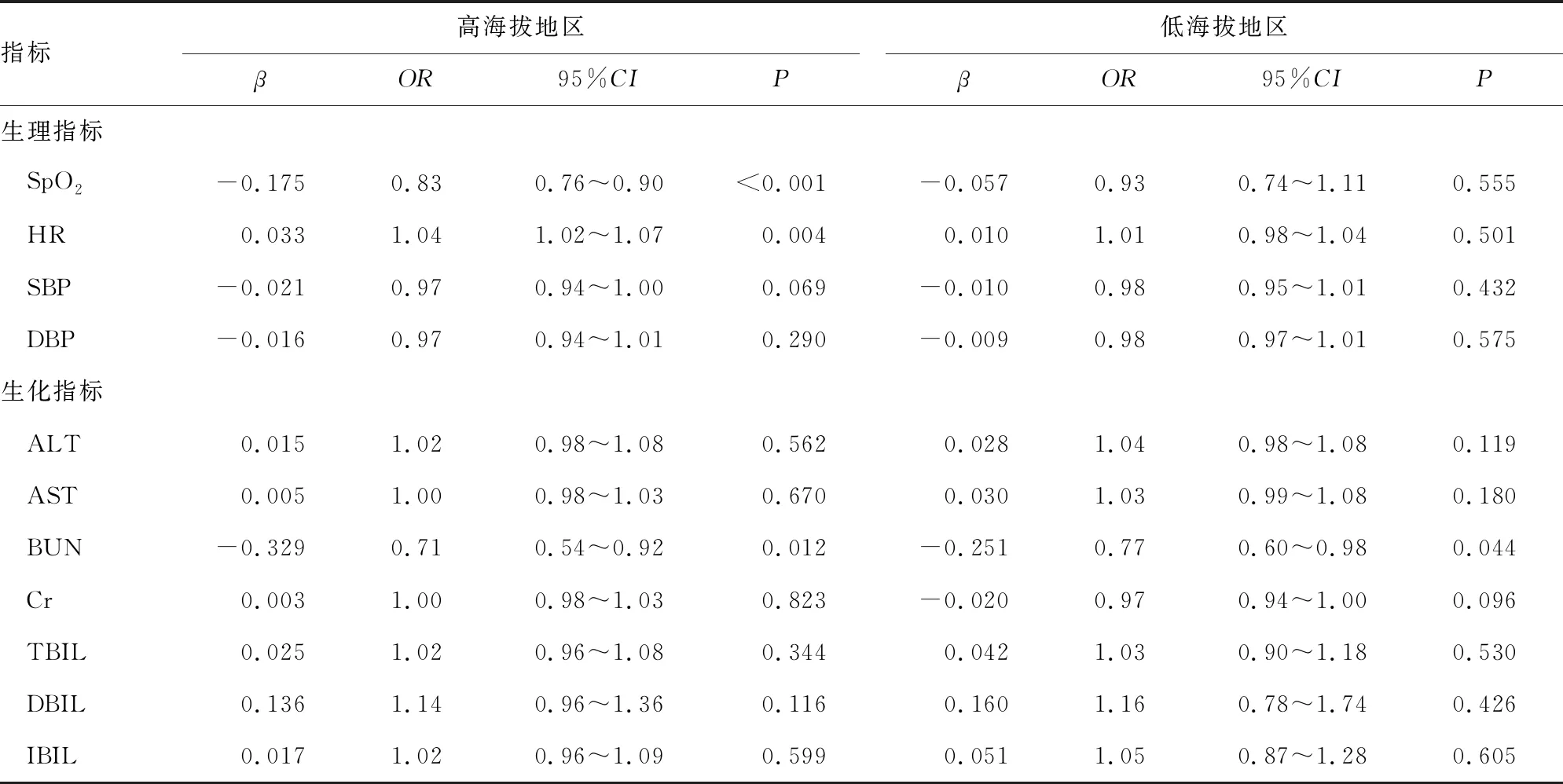
表3 在不同海拔地区影响HAH发病的单因素分析
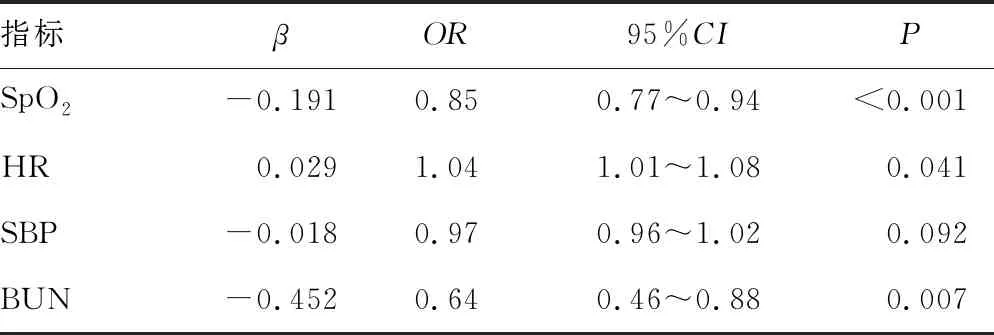
表4 高海拔地区影响HAH发病的多因素分析
3 讨 论
近年来随着经济的发展和旅游业等的兴起,HAH发病率持续递增,俨然成为影响进入高海拔地区人群身心健康的公共问题之一。尽管可通过缓慢进入高海拔地区的方式预防HAH发生,但个体差异、海拔高度、进入时间及方式、气象条件等诸多因素仍可能导致HAH的发生。进入高海拔地区后,人体的各项生理、生化指标会在多重因素的影响下发生变化,探寻生理、生化指标与HAH发生的关系对疾病预防、治疗和监测具有重要价值。
本研究分析了从低海拔到3 890 m高海拔地区后,44例受试者的生理、生化指标变化。结果显示,高原缺氧导致SpO2降低,从而向器官组织输送的氧气和能量减少,血氧水平下降刺激颈动脉化学感受器并激活自主神经系统,心输出量改善,最终导致HR升高[8],本研究结果与之前的研究结果一致[9]。随着海拔升高,人体吸入空气中的氧气分压降低,可引起供给脑组织的氧气不足而导致功能障碍和细胞毒性水肿的发生,这是HAH发生的主要原因[10]。此外,研究结果中HAH+组HR升高反映了交感神经系统的活动,使心输出量增加及内脏血管收缩加剧,从而促进血液的再分配(主要进入大脑等重要器官)。大脑中积聚的液体导致颅内压升高,这是诱发HAH的另一个重要原因[11]。有研究表明SpO2降低和HR升高是HAH的两个独立危险因素[12-13],本研究结果也支持这一观点。
此外,笔者还发现BUN与HAH明显相关。其原因分析如下。(1)尿素水平可反映细胞中的氧气供应和利用。在高海拔地区,BUN的产生可能受高海拔环境的影响,并且BUN水平可部分反映代谢状态和肝细胞的氧利用状况。有体外实验研究表明,在低压缺氧条件下,多种细胞系中的ATP均降低,并且随着氧气浓度的降低,离体大鼠肝细胞中两种尿素的产量均下降[14]。这些发现提示,血浆中的BUN水平可能反映了肝细胞氧驱动的分解代谢,甚至脑细胞的氧气供应和利用率。(2)尿素的高渗特性可能有助于降低颅内压和脑容量[15]。早在上世纪60年代,尿素便成为临床上第一种广泛使用的高渗性化合物,可降低颅内压并减轻脑肿胀[16]。因此,外源尿素可以维持脑细胞内外一定的渗透压,并防止过多的液体积累和脑肿胀。(3)尿素循环会产生半衰期短的一氧化氮,其迅速扩散到血管平滑肌中,会影响钙离子的调节,从而导致血管扩张[17],这对缓解肺动脉高压,改善心排血量和血气交换具有重要作用。杨卫波等[18]针对急性肾损伤在急性高原病发病过程中的差异研究中发现,肾损伤的严重程度与急性高原病的类型密切相关,肾损伤常见于重症急性高原病患者,高原脑水肿研究组BUN水平明显高于高原肺水肿组和急性轻型高原病组,与本研究结论相似。整体而言,其发生机制可能是高原低氧应激性引起交感神经-肾上腺髓质系统活性增强,导致血管紧张素释放增加、肾小动脉收缩、肾血流灌注不足,从而引起BUN水平的升高。因此,BUN可能可以作为一个判断HAH发生、发展潜在的参考指标。
4 结 论
综上所述,在急性暴露于高海拔地区后,HAH发生与多种因素相关,其中SpO2和HR是HAH在高海拔地区发生时的独立危险因素,同时较低水平的BUN在高海拔地区发生HAH的过程中也扮演着重要角色,可认为是HAH发生的另一种独立危险因素。本研究结果可为指导HAH预防、治疗和监测提供有力支撑,具有重要临床价值。
