棕榈酸诱导小鼠骨髓来源巨噬细胞M1型极化①
2020-12-25张焱皓刘芊伊冯继红刘利萍罗军敏
张焱皓 刘芊伊 冯继红 李 茂 刘利萍 秦 欢 罗军敏
(遵义医科大学免疫学教研室,贵州省免疫分子应用研究工程中心,遵义563003)
巨噬细胞是组织动态平衡和炎症反应中的关键细胞,发挥基本的组织特异性功能并保护机体免受感染。巨噬细胞因所处微环境中细胞因子、微生物及其产物和其他刺激物极化为特定表型,根据刺激物的不同,IFN-γ激活的巨噬细胞被定义为经典激活型巨噬细胞(M1),IL-4激活为替代激活型巨噬细胞(M2),且M2型巨噬细胞可细分为M2a、b、c[1-3]。M1型巨噬细胞具有促炎特性,高表达炎症细胞因子如TNF-α、IL-6、IL-12、诱导型一氧化氮合酶(inducible nitric oxide synthase 2,iNOS或NOS2)等,具有杀灭病原体及抗肿瘤功能;而M2型巨噬细胞膜表面高表达CD206,分泌大量转化生长因子-β(transforming growth factor-β,TGF-β)、IL-10、炎症区域分子1(found in inflammatory zone 1,Fizz1)、类几丁质酶3样分子3(chitinase 3-like 3,Chi3L3或YM-1)等细胞因子,可促进细胞增殖和组织修复[4]。受病原体及肿瘤微环境影响,巨噬细胞以M2型为主,分泌抑炎细胞因子,发挥免疫抑制作用,导致病原菌感染或肿瘤进展。因此,调控免疫抑制状态下巨噬细胞的极化表型尤其重要。棕榈酸(palmitic acid,PA)是脂肪生成过程中产生的脂肪酸。研究表明中草药中也含有PA,在昆仑雪菊花中PA占比达9.71%,在黄蜀葵子中占比约为5.88%,在猫爪草中占比为2.64%[5-7]。陈冬梅等[8]发现党参中提取的PA具有免疫活性,作用于TNF及IL-10发挥免疫调节作用。大量研究表明,PA是一种致炎能力极强的脂肪酸,常用于构建体外脂毒性损伤模型[9-11]。因此作为中草药中常见的单体成分,有必要了解PA对机体免疫细胞的功能影响,明确其作用机制。本研究通过将PA配制为水溶液,将其直接加入细胞培养基中,检测巨噬细胞极化相关标志物的动态变化,观察BMDM受诱导后的极化表型,并探讨PA诱导巨噬细胞M1型极化的机制。
1 材料与方法
1.1材料 6~10周龄雌性BALB/c小鼠购于重庆市第三军医大学医学实验动物中心,并饲养于本实验室清洁级动物房。PA购于Sigma公司,纯度≥99%。小鼠重组GM-CSF购于NOVUS。RNAisoTMPlus、PrimeScriptTMRT Reagent Kit(RR037A)、SYBR Premix Ex Taq Real-time PCR 购于TaKaRa。Cell Counting Kit-8购于东仁化学科技(上海)有限公司。分析纯氯仿、异丙醇、无水乙醇等购于重庆川东化工公司。DMEM低糖培养基购于Gibco,胎牛血清购于MRC。引物购于上海生物工程有限公司。APC 标记的抗小鼠 CD11b 抗体(cat.no.17-0112-82,eBioscience)、FITC标记的抗小鼠F4/80 抗体(cat.no.11-4801-82,eBioscience)、APC标记的抗小鼠CD206 抗体(cat.no.17-2061-82,eBioscience) 和PE标记的抗小鼠Nos2抗体(cat.no.25-5920-82,eBioscience)购于赛默飞。Anti-JNK(No.9252s)、 Anti-p-JNK(No.4668s)、 Anti-NF-κB(No.8242s)、Anti-p-NF-κB(No.3033s)一抗购于CST。anti-p38 MAPK(No.ab197348)、anti-ERK(No.196883)、anti-AKT(No.ab8805)、anti-phospho ERK(No.ab50011)、anti-phospho AKT(No.ab81283)、anti-phospho p38-MAPK(No.ab47363)、anti-GAPDH(No.ab181602)、Anti-Lamin B1(No.ab16048)及anti-IKBα(No.ab32518) 一抗购于Abcam。Anti-rabbit Ab conjugated to HRP(No.7074s) 二抗购于CST。
1.2方法
1.2.1小鼠骨髓来源巨噬细胞(BMDM)的获取 无菌条件下取BALB/c小鼠胫骨和腓骨细胞置于含有10%胎牛血清、20 ng/ml GM-CSF的DMEM低糖培养基中,37℃、5% CO2条件下培养7 d,流式细胞术检测骨髓细胞F4/80和CD11b双阳性比率。
1.2.2PA脂性培养基配置 称取0.04 g NaOH溶于10 ml ddH2O配置成浓度为0.1 mol/ml的NaOH溶液用于后续实验,称取0.1 g PA置于9 ml NaOH溶液中,75℃水浴加热30 min。称取1.2 g BSA于55℃预热的3 ml PBS中,8 000 r/min离心20 min。向 75℃的PA、NaOH混合液中加入BSA溶液,摇匀后55℃助溶30 min。细菌过滤器过滤后紫外照射30 min 灭菌。
1.2.3CCK8检测巨噬细胞活性 将PA以100、300、400和500 μmol/ml刺激小鼠BMDM 24 h后,收集培育7 d的BMDM于离心管,计数,以 1∶ 2比例依次采用DMEM等比稀释为至少3个细胞浓度梯度,接种于96孔板,每组设3~6个复孔。孵育箱培养24 h 使细胞贴壁,10 μl/孔加入CCK 8试剂,孵育4 h后于450 nm处测定OD值,并绘制标准曲线。
1.2.4RT-PCR检测细胞因子表达 收集样品,TRIzol提取RNA,按照TaKaRa说明书构建10 μl逆转录体系,反应条件为37℃ 15 min,85℃ 5 s,逆转录为cDNA。构建20 μl反应体系,95℃ 10 min,95℃ 15 s;60℃ 30 s,39个循环。引物序列见表1。
1.2.5流式细胞术检测巨噬细胞NOS2和CD206表达 收集细胞于EP管,加入流式抗体4℃避光孵育 30 min。 洗去未结合的抗体后流式细胞术检测。
1.2.6Western blot检测MAPK通路相关蛋白表达 提取细胞核蛋白。全蛋白提取按照如下操作:加入含有蛋白酶抑制剂、磷酸酶抑制剂和PMSF 的Lysis Buffer于细胞培养板中,细胞刮刀刮取细胞并制备蛋白;测定各组总蛋白浓度后,加入上样缓冲液制备样品,电泳、转膜、脱脂奶粉封闭、洗膜,加入一抗孵育过夜,加入二抗,ECL化学发光试剂曝光。

2 结果
2.1PA对小鼠BMDM的影响 与未处理组相比,当PA浓度为400 μmol/ml时,对小鼠BMDM活性无影响,且为诱导巨噬细胞的最大浓度。以此浓度作为诱导巨噬细胞极化的浓度进行后续实验,见图1。
2.2PA对小鼠BMDM形态的影响 M0细胞呈椭圆形,400 μmol/L PA诱导24 h后,细胞呈长梭形且伪足细长,与M1巨噬细胞形态一致。表明PA可能诱导巨噬细胞M1型极化,见图2。
2.3PA对小鼠BMDM细胞因子表达的影响 与未处理组相比,PA诱导巨噬细胞后,M1型相关细胞因子mRNA水平在0~72 h上调,其中IL-6 mRNA水平在诱导36 h后达到峰值,IL-12 mRNA水平在12 h后达到峰值,iNOS mRNA水平在48 h后达到峰值,而TNF-α mRNA水平在24 h后达到峰值。PA诱导后M2型相关细胞因子表达下调,且YM-1、IL-10在被诱导后12 h出现低转录状态,TGF-β出现于24 h,而Fizz1出现于36 h。表明在PA诱导后,小鼠BMDM上调M1型相关细胞因子转录,同时下调M2型相关细胞因子转录,提示PA可能具有诱导巨噬细胞M1型极化的作用,见图3。
2.4PA对小鼠BMDM NOS2及CD206表达的影响 PA诱导后,F4/80+NOS2+细胞占比明显上升,且于36 h达到峰值。 PA诱导组F4/80+CD206+细胞比例虽然在24 h时显著上升,但诱导48 h后,CD206表达恢复至未处理组水平,表明在PA诱导后,巨噬细胞向M1型极化,见图4。

表1 引物序列
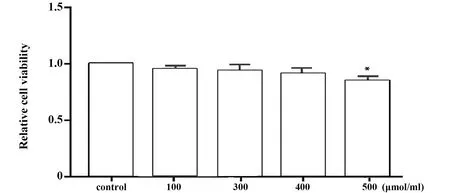
图1 PA对小鼠BMDM活性的影响Fig.1 Effect of PA on mice BMDM viabilityNote:Compared with control group,*.P<0.05.

图2 PA对小鼠BMDM形态的影响Fig.2 Effect of PA on BMDM morphology of mice
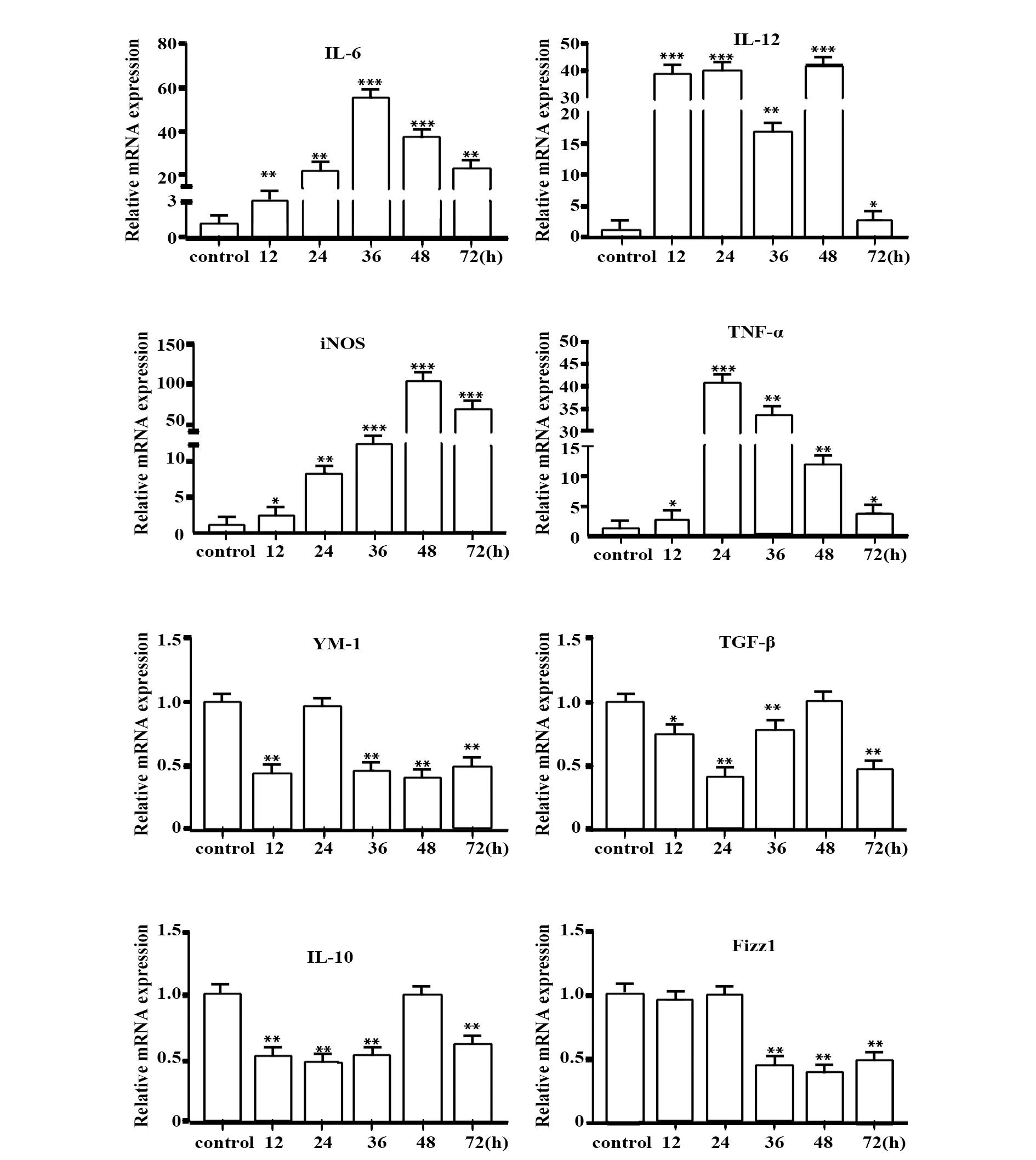
图3 PA对小鼠BMDM促炎细胞因子和抑炎细胞因子转录水平的影响Fig.3 Effect of PA on transcriptional levels of pro-inflammatory cytokines and anti-inflammatory cytokines in BMDM of miceNote:Compared with control group,*.P<0.05,**.P<0.01,***.P<0.001.

图4 PA对小鼠BMDM NOS2和CD206表达的影响Fig.4 Effect of PA on expression of NOS2 and CD206 in BMDM of miceNote:Compared with untreated group,*.P<0.05,**.P<0.01,***.P<0.001.
2.5Western blot检测MAPK信号通路相关蛋白的表达 诱导后15 min胞质中呈现p-ERK、p-JNK及p-p38表达,胞核中呈现p-NF-κB表达,30 min时达到峰值,而IKBα相比于其15 min时表达降低,60 min 时p-ERK、p-JNK、p-p38及p-NF-κB有少量表达,而无IKBα表达。说明PA通过MAPK信号通路诱导巨噬细胞M1型极化,见图5。
3 讨论
巨噬细胞具有极强的可塑性,可极化为不同表型。M1型巨噬细胞可产生促炎细胞因子,促进炎症发展,杀伤病原体及肿瘤细胞。而M2型巨噬细胞释放抑炎细胞因子,抑制炎症反应,参与组织修复,介导肿瘤免疫逃逸。因此调控巨噬细胞极化在疾病防治中具有重要意义。近年大量研究报道了中草药对巨噬细胞极化的影响,中草药活性成分通过诱导巨噬细胞极化治疗疾病。PA是大部分中草药的主要成分。虽然已有研究报道PA可作为巨噬细胞TLR4的配体诱导机体产生炎症细胞因子,但其诱导巨噬细胞极化后表型的鉴定及相关机制研究尚未明确[12]。
本研究从形态学出发观察到PA诱导后巨噬细胞形状呈梭型,形似M1型巨噬细胞。为验证其表型变化,检测巨噬细胞极化相关标志物的表达情况,发现相较于未处理组,PA诱导后M1型相关细胞因子TNF-α、IL-6、IL-12和iNOS在0~72 h的转录水平升高数十倍,而M2型相关细胞因子TGF-β、IL-10、Fizz1和YM-1的转录表达受到抑制,说明巨噬细胞转变为促炎表型。研究表明NOS2可作为巨噬细胞M1型极化的标志物[13]。本研究检测F4/80+NOS2+巨噬细胞双阳性细胞比例结果显示,相较于未处理组,PA诱导6 h后,NOS2表达上调,72 h时F4/80+NOS2+双阳性细胞比例为16.3%,处于较高水平。为进一步验证巨噬细胞的极化表型,本研究检测了M2型极化标志物CD206表达[14]。结果显示,虽然F4/80+CD206+双阳性细胞比例在PA诱导24、36 h时明显上升,但随着诱导时间推移,F4/80+CD206+双阳性比例下降至未处理组水平,因此推测CD206表达上调的原因可能是在PA的刺激下所激活的通路引发CD206表达,但随着PA诱导时间推移,引发促炎细胞因子的正反馈刺激,巨噬细胞逐渐向M1型转化,CD206表达也随之下降,说明PA具有诱导巨噬细胞M1型极化的能力。
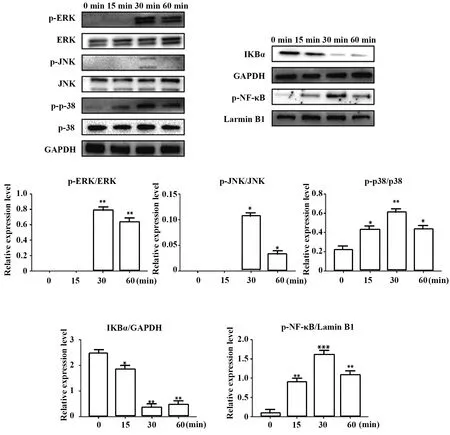
图5 PA对小鼠BMDM JNK/P38 MAPK信号通路的影响Fig.5 Effect of PA on JNK/P38 MAPK signaling pathway in mouse BMDMNote:Compared with 0 min group,*.P<0.05,**.P<0.01,***.P<0.001.
巨噬细胞的极化过程涉及多种经典的信号通路,而MAPK信号通路尤其重要[15]。MAPK信号通路可将信号传导给核因子κB(nuclear factor-κB,NF-κB),导致巨噬细胞M1型极化[16]。本研究检测了PA对该信号通路的影响,加入PA后15 min,检测到p-ERK、p-JNK,p-p-38表达,并通过提取核蛋白发现p-65入核。在诱导后30 min,p-ERK、p-JNK及p-p-38表达明显上调,p-65在核蛋白中高表达。诱导后60 min 仍然可观察到MAPK信号通路的信号传递。大量研究表明只有当NF-κB和IKBα解聚后,其核定位序列暴露,才能被转运至细胞核内促进NF-κB依赖的基因转录,因此检测IKBα表达作为验证,结果显示IKBα的表达与NF-κB相反,进一步证明PA通过MAPK信号通路导致p-65入核,激活NF-κB,诱导巨噬细胞M1型极化。
PA是中草药中的主要组成部分,但其对机体细胞功能的影响常常被忽略。目前研究发现,PA可通过激活库普弗细胞炎症小体导致非酒精性脂肪性肝炎进展[17]。此外,PA可作用于迁移抑制因子导致胰岛细胞功能紊乱和凋亡[18,19]。但Boubaker等[20]发现PA可阻碍可移植肿瘤发展,并提高荷瘤小鼠的脾细胞增殖率及宿主巨噬细胞溶酶体活性,发挥抗肿瘤作用。总之,在不同疾病中PA可能对疾病的转归发挥不同的作用。近年来中草药的活性成分在疾病治疗中发挥重要作用,而巨噬细胞的极化是疾病治疗的切入点,因此了解PA对巨噬细胞极化的影响将有助于中草药的开发和利用。
