围产期不同时期性激素及炎性因子水平变化对抑郁状态的影响
2020-12-25张雪丽陈静杨凤姣夏光源邹涛
张雪丽,陈静,杨凤姣,夏光源,邹涛
(1.贵州医科大学附属医院 精神科,贵州 贵阳 550001; 2.临沂市精神卫生中心 精神科,山东 临沂 276002)
孕产期是女性患抑郁症的高危时期,DSM- V将孕期至产后4周内出现的症状称为围产期抑郁(perinatal depression,PND),而世卫组织将危险期延长至产后12个月。目前认为PND指在妊娠期或产后1年内发生的一种轻微或严重的抑郁障碍,包括妊娠期抑郁和产后抑郁[1- 3]。PND普遍存在,人群的发病率为10%~15%[4]。众所周知,严重精神障碍给社会造成了一定的危害,但PND所造成的社会危害也不容忽视, PND患者容易变得敏感、多疑、神经质,可能出现伤害自身的行为,PND加重甚至会出现伤婴、杀婴及自杀的严重危险行为[5]。
越来越多的学者对PND发病机制产生了浓厚的兴趣,研究者作了大量探索,证明PND发生的原因与产妇的生物学因素、心理因素和社会环境等有关。生物学因素主要包括孕期体内神经内分泌激素的剧烈变化,如雌激素、孕激素、皮质醇水平,下丘脑- 垂体- 肾上腺轴(HPA轴)的改变等等,随着对精神免疫学研究的深入,在基因、分子以及细胞水平上形成了多种假说,其中包括激素、神经递质以及炎性因子之间存在密切联系,对机体免疫、应激与炎症反应起到关键作用,其发病机制尚未阐明[6]。Leffgelman等[7]研究表明,PND也是一种免疫炎症反应。
雌二醇(estradiol,E2)是最重要的雌激素,其不仅参与了机体的生殖发育及相关活动,还参与了调节情绪反应、认知、学习记忆、行为等中枢神经系统相应功能,与精神神经系统疾病有重要关系。何青等[8]研究表明,E2水平在孕早期、孕晚期、产后1周和产后42 d 4个时间点,抑郁组和非抑郁组之间差异有统计学意义,并提示低雌激素水平及其孕期波动可能与PND发生相关。孕酮(progesterone,P)在生物体内也具有神经活性,对神经递质系统起到调节作用,进而对情绪变化、学习、记忆等产生影响。脱氢表雄酮(dehydroepiandrosterone,DHEA)同雌激素的关系密切,研究发现脱氢表雄酮硫化物(dehydroepiandrosterone sulfide,DHEA- S)也涉及应激相关反应,对调节神经系统和免疫稳态有重要作用。学者们发现DHEA可通过影响γ- 氨基丁酸(γ- aminobutyric acid,GABA)受体来影响情绪,高水平的DHEA可调节糖皮质激素,从而减少焦虑失眠症状[9]。Schiller等[10]综合许多学者的研究后提出产后抑郁的波动易感促发模式,认为抑郁症状的发作与分娩时E2和P水平的快速变化(撤退)相关,对激素撤退敏感、易感的女性才容易发生产后抑郁症状。
孕妇在9个多月的妊娠期间,来自孕早、中、晚期不同阶段的应激源所致妊娠反应是有所不同的,而产后抑郁的发作与免疫相关疾病在病因上有相似之处。其中血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体- 1(vascular endothelial growth factor receptor 1,VEGFR- 1)、胎盘生长因子(placental growth factor,PLGF)与抑郁症发生机制的研究越来越受到人们的关注[11- 15],但有关研究PND与炎性因子方面的文献报道甚少。
目前对PND的发生机制仍然存在许多问题尚未解决。从妊娠到产后的各个时期激素的变化与抑郁最终产生有何联系?炎性因子在PND的发生中会起作用吗?是否和激素共同作用影响PND的发生?因此,本研究在前期研究的基础上继续进行相关研究,探讨围产期不同时点性激素及炎性因子水平变化对孕产妇抑郁状态的影响。
1 资料与方法
1.1 一般资料
本研究纳入2016年12月至2017年12月在贵州医科大学附属医院产科门诊进行保健,并且妊娠期及产后愿意配合的孕产妇。本研究纳入标准:既往个人及家属无精神病史及无精神活性物质滥用史,围产期无严重器质性疾病、内分泌系统疾病(如甲亢、心脏病、糖尿病、肝病等)及免疫系统疾病。初中以上文化程度,能正确理解量表内容以便能顺利进行评定。对孕早期(11~12周末)、孕中期(24~27周末)、孕晚期(37周~分娩前)、产后(42~48 h)进行4次筛选评估。
采用的量表为一般情况调查表:在产科及精神心理科专家的指导下,参阅大量文献制定相关调查情况,于孕早期第1次填写该表,用来了解患者的社会人口学资料和既往健康状况。抑郁情况采用爱丁堡产后抑郁量表(Edinburgh postnatal depression scale,EPDS)进行评估:该量表是目前被广泛应用的量表,内容包括10个项目,有心境、情绪、乐趣、悲伤、自责、抑郁、哭泣等条目,得分越高抑郁程度越重。研究发现,当EPDS得分≥9分为临界值筛查产后抑郁时,其灵敏度是88%,特异度是50%[16]。当EPDS得分≥13分为临界值时,适用于重度抑郁患者的筛查,而轻度或重度程度的抑郁患者可以以9或者10分为临界值[17]。所以本研究以EPDS得分≥9分为临界值跟踪筛查围产期抑郁状况。
1.2 方法
1.2.1 研究时期和分组方法 在孕早期(11~12周末)、孕中期(24~27周末)、孕晚期(37周~分娩前)、产后(42~48 h),采用一般情况调查量表、EPDS对所有参加研究的孕产妇进行追踪量表评分,以EPDS得分≥9分为临界值评出抑郁和非抑郁情况,从整个围产期分组时,以4个时期中至少出现1次EPDS得分≥9分为标准,出现1次EPDS得分≥9分为PND组,EPDS得分<9分为非PND组。跟踪调查期间,转至外院产期保健、流产、早产、孕产期出现其它内科系统疾病等的孕产妇排除研究对象之外。
1.2.2 检测指标及检测方法 检测各时期血清E2、P、DHEA、VEGF、VEGR- 1、PLGF的水平。追踪采取前3次的上午9:00左右及产后42~48 h空腹肘静脉血5 ml,静置凝固20 min,离心20 min(3 000 r·min-1、4 ℃)分离出血清,密封保存于-80 ℃冰箱中待检。统一采用ELISA方法测定,经稀释、加样、配液、洗涤、显色、测定等步骤测出孕产妇血清E2、P、DHEA、VEGF、VEGR- 1、PLGF的水平。
1.3 统计学处理
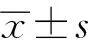
2 结 果
2.1 围产期各个时期的抑郁发生情况
最终完成量表测定及样本采集的研究对象共37人,其中完成4次完整样本测定的25人,3次的11人,2次的1人(因样本处理时受损)。根据临界值将各时期进行分组,分别为孕早期抑郁组(9人)、孕早期非抑郁组(27人);孕中期抑郁组(11人)、孕中期非抑郁组(26人);孕晚期抑郁组(12人)、孕晚期非抑郁组(24人);产后抑郁组(4人)、产后非抑郁组(30人)。得出围产期各个时期的抑郁发生情况:孕早期抑郁的发生率是25.0%,孕中期为29.7%,孕晚期为33.3%,产后为11.8%。本研究结果同既往报道[18- 21]相符。
2.2 PND组和非PND组间性激素和炎性因子水平比较
37名孕产妇中,PND组19人,非PND组18人。PND组和非PND组相比,4个时期所测各指标差异均有统计学意义(均P<0.05)。见表1。

表1 两组不同时期各指标间的相互比较
PND组各指标水平均在孕晚期最高,其中E2、P、DHEA、VEGF、PLGF水平与孕早期及孕中期各自水平比较差异具有统计学意义,VEGFR- 1水平同孕早期水平比较差异具有统计学意义(P<0.05)。PND组P、DHEA、VEGF、PLGF水平在孕晚期最高,其中P、VEGF、PLGF水平与孕早期及孕中期各自水平比较差异具有统计学意义,DHEA水平仅与孕中期比较差异有统计学意义(P<0.05)。E2、VEGFR- 1水平在产后最高,E2水平与孕早期及孕中期E2水平比较差异具有统计学意义(P<0.05)。见表2。
孕晚期PND组E2水平为(207.72±23.71)pg·ml-1,非PND组E2水平为(190.72±24.42)pg·ml-1,PND组高于非PND组,两组间比较差异有统计学意义(t=-2.138,P=0.041)。该时期其它各指标两组间比较差异均无统计学意义(P>0.05)。见表2。
从表2和图1对比得出:各指标水平随时间不断波动变化,在各个时间存在水平差异,这种波动变化可能对PND的发生存在一定影响。(1) E2、P水平PND组较非PND组波动范围大,特别是在孕晚期时达到最高峰,与孕早期存在明显差异。P水平非PND组与孕早期及孕中期水平比较差异均有统计学意义。(2) DHEA、PLGF水平非PND组较PND组波动范围大,在孕晚期达到最高峰,但PND组晚期水平与孕早期、孕中期比较差异均有统计学意义,非PND组只与孕早期比较差异有统计学意义。(3) VEGF水平PND组和非PND组在产前波动范围不大,但在产后PND组波动较大,产后两组水平较孕早期及孕晚期有差异。(4) VEGFR- 1水平在整个围产期时间和组间存在交互作用,当PND组水平升高时非PND组水平反而下降,在整个围产期存在波动。
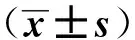
表2 PND组和非PND组不同时期各指标比较
2.3 不同时期各指标与EPDS得分的相关性分析
将每名孕产妇EPDS评分总得分以及该时期所测得的E2、P、DHEA、VEGF、VEGFR- 1、PLGF的值互相作相关性分析,孕晚期E2水平与EPDS得分具有相关性(r=0.361,P=0.042),两者呈正相关,即E2水平越高EPDS得分就越高。见表3。
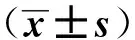
表3 各时期各指标与EPDS得分的相关性分析
2.4 孕晚期各指标与E2水平的关系
孕晚期E2水平和EPDS得分具有相关性(r=0.361,P=0.042),故将E2水平作为因变量,其余各指标水平作为自变量,行相关线性回归分析,结果表明,孕晚期VEGF、PLGF水平与E2水平之间有相关性(P<0.05),VEGF水平和E2水平呈负相关(r=-0.353),PLGF水平和E2水平呈正相关(r=-0.659)。见表4。
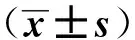
表4 孕晚期E2水平与其它各指标的关系
3 讨 论
本次研究发现,各检测指标在4个时期均存在差异,但PND组或非PND组各指标在不同时期两两比较时却不同,说明各指标在不同时期波动范围不同。既往关于雌孕激素对PND影响的研究结果不一致,李春晓[22]研究表明产后抑郁情绪的发生与产后雌孕激素含量的变化呈正相关关系,并由此推测产后抑郁的发生与产后雌孕激素的剧烈下降有一定关系。而何艳琼[23]则认为,产前产后E2和P水平与PND的发生并没有关系。国外研究结果也不一致,Osborne等[24]研究发现,孕中期P水平每增加1 ng·ml-1,患产后抑郁的可能性降低63%。而Jahangard等[25]研究表明,产前12周的低P和高DHEA水平可作为产后抑郁的生物学标记[25]。因此,我们推测出现这种不同结果的原因和Schiller提出的产后抑郁波动易感促发模式相关。
本研究从激素随时间波动变化图上看出,在孕晚期,PND组E2水平升高较非PND组较高较快,也提示妊娠期雌激素水平波动范围越大抑郁发生的可能性就越大。并且国外研究也发现,即使围产期各激素在正常范围内,其激素在整个围产期的波动也是促发易感人群发生抑郁的原因之一[26- 28]。通过我们前期陈静等[29]对产前产后激素变化与抑郁相关性的研究也发现,在分娩前48 h抑郁组的雌激素水平高于非抑郁组,推测产后性激素水平下降过快是产后抑郁发病的可能原因之一。因在孕晚期各种激素达到最高峰,且伴随着发生率的提高,因此我们推测孕晚期可能是PND的高发时期。
本研究发现VEGF、PLGF、VEGFR- 1水平的高低与EPDS评分均没有相关关系。由此认为其与抑郁的发生可能没有关系。因既往对VEGF与抑郁发生关系的研究常限于对抑郁动物模型的研究,临床研究甚少且结论不一致,对PND的有关研究目前还未见报道。
本研究通过对孕晚期雌激素和其它指标相关分析结果表明:VEGF与E2呈负相关,PLGF与E2呈正相关。既往分别对性激素及炎性因子与抑郁情绪变化的研究[30- 32]较多,但对两者是否共同作用引起情绪变化的研究甚少。有研究[30]表明,雌激素被认为是体液免疫的增强子,可对细胞的生长分化、炎症反应的发生和进展等起到一定影响,但具体的作用机制还未完全明确。必须指出的是,雌激素具有潜在的促炎作用。雌激素β受体被选择性抑制后,促炎症反应基因的转录进而也被抑制,提示了雌激素β受体选择性抑制剂具有一定的抗炎作用[31]。孕激素可以通过结合免疫细胞内受体从而调节某些特定基因表达,参与免疫系统的调节。雌孕激素具有协同作用,共同对免疫系统进行调控。从基因层面也有研究报道,雌激素可以通过 ERE基因使VEGF的表达上调,从而使VEGF水平升高[32]。而从VEGF对神经可塑性方面来讲,其对大脑神经的保护性降低,进而引起抑郁的发生。
综上所述,性激素与炎性因子在围产期不同时期存在波动,对PND的发生可能有影响,在孕晚期,E2水平越高PND发生的可能性越大。
