烟酰胺类辅酶依赖型氧化还原酶的辅酶偏好性改造及其在合成生物学中的应用
2020-12-24刘美霞李强子孟冬冬魏欣蕾游淳
刘美霞,李强子,孟冬冬,魏欣蕾,游淳
(1中国科学院大学,北京100049;2中国科学院天津工业生物技术研究所,天津300308)
氧化还原酶是目前已报道酶中数量最大的酶类[1]。在体外合成生物学和生物代谢工程中,氧化还原酶被广泛用于生产生物燃料、氨基酸、手性醇类、胺类、酮酸、抗生素以及天然产物等多种有机物[2-6]。氧化还原酶所催化的反应中通常需要辅酶作为转移电子、氢负离子、氢气、氧气或者其他小分子的中介体[2,7]。典型的辅酶包括烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)、泛醌(ubiquinone,CoQ)、黄素辅因子(flavin mononucleotide,FMN/flavin mononucleotide,FAD)等。其中,80%的氧化还原酶为NAD依赖型,只有10%的氧化还原酶依赖NADP进行氢负离子(H+和2e-)的转移和储存。这两个辅酶在结构上的区别非常小,NADP只是比NAD多了一个磷酸基团[图1(a)]。在微生物体内和体外合成生物学中,严格辅酶偏好型氧化还原酶的失配将会导致辅酶不平衡[8],工业生产中一旦辅酶的消耗和供应无法匹配,目的产物的产量和生产速率将大大降低,因此辅酶的供应、消耗以及其平衡对工业生产至关重要[9-10]。
蛋白质工程作为生物技术中一个强有力的工具[11],常用于构建高稳定性、高酶活性、强特异性、高立体选择性、广底物谱的工程酶[12]。利用蛋白质工程改造氧化还原酶对天然辅酶偏好性从而实现天然辅酶平衡,已成功用于工业菌发酵并使产物产量接近理论值[13]。仿生烟酰胺辅酶由于成本低、稳定性高[14]、扩散快(空间体积相对较小)[15]、电子传递速度快[16]等优势,可代替天然辅酶NAD(P)参与氧化还原反应。将氧化还原酶辅酶偏好性从天然辅酶NAD(P)到仿生烟酰胺辅酶的改造将进一步降低应用成本[17-18]。此外,NAD(P)广泛参与生物体内复杂的新陈代谢网络,因此对生物体内某一个或某一类氧化还原酶的功能的研究和调控较为困难。基于仿生烟酰胺辅酶的生物正交系统可以增强对NAD(P)介导的细胞代谢通路的理解,并为氧化还原反应的调控提供有效的策略[19-21]。

图1 天然烟酰胺辅酶和仿生烟酰胺辅酶的结构Fig.1 Structures of natural nicotinamide-based coenzymes and biomimetic nicotinamide coenzymes
本文作者将详细介绍烟酰胺辅酶依赖型氧化还原酶的辅酶偏好性改造所用到的设计策略和高通量筛选方法,以及这些偏好性改变的氧化还原酶在合成生物学中的应用,特别是对仿生辅酶具有偏好性的氧化还原酶突变体在一些合成生物体系中的应用。
1 氧化还原酶的辅酶偏好性改造方法
氧化还原酶的辅酶偏好性改造方法主要有3种:随机突变、半理性设计和理性设计[22-24]。这些方法的本质是构建分子多样性文库以及从文库中筛选出期望的阳性突变体。随着蛋白质分离纯化和晶体结构解析技术的快速发展,大量的酶结构信息被解析。然而很多酶有效突变点的预测仍然十分困难,因此随机突变是十分有效的改造手段。随机突变一般通过易错PCR或基因改组构建高通量随机突变文库从而筛选有效突变体[25-26]。相比而言,半理性设计和理性设计借助了生物信息学方法,通过计算机模拟获得潜在有益突变点[27-28],再利用饱和突变或定点突变技术进行筛选,不但提高了阳性突变率,而且大大缩小了突变文库容量。
1.1 随机突变
随机突变是酶改造的常用手段,无需了解酶的晶体结构和催化机制等背景知识,直接通过迭代有益突变筛选突变株,但由于工作量太大一般作为改变酶特性的最后解决方案。由于大多数NAD(P)依赖型的氧化还原酶具有高度保守的辅酶结合域Rossmann折叠[29-30],半理性设计和理性设计在氧化还原酶辅酶工程中应用更为广泛。
1.2 半理性设计
半理性设计是在蛋白质结构和功能基础上以多个特定残基为标靶进行饱和突变,筛选突变文库实现辅酶偏好性转换。Sieber等[31]对硫叶菌来源的葡萄糖脱氢酶(SsGDH)进行理性设计,通过对辅酶口袋附近9个氨基酸残基进行定点饱和突变,筛选到一个双突变体Ile192Thr/Val306Ile,该突变变体相比野生型酶对仿生辅酶1-苯乙基-1,4-二氢吡啶-3-甲酰胺(P2NA)的酶活提高了10倍,并成功应用于生产2-甲基丁烷。Zhao等改造亚磷酸脱氢酶(Pdh)获得了一个可以利用人工辅酶烟酰胺胞嘧啶二核苷酸(NCD)的突变体I151R/P176R/M207A,该突变体对NCD的酶活与野生型酶对NAD的酶活达到了同一个数量级。随后,该团队通过晶体结构和机制解析总结出改造脱氢酶偏好NCD的一般规律,对于构建工程酶高效利用仿生辅酶及其应用具有重要意义[19]。
1.3 理性设计
辅酶工程的理性设计首先要确认辅酶结合位点附近的残基[32-33],包括与2′-磷酸基团[34]、腺苷基团[35]以及烟酰胺基团结合的残基[36-39]。Chen等[36]对不同来源的6-磷酸葡萄糖酸脱氢酶(6PGDH)的辅酶结合域进行了多序列比对,发现6PGDH与NADP的2′-磷酸基团之间存在一个相互作用的loop区[36](图2)。序列比对结果显示NAD偏好的6PGDH在该loop区N端的Asp32位点高度保守,而NADP偏好的6PGDH在Asn32、Arg33和Ser/Thr34位点高度保守。定点突变海栖热袍菌来源的6PGDH(Tm6PGDH)中这些保守氨基酸后,获得最优突变体N32E/R33I/T34I,该突变体对NAD的催化效率(kcat/Km)是对NADP的96倍[40-42]。此外,Li等[28]借助计算机辅助设计,对枯草芽孢杆菌来源的葡萄糖脱氢酶(BsGDH)辅酶偏好进行改造,改造后的突变体严格依赖仿生辅酶NMN参与氧化还原反应,该NMN依赖型的突变体偶联各种氧化还原酶被成功用于进行体外酶促反应。

图2 不同来源的6PGDH辅酶结合域的多序列比对,框内是辅酶识别的loop区Fig.2 Amino acid sequence alignment of coenzyme-binding motifs of various 6PGDH enzymes,residues composing loop region and responsible for coenzyme recognition are shown in red box
1.4 基于高通量筛选(HTS)的定向进化方法
改造氧化还原酶使其偏好仿生辅酶是目前的一个热门课题。天然酶通常对仿生辅酶具有较低酶活,因此高通量筛选方法需要消除细胞内源性NAD(P)和还原性化合物的背景干扰。基于平板高通量筛选策略[14],Huang等[43]发展了一种更高效的平板高通量筛选方法——NAD(P)消除固相分析法(NESPA)。此方法能在最小背景信号下可靠地筛选仿生辅酶偏好的阳性突变体。具体步骤包括:①菌落高温处理,增加细胞膜通透性;②菌落转移到滤纸上;③洗涤滤纸去除内源性NAD(P)和还原性化合物;④偶联酶和电子中介体(IEC)显色[图3(a)];⑤肉眼筛选阳性突变体[图3(b)]。NESPA被成功用于提高Tm6PGDH对烟酰胺单核苷酸(NMN)的活性,最优突变体比野生型酶对NMN的催化效率(kcat/Km)提高了50倍,比酶活达到17.7 U/mg,与野生型酶对天然辅酶NADP的酶活相当[43]。然而这种方法只适合于高热稳定性的氧化还原酶的改造工作。
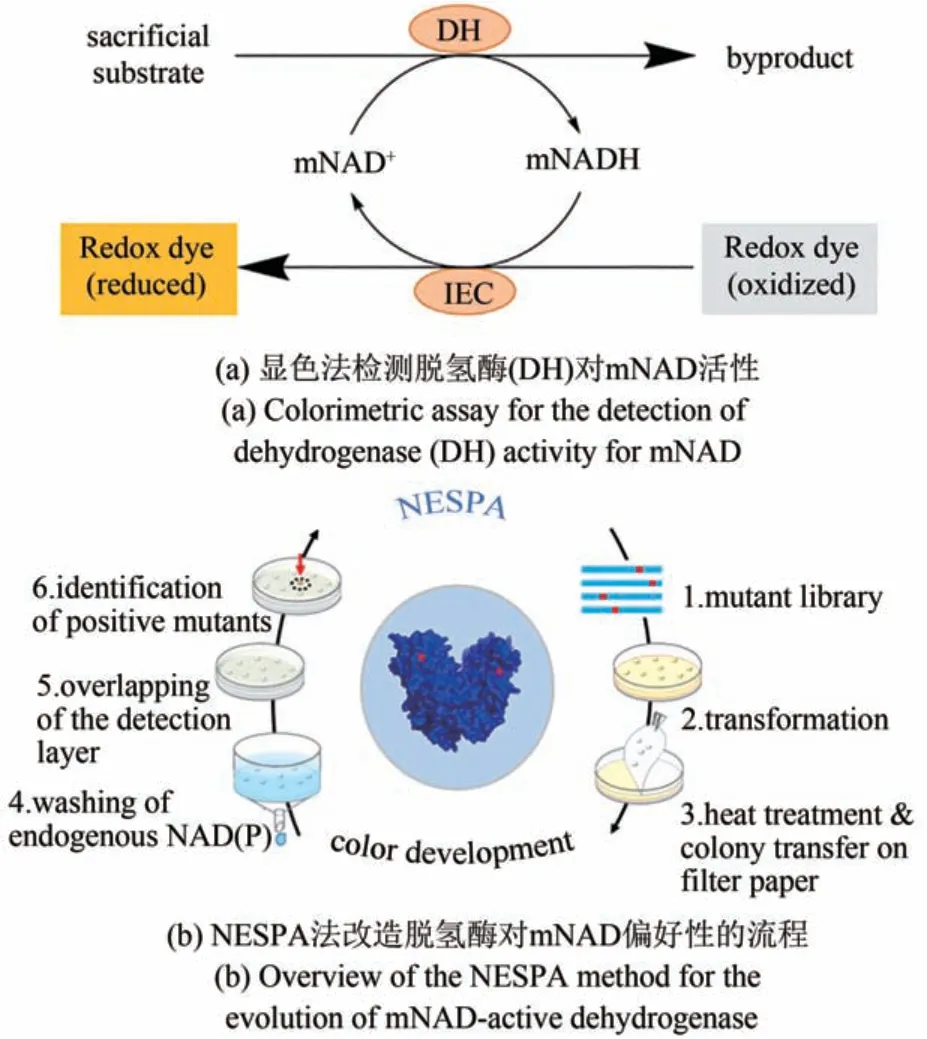
图3 使用NESPA法改造NAD(P)依赖型脱氢酶偏好仿生辅酶(mNAD)Fig.3 Schematic presentation of NESPA method for evolution of NAD(P)-dependent dehydrogenases to utilize biomimetic coenzyme mNAD
2 氧化还原酶的天然辅酶偏好性改造
辅酶NAD及其还原态NADH参与生物体内多种代谢途径,NAD(H)水平和NAD/NADH的比值在决定细胞氧化还原状态和代谢通量中起重要作用[10,44]。NAD一般通过酵母提取或微生物发酵获得,也有通过全合成、半合成以及酶催化合成的报道。由于NADP比NAD昂贵很多,因此在体外合成生物学中,辅酶偏好性改造常常是从NADP到NAD。而在体内合成生物学改造中,细胞内部没有辅酶成本的制约,辅酶改造可以双向进行,即从NADP到NAD或者NAD到NADP[45]。
2.1 NAD到NADP的改造
氨基酸是目前最大的发酵产物之一[46],它的生产与NADPH水平密切相关。在谷氨酸棒状杆菌中,每生产1 mol的赖氨酸需要4 mol的NADPH。可以通过糖酵解等途径提高体内NADPH的生产水平以提高赖氨酸的产量。但是糖酵解途径主要由NAD依赖型氧化还原酶组成,Bommareddy等[47]通过理性设计的方式将谷氨酸棒状杆菌中NAD依赖型3-磷酸甘油醛脱氢酶(CgGAPDH)的辅酶偏好改变为NADP依赖型。与野生型菌株相比,改造后的谷氨酸棒状杆菌赖氨酸产量提高了60%。
工业构建的用于乙醇生产的酿酒酵母菌株中包含毕赤酵母来源的木糖还原酶(PsXR)和木糖醇脱氢酶(PsXDH)。在乙醇生产中,NADPH依赖型的PsXR将木糖还原为木糖醇同时将NADPH氧化产生NADP,随后木糖醇被NAD依赖型PsXDH氧化为木酮糖而NAD被还原为NADH,整个过程中辅酶的不平衡大大降低了乙醇的产量。将PsXR改造为NAD依赖型酶或者将PsXDH改造为NADP依赖型酶可以实现系统的辅酶平衡。因此,Watanabe等[48-49]利用多位点饱和突变成功地将PsXDH的辅酶偏好性从NAD改造为NADP。这种改变大大提高了酿酒酵母对木糖的利用效率以及乙醇的产量,同时降低了木糖醇的积累[12]。
2.2 NADP到NAD的 改 造
大肠杆菌以葡萄糖为底物,可以通过修饰的支链氨基酸途径合成异丁醇[13,38,50-52]。在这条代谢途径中,糖酵解途径消耗一分子葡萄糖生成两分子NADH和两分子丙酮酸。然而,每生成一分子异丁醇需要消耗两分子NADPH,整个途径辅酶严重不平衡。因此,需要在好氧或者微好氧条件下发酵,激活磷酸戊糖途径或者三羧酸循环为生产异丁醇提供NADPH。除了优化发酵条件外,改变氧化还原酶的辅酶偏好性是解决该困境的理想手段。Bastian等[13]将酮酸氧化还原异构酶(KARI)和醇脱氢酶(ADH)改造为NADH依赖型,在厌氧条件下实现了异丁醇100%转化。与异丁醇途径相似,将辅酶偏好型由NADPH改造为NADH的XR和NAD依赖型XDH构建到酿酒酵母中生产乙醇时[53-54],乙醇的产量提高20%,木糖醇的积累下降52%。
3 氧化还原酶的仿生辅酶偏好性改造及其应用
烟酰胺辅酶在手性化合物和医药前体化合物的合成上有着广泛应用,但是高成本、低稳定性[55]的天然辅酶限制了其工业应用。为了克服这一困难,近年来研究者们致力于合成仿生烟酰胺辅酶用于代替天然辅酶参与氧化还原反应[56-57]。表1列出了本文中典型的氧化还原酶的仿生辅酶偏好性改造案例。天然辅酶按结构可以分为负责传递氢和电子的烟酰胺单核苷酸(NMN)以及负责锚定辅酶与酶相互作用的腺苷磷酸(AMP)。仿生烟酰胺辅酶的合成主要是改变天然辅酶中的AMP部分[12]。仿生烟酰胺辅酶可以分为2类:半合成仿生辅酶,在结构上与天然烟酰胺辅酶类似,通常是天然辅酶的截短形式(例如烟酰胺单核苷酸,NMN),或者仅对天然烟酰胺辅酶某些基团做了修饰替换[图1(b)];全合成的仿生辅酶[57],通常空间体积较小(例如N-苄基烟酰胺,BNA),仅保留了负责电子转移的烟酰胺基团[图1(c)]。

表1 氧化还原酶对仿生烟酰胺辅酶mNADs偏好性的改造Tab.1 List of coenzyme engineering of oxidoreductases on biomimetic nicotinamide coenzymes mNADs
3.1 在体外合成生物学中的应用
体外合成生物学是近几年来新兴的生物制造平台,它具有可操作性强、产品产率高、反应速度快等特点[59-61],被成功应用于生产氢气、生物电等生物化学品[3,62-65]。利用体外合成生物学生产电、氢气、氨基酸、醇类以及胺类等物质时,通常涉及辅酶的氧化与还原[62,66-73]。由于辅酶价格昂贵,因此在体外合成途径中少使用、循环使用或者不使用辅酶,能有效降低生产成本[74]。在体外合成途径中,使用高稳定、低成本的仿生辅酶替代不稳定、昂贵的天然辅酶是降低辅酶使用成本的另一有效方法。氢气被认为是未来最有前途的清洁能源。利用生物体外合成路径产氢具有产率高、速率快、无污染等优点。产氢途径中需要用到两个关键的脱氢酶:葡萄糖6-磷酸脱氢酶(G6PDH)和6-磷酸葡萄糖酸脱氢酶(6PGDH)。这两个酶利用辅酶(NADP)直接将电子传递给氢酶,经氢酶催化发生氧化还原反应生产氢气。改造G6PDH和6PGDH的辅酶偏好性,使其能够利用仿生辅酶,是体外合成途径生产氢气过程中亟待解决的问题。Huang等[43]利用定点饱和突变和随机突变的方式对Tm6PGDH进行辅酶偏好性改造。与野生型相比,突变体对NMN比酶活提高了近30倍[图4(a)]。突变型6PGDH利用NMN作为辅酶与野生型6PGDH利用NADP具有相同的甲基环己酮产率[图4(b)]。此外,作者课题组以运动发酵单胞菌(Zymomonas mobilis)来源的G6PDH作为研究对象,通过4轮定点饱和突变和组合突变,同样实现了该酶由NADP依赖型到NMN依赖型的辅酶偏好性改造(未发表数据)。然而,突变型G6PDH和6PGDH对NMN的米氏常数(Km)仍然较高,不利于其在体外合成生物体系手性醇、生物电等方面的应用。通过酶工程改造降低该酶对NMN的Km值是未来的重要研究方向。

图4 定向进化提高6PGDH对NMN的活性及其应用Fig.4 Directed evolution to improve 6PGDH activity on NMN and its application
3.2 在生物正交系统中的应用
尽管许多氨基酸类[75-76]、有机酸类、手性药物等化学品已经能够通过代谢工程改造菌株进行生产[77-82],但由于生产力、效价和产量较低,能够进行实验室规模生产的例子仍然很少。在生物体内,大量氧化还原反应通过天然辅酶NAD(P)进行电子传递,这些氧化还原酶并不能利用人工辅酶。因此,通过构建生物正交体系,将代谢途径中的某个或某些氧化还原酶及其天然辅酶用氧化还原酶突变体及人工辅酶替代,对于解析微生物代谢机制、代谢流走向、微生物生理生化性质具有重要的研究意义。研究人员通过对氧化还原酶与烟酰胺辅酶结合规律的研究,结合理性设计方法,实现了BsGDH的辅酶偏好性由严格NAD(P)依赖型到严格NMN依赖型的改造。通过将仿生辅酶NMN偏好的突变型GDH与各种氧化还原酶偶联,证明NMN在体外生物转化过程中可以支持多种酶促反应,包括C=C双键、C≡C三键和硝基的还原以及为细胞色素P450传递电子的反应。其中,对C=C双键的高还原效率和稳定性可达到工业酶标准[28]。这套体系为实现代谢路线在工程菌中的正交化提供了有力支持。
NAD是胞内不可或缺的辅酶,其水平的改变会导致全局性且难以预测的生物学效应。为突破基于天然辅酶代谢调控的局限,中国科学院大连化学物理研究所的赵宗保研究员团队通过定向进化获得了多种氧化还原酶的非天然辅酶依赖型突变体,并构建出相应的正交氧化还原催化体系。在对亚磷酸脱氢酶进行辅酶偏好性改造基础上,阐明了氧化还原酶辅酶偏好性改变的分子基础,并构建了亚磷酸驱动的有机酸合成体系。除此之外,该团队还通过定向进化获得了NCD偏好型甲酸脱氢酶(FDH),在纯酶水平与NCD偏好型苹果酸酶(ME)突变体偶联,构建了新的正交氧化还原体系,证明其可利用甲酸来源的碳和还原力进行丙酮酸还原羧化;同时在微生物细胞内成功构建了甲酸驱动、NCD介导的苹果酸生物合成体系。该研究逆转了胞内苹果酸节点的代谢流方向,对人工设计代谢途径、选择性调控细胞物质能量代谢具有重要参考价值(图5)[19-20,58,83]。

图5 由仿生辅酶NCD和NFCD与突变体酶苹果酸酶(ME)、D-乳酸脱氢酶(DLDH)和甲酸脱氢酶(FDH)组成的仿生辅酶正交体系Fig.5 Cofactor orthogonal system of NCD and NFCD with mutated malic enzyme(ME),D-lactate dehydrogenase(DLDH)and formate dehydrogenase(FDH)
3.3 在酶燃料电池中的应用
电极表面聚合物膜中酶的固定化在生物燃料电池和生物传感器中有着广泛的应用[84-87]。与游离酶相比,固定化酶的使用减少了所需的酶量,大大提高了系统的稳定性和寿命[88-89]。然而,在该系统中辅酶的扩散成为关键的限速步骤[90]。NAD的分子量约为663.43,体积庞大,在穿梭膜的过程中阻力较大,传质效果差。与NAD相比,NMN缺少腺嘌呤核糖核苷酸单元,只保留了以烟酰胺为底盘的氧化还原中心,传质速率更加快捷。Campbell等[15]通过定点饱和突变拓展了来源于Pyrococcus furiosus的醇脱氢酶(PfADH)的辅酶谱,使其能够利用分子量更小的NMN,并将其应用于酶燃料电池。与天然辅酶NAD相比,NMN构建的生物燃料电池系统电流密度增加了40%。
3.4 氧化还原酶的BNA偏好性改造在高值化学品生产中的应用
BNA是一种典型的全合成仿生烟酰胺辅酶,也是被研究较多的仿生辅酶。Hollmann课题组[91]设计合成了一系列BNA类似物代替天然辅酶用于烯酸还原酶(ER)催化茶香酮及α,β-不饱和羰基化合物C=C键的不对称还原体系中。实验结果表明反应转化率和产物的对映体选择性均大于99%,且该体系已经成功进行了放大试验。Hauer等[92]将BNA中苄基替换为苯基,从而合成了1-苯基-1,4-二氢烟酰胺(PNAH)和1-(4-羟基苯基)-1,4-二氢烟酰胺(HPNAH)。来源于发酵单胞菌的2-环己烯-1-酮还原酶对PNAH的酶活与对天然辅酶NAD的酶活达到了同一个数量级。来源于Pseudomonas azelaicaHBP1的2-对苯基苯酚3-单氧酶可以利用BNA作为辅酶将羟基加在对苯基苯酚上形成邻苯二酚[93]。同样的,大肠杆菌来源的含有黄素的硝基还原酶也能利用人工辅酶BNA[94-95]。这些研究报道表明,高稳定、低成本的全合成仿生辅酶具有替代昂贵、不稳定的天然辅酶的应用前景。然而,自然界中大部分氧化还原酶对仿生辅酶没有活性,或者仅具有很弱的活性。因此,通过蛋白质工程手段对具有工业应用价值的氧化还原酶进行仿生辅酶偏好性改造,是提升高值化学品生物制造的有效手段。
4 总结与展望
由于不同类型的辅酶之间的差异、辅酶的供需平衡以及辅酶的成本和稳定性问题,对氧化还原酶的辅酶偏好性改造在生物代谢调控、工业医药以及体外合成生物方面都有着广泛的应用。随着高分辨率蛋白质晶体结构、同源氧化还原酶辅酶工程改造的不断增加以及新型高通量筛选方法的不断发展,NAD和NADP之间辅酶偏好性改造的蛋白质工程日趋成熟。同时,高稳定、低成本的仿生辅酶替代天然辅酶参与酶催化反应变得越来越容易实现。
从含有大量突变体的文库中筛选目的突变体目前依然是氧化还原酶辅酶工程改造的常用手段,因此高效准确的高通量筛选方法的建立依然具有重要意义。液滴微流控高通量筛选平台不仅能以低成本实现超高通量筛选酶库,而且可以快速、有效识别和分离酶突变体,被广泛应用于酶定向进化研究。目前,液滴微流控筛选体系应用于氧化还原酶的仿生辅酶偏好性研究最大的难点在于细胞内大量内源性天然辅酶对仿生辅酶的信号干扰。近期光谱实验数据显示天然辅酶与仿生辅酶在不同波长下荧光寿命不同。基于此性质差异,使用液滴微流控筛选仿生辅酶偏好的氧化还原酶将可能得以实现。
氧化还原酶的仿生辅酶偏好性研究是一个相对较新的领域,为研究者提供了更多的机遇和挑战。构建高效仿生辅酶再生体系同样处于初级阶段,大多数研究都集中在实验室水平,还没有成功应用于工业生产的案例。过去关于酶与仿生辅酶结合的蛋白质晶体结构非常有限,酶与仿生辅酶相互作用机制仍不清晰,仿生辅酶相关的蛋白质改造工程一直没有普适的理论指导。然而随着时间的推移,越来越多天然酶元件被发现具有仿生辅酶活性;同时根据现有仿生辅酶的研究基础,更多具有高稳定性、优异溶解性以及与酶元件高度兼容性的新的仿生辅酶(PNA、HPNA、NCD、NFCD)被理性设计并合成出来。这些成果为未来氧化还原酶的辅酶工程研究提供了方向和坚实的基础。
