天然产物成药性的合成生物学改良
2020-12-24王清陈依军
王清,陈依军
(中国药科大学生命科学与技术学院化学生物学研究室,江苏南京211198)
由于天然产物含有大量生物活性相关特征的分子骨架和药效团,如何将天然活性分子或药效团发展成为临床治疗药物一直是人们努力的目标[1-4]。长期以来,天然产物被视为临床药物的重要来源和药物设计的宝贵源泉,尤其在抗肿瘤和抗感染领域[5-7]。据统计,在1981—2010年间获批上市的1073种小分子药物,直接来源于天然产物或者与天然产物相关的药物约占64%,其中抗感染和抗肿瘤药物方面与天然产物相关药物所占的比例更高[8]。
尽管天然产物具有生物活性分子的天然优势,但是往往因具有以下特点,减缓了其研发过程甚至导致难以成药:①受自然资源和生长条件等方面的限制,天然产物特别是植物来源的天然产物难以通过提取分离而获得足够的质量,这种可及性限制常常阻碍活性分子的临床前和临床研究以及上市供应;②随着不断的重复分离,从自然界发现新结构或新活性天然产物的概率变得越来越低;③天然产物通常存在水溶性差、活性不强、结构类似物多等成药性缺陷。对此,人们采用有机合成化学对天然产物进行了大量的设计和合成,产生自然界不存在的类天然产物。虽然这种策略和方法取得了重要进展并获得了不少成功上市的药物,但是分子结构的复杂性、反应条件的严苛性、合成路线的繁杂性等诸多因素制约了有机合成化学在天然药物研发中的广泛应用。
与此同时,新的活性分子的发现仅是药物研发过程的开端。由于天然产物通常存在理化性质方面的缺陷,往往还需要十分漫长的优化过程[9-11]。因此,亟需新的策略和手段进行天然产物的成药性改造和优化。鉴于合成生物学通过运用系统设计和工程化原理,设计并获得基本的生物学元件、模块和系统,使得创建人工生物合成体系、规模化定向生物合成新型活性分子成为可能和现实[12-13]。因此,基于其灵活性、系统性、可操控性以及确定性,运用合成生物学的技术和手段改善天然产物的成药性自然成为了一种有效的策略和工具。迄今,合成生物学策略和技术已在制备天然产物和改善其成药性方面取得了一定进展,如达托霉素及衍生物的发现[14]和美登素的异源生产[15]等。本文作者就合成生物学策略和技术解决天然来源的药物研发所面临的主要问题进行概述和总结,期许有助于加速天然产物的成药性改良以及新药研发的进程。
1 增加水溶性
不论哪种给药途径,任何药物均需要一定的水溶性才能制备成合适的剂型而用于临床治疗。然而,除多糖和寡糖类物质外,绝大多数天然产物的水溶性不佳,导致其成为限制天然产物成药的重要因素之一。针对水溶性低的问题,结构修饰和改造是有效的解决办法。由于酶和生物体系的高度位点和立体选择性,通过合成生物学手段构建体内外水溶性修饰体系,定点改造化合物的骨架结构,取得了较好的效果。这些修饰包括糖基化、羟化、磺酸化、磷酸化等,其中由于糖基转移酶和糖苷合成酶广泛存在于自然界而成为改善天然活性分子理化性质的重要手段[16-17]。例如,甘草次酸(glycyrrhetinic acid,GA)是一种疏水性五环三萜化合物,具有多种生物活性。Liu等[18]应用来自植物Barbarea vulgaris的糖基转移酶UGT73C11在大肠杆菌中重组表达,纯化的UGT73C11体外催化UDP-葡萄糖和GA C-3位羟基经β-糖苷键连接生成新化合物甘草次酸-3-O-单葡萄糖(GA-3-O-monoglucose)(图1),糖基化修饰后的产物显著提高了GA的水溶性和生物活性。此外,Liang等[19]利 用 真 菌(Cunninghamella elegansAS 3.2028)将具有抗动脉硬化活性的天然产物丹参酮转化为两种糖基化衍生物,其中对苯二酚丹参酮-11-O-β-D-葡萄糖苷的水溶性提高了50倍,同时小鼠口服吸收明显改善。
硫肽类抗生素硫链丝菌素(thiostrepton,TSR)能够有效杀死革兰氏阳性耐药菌,其结构包含Loop2的双环,侧环含有一个喹啉酸(quinaldic acid,QA)[20-21]。其生物合成途径中QA部分的形成涉及甲基转移到L-色氨酸的吲哚环并发生重排,产生喹啉酮作为中间体。Wang等[22]通过对QA部分的选择性修饰,生物合成了喹啉酮的5-氟化和12-甲基化的酯类似物。随后,将类似物加入QA基因敲除菌株中。由于该敲除菌株缺少用于内源生成喹啉酮的甲基转移酶,生成了5′-氟-TSR和12′-甲基-TSR衍生物。这两种衍生物的抗菌活性明显增强,并且12′-甲基-TSR的水溶性提高了1.5倍,提高了其成药的可能性。

图1 甘草次酸糖基化形成甘草次酸-3-O-单葡萄糖Fig.1 Glycosylation of glycyrrhetinic acid to form GA-3-O-monoglucose
2 提高活性
天然产物的活性直接决定其临床治疗的有效性。在大多数情况下,从微生物或植物分离的天然产物通常活性不够显著,很难达到临床治疗所需的效果。因此,提高天然产物的活性成为了一个重要课题。虽然化学改造是一种有效的手段,但常常因母核结构复杂而无法从根本上解决问题。与此同时,合成生物学可以通过药效团和构效关系分析,人工设计并定向合成其母核改变、结构丰富的活性衍生物库,经筛选后获得活性显著提高的先导化合物或候选药物。例如,Evans等[23]采用基于同源重组的等位基因替代策略,成功删除了产生菌中非核糖体肽合成酶AdmK基因,将所得菌株用作表达AdmK突变体的宿主,通过构效关系分析选择激活非极性氨基酸的A结构域,从定点饱和突变的位点中选择了3个高度变异的残基构建了含有不同突变体的文库。随后,筛选得到了3个Andrimid衍生物,其抗金黄色葡萄球菌活性明显增强。
由于建库筛选耗时费力,人们转向利用理性设计与组合生物合成的思路提高天然产物的活性。以二聚化为例,天然产物的二聚化通常有助于活性的提高。2018年,Matsuda等[24]通过基因敲除,发现了天然产物Neosartorin生物合成基因簇nsr,并且发现P450酶NsrP能催化氧杂蒽酮发生异源二聚化。通过不同单体间的二聚化产生多样化二聚体,新型二聚化产物体现出更好的抗菌活性。Alboflavusins(AFN)最初从黄链霉菌(Streptomyces alboflavussp.313)中获得,是一种具有抗菌、抗肿瘤活性的环六肽[25-26]。AFN的生物合成属于非核糖体肽合成酶机制,而其6-Cl-LTrp前体由位于afn基因簇外部的色氨酸卤化酶基因形成。构效关系分析表明,AFN的吡咯吲哚环上形成C5-C5′联芳基二聚体,产物的活性会大幅增加。通过对AFN生物合成途径相关基因的改造,可以产生AFN衍生物。随后在S.alboflavus野生型和突变菌株中异源表达P450酶HmtS和Clps,以AFN为底物催化区域选择性二聚化反应,形成两个二聚AFN(di-AFN)[27](图2)。通过体内外验证,二聚化AFNs的抗菌和抗肿瘤活性提高至单体的10~100倍。
此外,Hindra等[28]通过基因组挖掘发现了Streptomyces mobaraensisDSM40847含有博来霉素(bleomycin,BLM)基因簇。通过建立链霉菌的遗传操作系统,在Streptomyces mobaraensisDSM40847基因组中沉默blmG基因构建重组工程菌,产生了BLM类似物6′-脱氧BLM A2。6′-脱氧BLM A2对DNA的切割活性更高,表明改变BLM的二糖结构可以调节其活性。
3 减少类似物
受自然环境、生长条件、生长周期、代谢调控等因素的影响,天然产物的产生经常伴随着很多结构相似副产物的积累,但结构上的微小差异往往导致天然产物之间活性差别较大。由于这些副产物结构类似而难以分离,极大阻碍了天然产物的工艺开发和质量控制。因此,通过对目标产物合成途径及结构差异的分析,改造和组装生物合成途径中关键酶的基因,再利用转录与代谢的调控,能够增加目标天然产物的比例及产量。
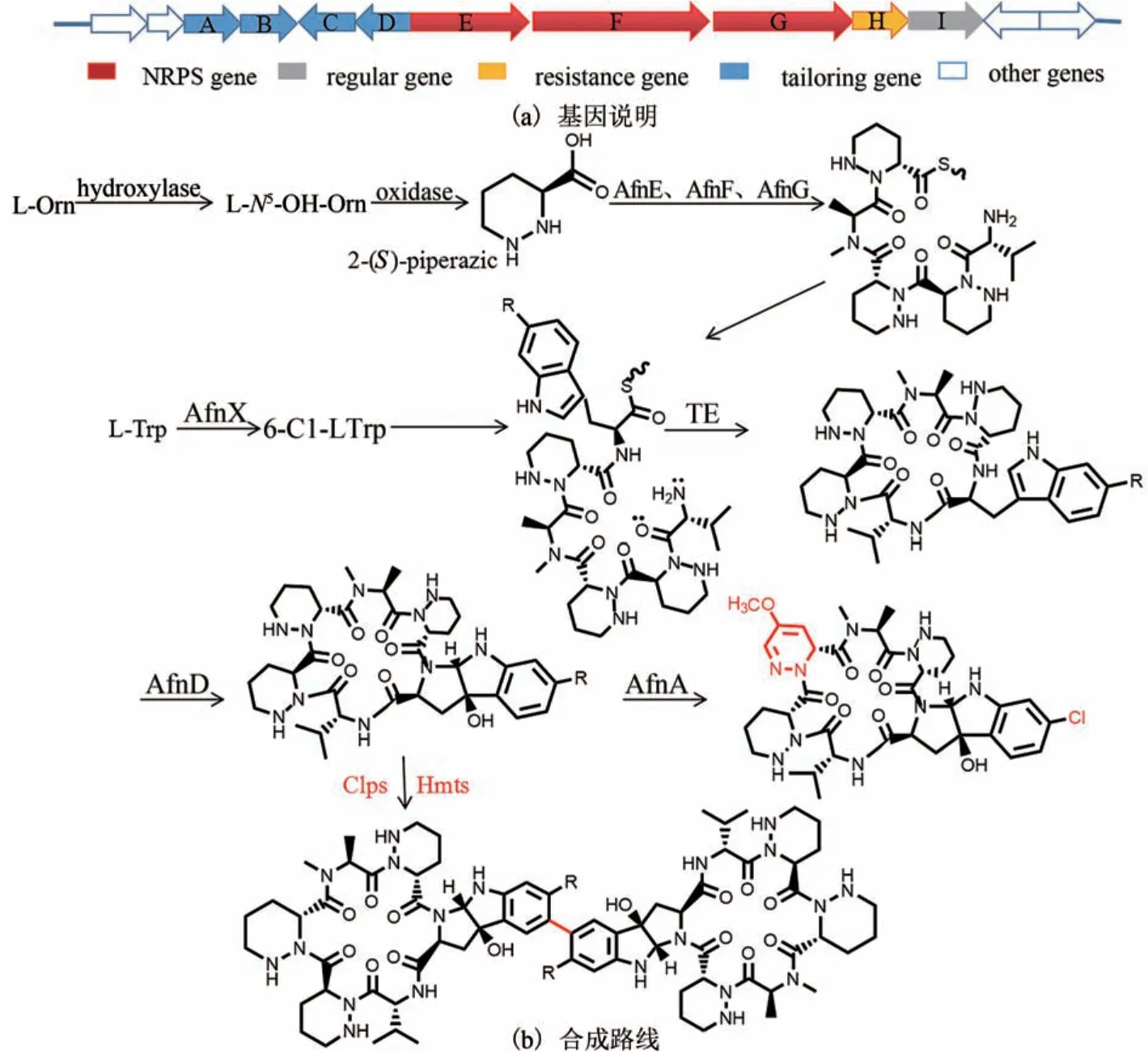
图2 白黄菌素的生物合成基因簇和二聚白黄菌素生物合成途径改造Fig.2 AFNs biosynthetic gene cluster and manipulation of biosynthetic pathway for production on of di-AFNs
红霉素(erythromycin)主要包含A、B、C、D四种成分,其中红霉素A(Er-A)的活性最好,在临床广泛使用,并由此改造开发出具有良好抗菌活性的新药(阿奇霉素、氟红霉素和泰利霉素)[29-31]。为了提高Er-A的比例而减少其他组分,将红霉素产生菌Saccharopolyspora erythraeaHL3168 E3中8个attB位点的序列替换隐秘基因nrps1-1。然后,引入对Er-A生物合成具有重要影响的外源或内源基因,包括用于正向调节的S-腺苷甲硫氨酸合成酶基因,用于增加氧气供应的vhb基因以及用于优化后修饰的基因eryK(编码C-12羟基化的P450酶基因)和eryG(编码C-3O-甲基化的O-甲基转移酶基因)[32](图3)。经过这一系列改造,Er-A产量得到系统性提高并且副产物Er-B和Er-C被完全消除。
此外,酵母菌常用于生产乙酰辅酶A衍生物(聚酮化合物、萜类化合物等)[33-34]。因此,通过在Crabtree negative酵母设计转录调控信号放大器,构建了一个新的生物合成系统,使乙醇诱导表达能力提升近20倍[35],将这种乙醇诱导型元件应用于合成降血脂药物辛伐他汀中间体莫纳克林J。通过调控上下游生物合成途径,并偶联阻断其竞争性途径,使莫纳克林J产量大幅提高,且无副产物累积。
4 提高可及性
许多天然产物具有良好的活性,但将其从天然宿主中提取分离或通过化学合成的方式无法获得足够的质量,用于临床研究和疾病治疗。然而,分析这些化合物的生物合成途径发现,它们均遵循生物合成逻辑而通过体内相关酶催化反应产生。因此,人们可以通过对次生代谢产物生物合成基因簇的改造和拼装,人工构建生物合成途径,重新筛选并优化底盘细胞,有效提高天然药物的产量,提高先导化合物或药物的可及性。重要天然产物如萜类[36]、聚酮[37]、非核糖体肽[38]和生物碱[39]均可通过合成生物学技术进行改造和生产,并且取得了一系列成功,产生了多个应用于临床的药物。其中,最为突出的是,抗疟药青蒿素[40-41]、抗肿瘤药紫杉醇[42]的生物合成在合成生物学技术应用于天然产物研究和开发历史上具有里程碑式的意义。

图3 红霉素A的合成生物学改造Fig.3 Synthetic biology approach for production of erythromycin A
4.1 重构生物合成途径
在许多情况下,相关的代谢前体不能在原始宿主中大量产生,并且当中间产物不稳定或相关酶活性较低都导致最终产物较少。合成生物学旨在创建能够大量合成目标代谢物的新途径,把部分反应的模块组合到新的生物合成通路中,调节通路中各个基因的表达水平,优化代谢流和避免毒性中间体的积累。
甲硫氨酸是人体必需的氨基酸,具有抗氧化等多种生物活性,在医药领域具有广泛的用途[43-44]。O-乙酰高丝氨酸(O-acetylhomoserine,OAH)是L-甲硫氨酸合成的重要前体,刘君教授与江会峰教授课题组[45]合作在大肠杆菌中重构了OAH的生物合成途径。通过代谢工程策略消除副产物的积累,增加草酰乙酸的供应以及促进前体高丝氨酸的生物合成,通过定点突变等策略使限速酶的活性提高了12倍,达到了迄今所报道的OAH最高产量(图4)。

图4 O-乙酰高丝氨酸生物合成途径及改造PEP—磷酸烯醇丙酮酸;PYR—丙酮酸;OAA—草酰乙酸;ACE—醋酸盐;HSE—L-高丝氨酸;MetX—乙酰转移酶Fig.4 Synthetic biology strategy for high level production of O-acetylhomoserine in Escherichia coliPEP—phosphoenolpyruvate;PYR—pyruvate;OAA—oxaloacetate;ACE—acetate;HSE—L-homoserine;MetX—acetyltransferase
吲哚霉素是细菌色氨酸转移RNA合成酶的竞争性抑制剂,对临床耐药菌具有很好的杀菌活性[46]。2019年,杜艺岭教授课题组和加拿大Ryan教授课题组合作[47],阐述了细菌代谢过程中的特异性趋同现象,并且通过对链霉菌和海洋来源的藤黄紫交替假单胞菌中吲哚霉素合成途径的研究,整合了3种细菌合成酶构建了一条人工合成途径,使吲哚霉素效价提高了30%。
4.2 异源表达
由于天然产物生物合成过程中的复杂转录和代谢调控,难以合理系统地设计和改造原宿主的合成途径以提高天然产物的生物合成效率[48-49]。随着基因组学的发展和合成生物学技术的日趋成熟,异源表达已被广泛应用于产生复杂天然产物。由于大量基因组序列的可获得性和生物信息学理论及方法的发展,将生物合成活性分子的信息和能力从原宿主转移到遗传更友好的模式宿主能极大提高其生产能力和效率[50-51],同时通过遗传操作在宿主中沉默某些基因,也有利于发现新的天然产物。刘天罡教授课题组[52]将多杀菌素(spinosad)的生物合成基因簇转移至含有更多前体(乙酰辅酶A、UDP-葡萄糖等)以及辅因子(NADPH、SAM)的白色链霉菌S.albusJ1074中,实现了多杀菌素的异源表达。经代谢组学及蛋白质组学分析,将多杀菌素生物合成中的3个限速步骤——鼠李糖合成模块和甲基转移酶SpnI,forosamine生物合成模块以及聚酮合酶基因spnE分别过表达,从而使多杀菌素产量逐步提高至1460µg/L,比出发菌提高了约1000倍。另外,黑色素(melanin)是一类具有较好理化性质、较好生物活性的吲哚类或酚类分子色素的总称[53-54]。采用生长最快的细菌——需钠弧菌为宿主,可以异源合成黑色素。经替换tac启动子诱导表达酪氨酸酶,在IPTG诱导下,酪氨酸酶的表达量提高100倍。随后,比较不同的培养条件,结果显示在M9培养基中黑色素的生产速度达到420 mg/(g CDW·h),其效率高于已报道的数值[55]。
5 展望
自青霉素被发现以来,天然产物及其衍生物在人类对抗各种疾病的艰难斗争中发挥了至关重要的作用,为提高人类健康水平、延长寿命和社会经济发展做出了巨大贡献。然而,随着靶点和化合物两方面的枯竭,新药研发所需的时间越来越长、资金需求越来越大,资源利用及浪费也相应增大。如何加速新药研发的进程,是摆在学术界和工业界面前的巨大挑战和难题。虽然天然产物在成药性方面存在各种各样的缺陷,鉴于其结构和活性的多样性,现在和将来很长一段时间内仍将是新药来源的一个重要方面。可以预见的是,现代生物技术特别是合成生物学技术,在新型天然产物的发现、活性天然分子的成药性改良等方面将发挥不可替代的作用。在微生物天然产物领域,各种沉默基因簇的激活策略已经带来了不少结构和活性新颖的天然产物,并且应用合成生物学策略在改善成药性方面也取得了一系列进展。在植物天然产物领域,虽然生物合成途径的解析难度较大,但随着多种组学技术的综合应用,传统的提取分离研究模式正在快速向基于遗传操作和生物合成途径的方向转移,并取得了可喜的进展。与此同时,以基因编辑为代表的新型分子生物学方法和手段发展迅猛,为合成生物学技术的完善和广泛应用提供了更多和更高效的工具。此外,计算机科学和信息学的快速发展也为其在合成生物学中的应用注入了新的活力。生物信息学已经成为合成生物学不可或缺的高效工具,人工智能也将逐步应用于合成生物学的研究和开发中。这些发展均将有力推动天然产物成药性的合成生物学改良。通过对天然活性分子结构与活性的分析,理性设计和改造生物合成途径,充分利用代谢工程方法改造和开发新型异源表达系统,进一步提高各种元件、模块和底盘的适配性,快速构建人工生物合成体系,必将大幅提升天然产物的成药率,为临床疾病治疗提供新的手段,从而进一步展现合成生物学的潜能和生命力。
