基于工程化盐单胞菌的下一代工业生物技术
2020-12-24陈江楠陈潇宁刘心怡万薇章义鑫张自豪郑逸飞郑陶然王宣王子瑜闫煦张旭吴赴清陈国强
陈江楠,陈潇宁,刘心怡,万薇,章义鑫,张自豪,郑逸飞,郑陶然,王宣,王子瑜,闫煦,张旭,吴赴清,陈国强
(1清华大学生命科学学院,北京100084;2清华大学新雅书院,北京100084;3天津大学生命科学学院,天津300072;4山东大学生命科学学院,山东济南250100)
化学工业在过去几十年里为人类社会带来了巨大的福利,但随着社会的进步,化学工业导致的环境污染、资源枯竭等问题引起越来越多的关注,可持续发展的呼声不断增多[1-2]。工业生物技术(industrial biotechnology)是指通过微生物发酵或无细胞生物催化,在温和的条件下将原材料转化为所需的化学物质、材料和能源的技术,它可以有效缓解环境污染问题,实现可持续发展[3-4]。但现有工业生物技术存在许多缺点:易发生微生物污染,对生物反应器、操作人员、发酵条件和发酵程序要求十分严格,微生物生长缓慢,原材料价格昂贵,底物到产物的转化率低,生产过程难以连续,产品分离纯化困难,消耗大量淡水和能源等[5]。这些缺点导致工业生物技术生产成本较高,无法与以低廉的石油为基础的传统化学工业竞争[6-7]。因此,迫切需要开发能够克服这些缺点的新型工业生物技术。
下一代工业生物技术(next generation industrial biotechnology,NGIB)是一种低成本生物加工技术,其核心是利用生长在特殊环境中的极端微生物,如嗜盐菌、嗜酸菌、嗜碱菌、嗜冷菌、嗜热菌等作为底盘细胞建立的开放、无灭菌的连续发酵生产体系[8-10]。由于这些微生物在极端环境下仍能快速生长,可以避免杂菌污染对发酵培养的干扰。盐单胞菌(Halomonasspp.)在高盐和碱性环境中能够快速生长,这为限制杂菌生长提供了双重保证。以盐单胞菌为基础开发的下一代工业生物技术可以有效节约淡水和能源、降低发酵过程的复杂性和生产成本(图1)[9]。此外,多种盐单胞菌的全基因组测序已经完成[11-15],为这些物种的合成生物学和代谢工程改造和研究奠定了生物信息学基础。研究人员已开发了适用于盐单胞菌的多种基因编辑工具和调控元件,以快速获得优良的目标性状[16]。基于盐单胞菌的下一代工业生物技术体系已成功用于在开放、非灭菌条件下连续生产多种聚羟基脂肪酸酯[17-18]、生物表面活性剂蛋白[19]和氨基酸[20]。基于工程化盐单胞菌的下一代工业生物技术显示了巨大的发展潜力。

图1 基于盐单胞菌的下一代工业生物技术的流程[9]Fig.1 Process of next generation industrial biotechnology based on Halomonas spp.[9]
本文作者系统总结了近年来基于工程化盐单胞菌的下一代工业生物技术在各个方面取得的进展和突破,同时为进一步的研究提供良好的理论支撑。
1 下一代工业生物技术的优势
1.1 利用海水代替淡水
随着农业、工业和生活用水量的不断增加,全球可用淡水资源急剧下降[21]。传统工业生物技术的底盘细胞如大肠杆菌、枯草芽孢杆菌、假单胞菌、罗氏真氧菌以及酵母等发酵过程需要消耗大量珍贵的淡水,使水资源短缺问题更加严重。而全球水资源中97%以上为海水,却没有得到充分的利用[22]。开发能够利用海水的新型底盘细胞对节约淡水资源具有重要意义[23-24]。
盐单胞菌生活在深海、盐湖等高盐环境中,天然条件下可合成聚羟基脂肪酸酯(PHA)[24]、果聚糖[25]、胞外多糖[26]、四氢吡啶[27]、胞外聚合物(EPS)[28]等多种化合物。盐单胞菌Halomonas bluephagenesis(H.bluephagenesis)是清华大学陈国强团队[29]从新疆艾丁湖中分离出来的,该菌株可在不灭菌条件下,在海水中生长数周至数月不被污染。近年来,利用海水进行发酵生产盐单胞菌已被成功开发。Tan等[29]利用该菌株在含60 g/L NaCl的发酵培养基中经56 h的补料分批发酵生产聚3-羟基丁酸(PHB)。此外,盐单胞菌H.campaniensisLS21重组菌株在实验室人工海水(27 g/L NaCl)中经65 d连续开放发酵,细胞干重达约65 g/L,PHB占细胞干重约70%,并且在利用模拟餐厨废料的发酵过程中,分泌到胞外的纤维素酶、淀粉酶、脂肪酶和蛋白酶都保持良好的活性[30]。工程化的盐单胞菌能够利用海水迅速生长并积累产物,这对充分开发海水资源、节约淡水资源具有重要应用意义。
1.2 节省能量
在微生物发酵生产流程中,蒸汽灭菌和好氧发酵过程中的空压机鼓气是能量消耗最高的两大步骤[31]。盐单胞菌由于生长在高盐和碱性培养液中,直接抑制了其他微生物的生长[32],因此可以免除灭菌步骤,进行开放发酵。另外,嗜盐菌生长快,在争夺营养物质的竞争中占据优势,从而间接抑制杂菌生长繁殖[33]。Tan等[29]对高盐和碱性培养基中的培养物定期进行菌落计数和PCR污染测试,结果显示培养48 h后杂菌细胞干重仍少于3.5 g/L,仅为H.bluephagenesis数量的1/10。利用盐单胞菌作为底盘细胞避免了灭菌导致的能源消耗。
由于微生物耗氧量与所生产的生物质浓度密切相关,在发酵罐中进行高细胞密度培养时,需要向培养基中持续泵入充足的无菌氧气(或空气),这个过程增加的空气过滤流程导致了更高的能耗[34]。利用合成生物学方法对微生物进行改造,使其在低氧条件下维持正常的生长和生产效率是降低能量损耗的有效途径[35-37]。Ouyang等[38]将血红蛋白(VHb)导入盐单胞菌中,并利用双精氨酸转位酶途径(Tat)将其转运到细胞的周质空间,促进与氧气的接触和转运,使低氧条件下细胞干重提高了100%。Wu等[39]还发现,构建串联Pvgb重复序列的启动子可以在低曝气或高细胞密度条件下强有力地诱导PHA合成。除了以上策略,蛋白定向进化技术广泛应用于酶性能的改造[40]。筛选能够在低氧培养环境中保持高活性的突变,从而降低对氧气的需求,这是更加节能的方式之一,也是下一步研究的重点方向。
1.3 从灭菌不连续的批次发酵到开放连续发酵转变
连续发酵是指以一定的速度向发酵罐内不断添加新鲜培养基,同时以相同速度流出培养液,使发酵罐内液体量维持恒定的发酵过程[41]。相比分批发酵,连续发酵工艺将产生巨大的经济效益,包括:①避免间歇发酵中重复清洗和灭菌步骤,减少了人力、能量和时间消耗;②延长微生物指数增长时间,促进产物积累;③采用连续收获分离,降低了底物或产物的抑制作用[42]。虽然连续发酵具有这些优势,但由于长时间培养增加了污染的概率,普通微生物进行连续发酵存在较大风险。
盐单胞菌由于培养基中高盐和碱性环境可有效抑制杂菌生长,是开发连续发酵工艺的理想底盘细胞。Tan等[29]在H.bluephagenesis中建立了连续培养体系,并进行了为期14 d的不灭菌连续发酵培养。该体系包括两个发酵罐,第1发酵罐为MM-G培养基,培养条件为37℃、pH 9.0和50%溶解氧浓度(DO),24 h后细胞干重达40 g/L,PHB含量达60%,此时将第1发酵罐中的培养物连续泵送到第2发酵罐中,并在无氮源的培养基继续培养,第2发酵罐中的细胞干重在20 g/L左右,PHB水平保持在细胞干重的65%~70%。培养物泵出和培养基补充同时进行,保持发酵罐中培养物体积恒定。第2发酵罐中的培养物经分离后上清可继续用于配制第1或第2发酵罐的培养基,从而循环使用。经测定,第1发酵罐的葡萄糖转化率在20%~30%,第2发酵罐的葡萄糖转化率在50%以上。
Yue等[30]利用盐单胞菌H.campaniensisLS21进行了连续65 d的流加发酵培养未发生杂菌污染,重组菌产生的PHB大约占干重的70%,而野生型产生的PHB大约占干重的26%,重组质粒在整个流加发酵过程中稳定存在。
Ling等[43]对盐单胞菌的沉降性能进行了优化,获得了1 min内即可自动絮凝沉降的突变菌株,以此为基础进行了连续发酵培养,并进行了对比研究。在连续培养过程中,菌体移除后无需灭菌和接种,上清液可再次用于下一批的生长,在120 h的连续过程中,絮凝细胞被收集了4次,菌株细胞干重和PHB的产率分别从单次发酵的0.45 g/(L·h)和0.18 g/(L·h)提高到连续发酵的0.82 g/(L·h)和0.33 g/(L·h),几乎是批量生产的两倍[43]。这些结果表明无废水工艺不仅减少废水排放,而且在一定时间内增加了细胞生长和产品形成效率。
1.4 简化发酵过程与使用低成本原料
发酵过程的复杂程度直接影响生产效率和生产成本[44]。盐单胞菌由于生长在高盐和碱性环境中,可以有效抑制杂菌生长,因此发酵过程可以免除发酵设备、培养基和空气的灭菌程序,使发酵过程大大简化。由于不需要灭菌,发酵装置也不需要使用价格昂贵的不锈钢材料,可以用成本低廉的塑料甚至水泥发酵装置[9]。通过培育具有自絮凝特性的菌株,简化了后期菌体分离工艺,也可简化后期分离过程[43]。盐单胞菌作为下一代工业生物技术的底盘细胞,已经体现出了巨大的优势与潜力,未来通过改进发酵流程与发酵工艺,使用更低成本的发酵原料,将会进一步降低成本,提高盐单胞菌在绿色生物制造方面的优势。
盐单胞菌H.bluephagenesis可以利用葡萄糖、果糖、蔗糖、甘油等多种化合物作为底物生长进行培养[45]。为进一步降低底物成本,研究人员对厨余垃圾作为碳源进行了研究。Yue等[30]利用与厨房垃圾相似的混合基质,包括可溶性和不溶性纤维素、蛋白质、脂肪、脂肪酸和淀粉等对盐单胞菌进行培养,发现菌株H.campaniensisLS21能产生约70%的PHB。据测算,利用嗜盐菌构建的开放连续培养工艺,碳源转化率增加了40%,PHB生产成本控制在1.4万元/吨,只有Escherichia coli成本的一半[42]。
近年来,农产品加工的废弃物如去油米糠、水稻碾米水等被用作低廉底物进行PHA等化合物生产[46-47],开拓新兴低廉底物也是下一代工业生物技术的重要研究方向。
2 下一代工业生物技术开发和利用
2.1 盐单胞菌生物元件与调控工具开发

图2 盐单胞菌H.bluephagenesis中已开发的下一代分子生物技术工具(a)、方法(b)和合成的多种产物(c)[5]1—Porin启动子表达系统;2—T7-like诱导表达系统;3—CRISPRi基因编辑系统;4—CRISPR/Cas9基因编辑系统;5—提升氧气利用率;6—形态工程改造;7—高密度生长;8—大规模发酵;9—PHA产品类型(PHB、PHBV和P3HB4HB);10—其他产品类型(PhaP,PhaR,ALA和ectoine)gRNA—向导RNA;PHBV—聚3羟基丁酸-3羟基戊酸酯;RBS—核糖体结合位点;sgRNA—单链向导RNA;VHb—透明颤菌血红蛋白Fig.2 Engineering halophilic Halomonas spp.for NGIB tools(a),methods(b)and production of multiple products(c)1—Porin promoter expression system;2—T7-like expression system;3—CRISPRi engineering system;4—CRISPR/Cas9 engineering system;5—increasing oxygen availability;6—morphology engineering;7—high-cell-density growth;8—large-scale fermentation;9—PHA product types(PHB,PHBV,and P3HB4HB);10—other products(PhaP,PhaR,ALA,and ectoine)gRNA—guide RNA;PHBV—poly(3-hydroxybutyrate-co-3-hydroxyvalerate);RBS—ribosome binding site;sgRNA—single-guide RNA;VHb—Vitreoscilla hemoglobin
为对嗜盐菌进行调控和改造,许多调控工具、元件相继被开发出来[5][图2(a)、(b)]。Fu等[48]建立了质粒接合转化到嗜盐菌中的方法,并利用自杀载体pRE1126I-SceI建立了无标记的基因敲除技术。Tan等[45]在高拷贝质粒pSEVA341中连入LacIq-Ptrc系统实现嗜盐菌中多个基因的诱导表达。为实现外源基因的稳定整合和表达,Yin等[49]开发了基于强表达的porin基因的染色体表达系统。Li等[50]通过对porin基因启动子-35至-10区间进行突变,构建了转录活性变化达310倍的组成型启动子库,并通过将lac元件整合到核心启动子区,构建了诱导率大于200倍的可诱导启动子库。Shen等[51]进一步利用porin基因启动子-10区内部及上游分别进行4碱基与3碱基的饱和突变,构建了转录活性在40~140 000的稳定启动子库。Ouyang等将8个低氧诱导的vgb启动子串联,获得了低氧诱导的强启动子Pvgb[38]。Tao等[52]开发了盐单胞菌CRISPRi系统,并成功实现了对编码细菌分裂环形成蛋白的ftsZ基因、编码2-甲基柠檬酸合成酶的prpC基因和编码柠檬酸合成酶的gltA基因可控抑制。为了控制靶基因的表达水平,Zhao等[53]成功建立3个诱导表达系统MmP1、VP4和K1F,基因诱导倍数达3085倍,效率是Ptac启动子的2.5倍。Qin等[54]利用CRISPR/Cas9系统开发了一种高效、无瘢痕的盐单胞菌基因组编辑方法,基因敲除效率最高可达100%。调控工具和调控元件的不断开发使盐单胞菌的合成生物学改造变得更加方便、更加高效。
2.2 重组盐单胞菌用于生产多种产品
基于盐单胞菌的下一代工业生物技术是一个广谱的生产平台,已被成功用于合成PHB[55]、聚(3-羟基丁酸-co-3-羟基戊酸)(PHBV)[45]、聚(3-羟基丁酸-co-4-羟基丁酸)(P3HB4HB)[56]、表面活性剂蛋白[19]、5-氨基乙酰丙酸(ALA)[20]等多种材料及化学品[图2(c)]。PHB是研究最多的聚羟基脂肪酸酯材料。PHB是一种热塑性材料,性能与石油化工塑料聚乙烯和聚丙烯类似,它具有生物惰性、生物相容性和生物可降解性,在医学和生物医学领域有着广泛的应用前景[57]。传统菌株生产PHB,产量低、成本昂贵。利用盐单胞菌在实验室发酵条件下培养56 h后细胞干重达80 g/L,PHB含量达80%[29]。另外,抑制编码柠檬酸合成酶的gltA基因,将更多的乙酰辅酶A从三羧酸(TCA)循环引导到PHB合成途径,使盐单胞菌中PHB积累增加了约8%[52],而提高NADH/NAD+比值使PHB的积累量达到细胞干重的90%[55]。
PHBV是由3-羟基丁酸(3HB)和3-羟基戊酸(3HV)形成的共聚物,具有良好的生物可降解性和生物相容性,其材料物理和机械性能很大程度上取决于3HV比例[58]。在E.coli中利用葡萄糖为单一碳源,结合柠檬酸途径和苏氨酸生物合成途径可以将PHBV中的3HV比例提高,但菌株生长较差,PHBV含量较低,而且发酵过程中还要加入昂贵的诱导剂使生产成本增加[59]。在盐单胞菌中敲除编码2-甲基柠檬酸合成酶的prpC基因,丙酸转化为3HV单体的效率从约10%提高到近100%,过表达苏氨酸合成途径和苏氨酸脱氢酶基因,重组菌株TD08能够利用多种碳源合成PHBV,3HV比例在4%~6%(摩尔分数)[45]。在盐单胞菌中利用CRISPRi体系下调prpC基因,获得了3HV比例在1%~13%(摩尔分数)的多种PHBV共聚物[52]。通过敲除prpC和琥珀酸脱氢酶组装因子2编码基因sdhE,同时过表达编码甲基丙二酰辅酶A变位酶基因scpA、甲基丙二酰辅酶A脱羧酶基因scpB和磷酸烯醇丙酮酸羧化酶的编码基因ppc,重组菌株TY194细胞干重达6.3 g/L、PHBV占细胞干重65%,3HV单体含量为25%[17]。
P3HB4HB可用于心血管、软骨和神经组织的修复以及织工程支架[60]。在R.eutropha中利用豆油和γ-丁内酯(GBL)作为碳源进行P3HB4HB生产的尝试,得到了4-羟基丁酸(4HB)摩尔分数为6%~10%的共聚物[61]。提高GBL的供给可以提升共聚物中4HB的含量,但却降低了细胞干重(CDW)和PHA产率。Chen等[56]将编码4HBCoA转移酶的orfZ基因整合到嗜盐菌基因组中,使菌株能够利用GBL合成4HB,在发酵罐中培养48 h,细胞干重超过70 g/L,P(3HB-co-12%4HB)比例达63%。利用更强的Pporin启动子过表达orfZ基因时,菌株在7 L发酵罐中无灭菌分批发酵50 h后,CDW超过100 g/L,含有80%的P(3-HB-co-11% 4-HB)[51]。Ye等[62]在5 m3生物反应器中进行了中试放大研究,在数学模型和合理计算的帮助下,生长36 h后细胞干重达100 g/L,P(3HB-co-13.5%4HB)占比60.4%。通过敲除编码琥珀酸半醛脱氢酶基因gabD减弱4HB竞争途径,同时过表达琥珀酸半醛脱氢酶基因sucD、4-羟基丁酸脱氢酶基因4hbD、CoA转移酶基因orfZ、2-氧葡萄糖酸脱羧酶基因ogdA促进4HB-CoA合成,构建了以葡萄糖为唯一碳源的P3HB4HB合成菌株[18]。该菌株在7 L生物反应器中,非灭菌条件下培养60 h细胞干重达26.3 g/L,P(3HB-co-17.04% 4HB)含 量 达60.5%[18]。
Lan等[19]在嗜盐菌中构建了表面活性剂蛋白PhaP的高效表达系统,在开放发酵中得到了1.86 g/L的PhaP蛋白产量。ALA是一种重要的细胞中间代谢产物,在许多疾病的治疗中有重要作用[63-64],其生物法生产也是领域内关注的重点[65]。Li等[20]在H.bluephagenesisTD01中 构建了ALA合成途径,产量达到635 mg/L,同时PHB产量达到细胞干重的22%。
2.3 下游分离过程优化
发酵菌体分离是影响产物成本的重要因素,常用方法有离心分离法、常规过滤法和膜过滤法等。这些方法不但需要昂贵的设备而且损耗大量能量。为简化盐单胞菌分离程序,研究人员从增大细菌体积、增强细菌自凝絮性能等方面进行了优化,促进细胞更方便地从培养液中分离出来。
细菌体积调控的研究最早是在大肠杆菌中展开的,研究最多的是细胞骨架蛋白MreB和细胞分裂蛋白FtsZ[66-68]。Wang等[69]抑制E.coli中ftsZ基因,使细胞从棒状变为丝状,PHB含量和细胞干重增加100%,细胞静置20 min后可以自行沉降从发酵液中分离出来。Jiang等[70]删除E.coliJM109SG中mreB基因,使细胞变为球形,细胞尺寸增大到5~10μm,PHB含量也显著增加。Elhadi等[71]利用CRISPRi技术同时抑制ftsZ和mreB基因表达,产生形态各异、体积增大的细胞,并且细胞内PHB累积量与细胞体积成正比,约占细胞干重的40%~80%。由于mreB和ftsZ基因突变影响细菌分裂和生长,为更好地协调生长和体积调控的关系,急需进一步对调控策略进行优化。Jiang等首先构建mreB突变体,然后将mreB基因连入温敏质粒再转入突变体中,该菌株在30℃时能够表达一定量MreB蛋白,使细胞正常分裂生长,但当温度升到37℃时细胞中不再表达MreB,细胞体积增大,平均长度达到5µm;利用相同策略,ftsZ基因缺失细胞的平均长度达到500µm[59]。
除了增大细胞体积,改变细胞表面电荷是促进细胞沉降的另一条有效途径。Ling等[43]通过敲除H.campaniensisLS21中编码电子转移黄素蛋白的etf操纵子,使细胞表面电荷降低、细胞疏水性提高,在停止搅拌后大多数细胞在1 min内絮凝沉淀到反应器底部,实现便捷分离。
菌体收集之后的裂解和内含物的高效分离也是下一代工业生物技术研究的重要方向。Hajnal等[61]开发了基于lambda噬菌体裂解基因SRRz和合成核糖体结合位点(RBS)新型细胞自溶系统,当细胞生长至OD600>10,并通过离心进一步浓缩至OD600为200时,细胞自裂解可自发发生。Shen等[72]利用诱导型启动子在细胞平台期诱导minC和minD基因表达抑制分裂环形成,同时删除PHA颗粒表面结合蛋白基因phaP1,获得了细胞体积与PHA颗粒同时增大的菌株,PHA颗粒的尺寸最大达10μm。增大的PHA颗粒将降低回收难度,提高回收效率,对简化加工过程具有重要意义。
2.4 发酵规模放大
基于工程化盐单胞菌的下一代工业生物技术已经首先在PHA的大规模生产中取得突破(图3)[73]。Chen等[56]在盐单胞菌中构建了以葡萄糖和γ-丁内酯为底物合成P3HB4HB的工程化菌株,在1 L和7 L发酵罐中分别进行补料分批培养,在非无菌条件下培养48 h细胞干重超过70 g/L,P(3HB-co-12%4HB)含量达到干重的63%。在1000 L发酵罐中,经过48 h培养细胞干重可以达到83 g/L,P(3HB-co-16%4HB)占比达到61%。Ye等[62]进一步利用废葡萄糖酸盐代替葡萄糖作为碳源,使原料成本降低60%左右,同时建立数学模型并进行合理计算用于指导补料策略和放大生产。在5000 L发酵罐中生长36 h后,CDW达到100 g/L,含60.4% P(3HB-co-13.5% 4HB),通过优化废玉米浆的用量,P3HB4HB含量达到74%。在嗜盐菌中通过将发酵与下游提取工艺耦合,已成功地开发了一条稳定、连续、低成本、高效生产P3HB4HB等多种材料的开放式工艺。

图3 利用盐单胞菌成功合成多种不同PHA材料[73](a)使用T7-like诱导表达系统高产PHB;(b)利用非相关碳源在H.bluephagenesis TD08(prpC基因敲除)菌株生产PHBV;(c)利用γ-丁内酯和葡萄糖在H.bluephagenesis TD40中生产P3HB4HB;(d)在H.bluephagenesis TD(phaC敲除)菌株中生产PhaP蛋白;(e)在H.bluephagenesis TD(phaC敲除)菌株中生产PhaR蛋白;(f)在加大或者加长的H.campaniensis LS21中(mreB基因敲除或者ftsZ基因敲除)生产PHB;(g)第一个5000L不灭菌开放连续塑料发酵罐,Halomonas spp.在发酵罐中生长;(h)在H.bluephagenesis TD LTT22中生产ALA基因:phaC—编码PHA合酶;phaA—编码β-酮硫解酶;phaB—编码NADPH依赖乙酰乙酰辅酶A还原酶;prpC—编码2-柠檬酸甲酯合酶;orfZ—编码2-柠檬酸甲酯合酶;mreB—编码细胞骨架蛋白;ftsZ—编码细胞分裂蛋白;△ftsZ::ftsZ-gfp—gfp基因插入ftsZ基因的C端,使后者丧失功能;hem1—编码ALA合酶Fig.3 Engineering halophilic Halomonas spp.for production of multiple PHA products(a)Production of PHB using T7-like expression system in H.bluephagenesis TD-HⅠGH;(b)Production of PHBV in H.bluephagenesis TD08(without prpC)in the absence of propionic acid;(c)Production of P34HB in H.bluephagenesis TD40 usingγ-butyrolactone and glucose as carbon sources;(d)Production of PhaP in H.bluephagenesis TD(without phaC);(e)Production of PhaR by H.bluephagenesis TD(without phaC);(f)Production of PHB by enlarged or elongated H.campaniensis LS21 without mreB and deficient ftsZ,respectively;(g)The first 5000L plastic fermentor used to grow Halomonas spp.under open unsterile and continuous conditions;(h)Production of ALA in H.bluephagenesis TD LTT22Genes:phaC—encoding PHA synthase;phaA—encodingβ-ketothiolase;phaB—encoding NADPH dependent acetoacetyl-CoA reductase;prpC—encoding 2-methylcitrate synthase;orfZ—encoding 2-methylcitrate synthase;mreB—encoding cytoskeleton protein;ftsZ—encoding cell division protein;△ftsZ::ftsZ-gfp—a gfp gene was inserted into the C-terminal of ftsZ to destroy its function;hem1—encoding 5-amino-levulinic acid synthase
2.5 废水循环
下一代工业生物技术减少了淡水使用,但产生含盐废水。目前含盐废水处理是一个难题,常用的方法有焚烧法、蒸发法、离子交换法、吸附法、膜分离法、高级氧化法、生物法等[74-76]。无论采用哪种方法都将额外增加生产成本,因此减少含盐废水排放是下一代工业生物技术迫切需要克服的难题。Ling等[43]探索建立了废水循环使用技术体系,利用自凝絮菌株快速分离菌体后,在残留营养物质和发酵上清液中补充营养物质,无需再次灭菌和接种,直接用于下一批细胞的生长,同时洗涤细胞所用的水也可以被带回生物反应器中继续循环使用。利用该技术收集4批菌体仅产生1次高盐废水。这种发酵策略在降低下游处理成本的同时,还能促进细胞生长、增加PHB产量,进一步促进以工程化盐单胞菌为基础的下一代工业生物技术的推广应用。
3 结论和展望
随着盐单胞菌分子操作平台的不断完善和菌株性能的不断优化,具有开放、非灭菌、连续培养特点的下一代工业生物技术已经建立起来,并成功用于多种化学品的高效合成。相比传统工业生物技术,基于工程化盐单胞菌的下一代工业生物技术(NGIB)具有明显优势(表1)。主要表现在:
①节能:无需高温高压灭菌。
②节水:用海水替代淡水,过程水可循环利用。
③节时:生产过程可连续。
④设备投资少:无需使用不锈钢发酵系统,转而使用便宜的塑料、陶瓷甚至水泥罐体或管道等。
⑤产物终浓度高:细菌在高密度下进行产品合成。
⑥分离过程简化:增大细菌体积或表面电荷,利于重力或自凝絮沉淀。
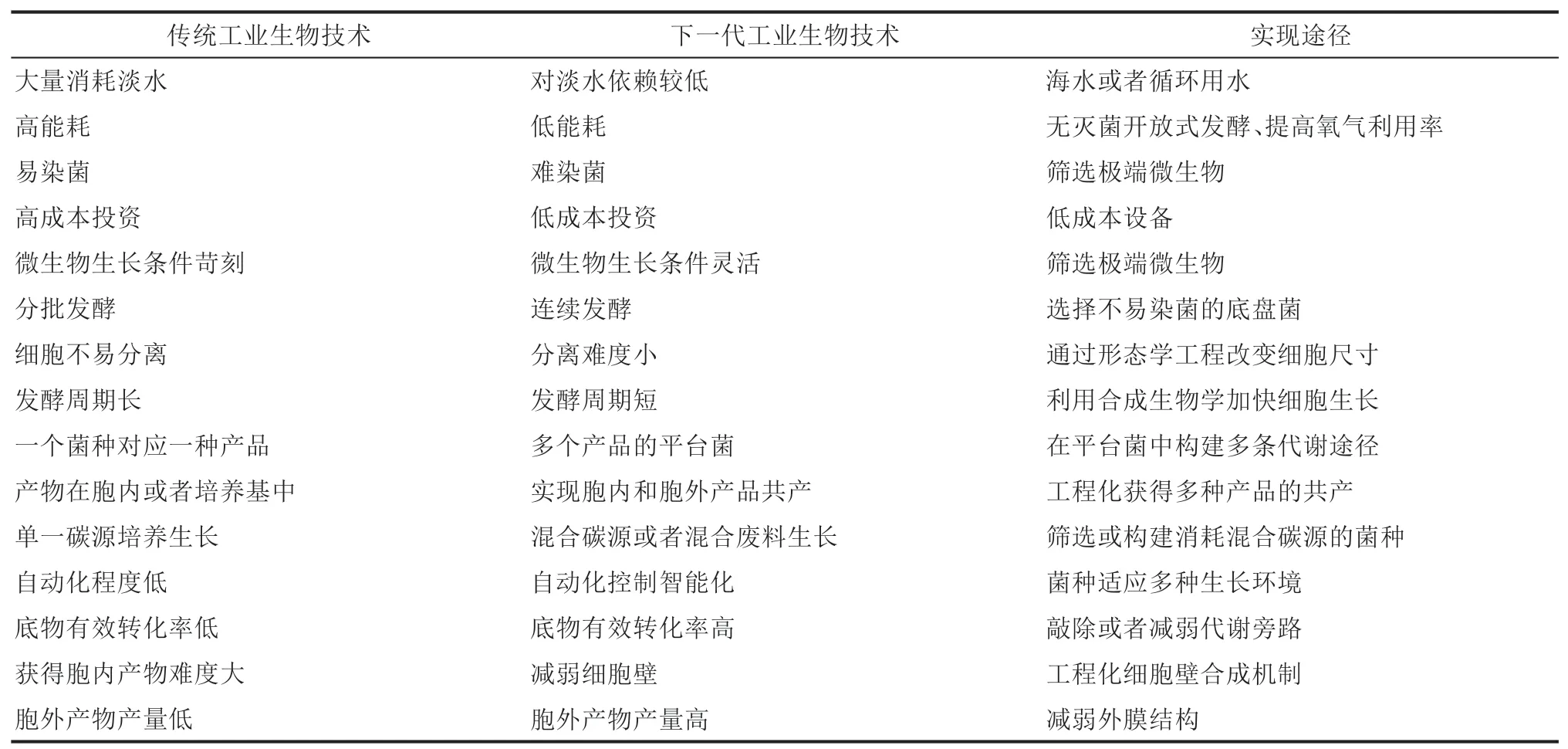
表1 下一代工业生物技术与当前工业生物技术对比[9]Tab.1 Next generation industrial biotechnology(NGIB)compared with current industrial biotechnology
现阶段NGIB还面临一些技术难点,主要包括含盐废水的处理及对设备可能造成的腐蚀问题、菌株遗传操作过程复杂问题和高密度下基因诱导表达成本高问题。为减少含盐废水排放,对底盘细胞进行筛选,获得了自凝絮底盘菌株,以此为基础建立了连续培养系统,减少废水排放。但目前该技术只在H.campaniensisLS21中取得成功,其他嗜盐菌株的自絮凝突变还有待进一步筛选。高浓度盐对不锈钢发酵罐的腐蚀在中性或酸性环境中是一个严重问题。但对于嗜盐嗜碱菌来说,其培养基pH在8.5以上,碱性环境下金属保持在稳定状态。本文作者在山东百盛生物科技有限公司多年来一直采用嗜盐菌生产PHA,未发现明显的发酵罐腐蚀现象。与E.coli相比,嗜盐菌的基因操作方法还不完善,H.bluephacenesis和H.campaniensis不能通过化学或电刺激进行质粒转化,而只能进行结合转化,增加了菌株改造的复杂性和难度。高密度发酵条件下基因诱导表达对PHA合成和细胞形态调控具有重要意义。目前常用的化学诱导剂价格昂贵、不同批次间稳定性差,在嗜盐菌中开发以温度、光、pH或溶解氧等为诱导因素的诱导系统将使发酵过程中细胞生长更易控制,同时节省成本。
未来下一代工业生物技术将进一步完善高盐废水循环利用策略,优化基因操作工具,加强高密度发酵条件下调控模块开发,加强对廉价底物利用途径的设计,拓宽技术应用规模和应用领域,实现多种化学品大批量生产。NGIB的不断完善使用将有力促进化工制造向绿色生物制造的转变,为大幅提升生物制造产品的竞争力贡献力量。
