H19靶向miR-130-5p调控自然杀伤细胞对前列腺癌细胞的杀伤作用
2020-12-24石涛高艳凡磊周本正丁志勇张大虎
石涛 高艳 凡磊 周本正 丁志勇 张大虎
(湖北医药学院附属襄阳医院(襄阳市第一人民医院) 1泌尿外科,湖北 襄阳 441000;2综合内科)
前列腺癌(PCa)是男性泌尿生殖系统中发病率较高的恶性肿瘤之一,现在的治疗方式有手术治疗,放射照射及化学治疗,内分泌治疗等,随着分子生物学及免疫学的发展,基因治疗和免疫治疗成为新的治疗方法〔1〕。自然杀伤(NK)细胞具有独立杀伤能力,是肿瘤免疫的第一道防线,且是细胞免疫的主要效应细胞,在PC细胞中低表达,免疫水平下降〔2〕。所以增强机体杀伤癌细胞的能力对PC的发生发展,治疗和预后具有重要意义。长链非编码RNA是一类无法编码蛋白质的RNA,可通过调控miRNA发挥作用,研究发现H19在多肿瘤中异常表达,通过其转录产物长链非编码RNAH19影响生长、增殖、分化凋亡及侵袭转移等过程〔3〕。H19在PC中发挥抑癌基因作用,可作为PC诊断、治疗、预后及药物敏感性的生物标记物〔4〕。但H19对NK细胞的杀伤作用的影响机制目前还不清楚。miRNA是一种内源性的非编码RNA,同样具有抑癌或促癌作用,研究发现miR-130-5p在PC细胞中低表达,过表达可抑制PC-3细胞的增殖和迁移,延缓PC的进展〔5〕。但miR-130-5p对NK细胞的杀伤作用的影响机制还尚未清楚,H19是否与miR-130-5p有关也尚未见报道,本文旨在研究H19与miR-130-5p的调控关系及影响NK细胞对PC细胞的杀伤作用。
1 材料与方法
1.1材料 NK细胞、PC细胞DU-145、PC-3和人正常前列腺上皮细胞(RWPE)-1购自中国科学院上海细胞库;胎牛血清、RPMI1640培养基、胰蛋白酶购自美国Gibico公司;Lipofectamine TM 2000购自Sigma公司;酶联免疫吸附试验(ELISA)试剂盒、噻唑蓝(MTT)试剂盒、双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;Trizol试剂、反转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;二喹啉甲酸(BCA)试剂盒、放射免疫沉淀(RIPA)裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒购自上海碧云天生物技术有限公司;抗体购自上海煊翎生物科技有限公司。
1.2方法
1.2.1细胞培养 NK细胞、PC细胞DU-145、PC-3和人正常前列腺上皮细胞RWPE-1用含10%胎牛血清的RPMI1640培养基于37℃、5% CO2饱和湿度条件下培养,每天换液一次,待细胞融和至80 %左右时,加入胰蛋白酶进行消化传代,选取对数生长期的细胞进行实验。
1.2.2细胞转染与分组 取对数生长期的PC-3细胞和NK细胞,同时接种两种细胞进行PC-3细胞与NK细胞共培养。将si-NC,si-H19、pcDNA3.1、pcDNA3.1-H19、miR-NC、miR-130-5p、anti-miR-NC、anti-miR-130-5p质粒载体分别转染至正常培养的PC细胞中;将si-NC,si-H19、miR-NC、miR-130-5p质粒载体分别转染至PC-3细胞与NK细胞共培养的细胞中;将si-H19分别与anti-miR-NC、anti-miR-130-5p质粒载体共转染至PC-3细胞与NK细胞共培养的细胞中;以上细胞培养48 h后收集待用。
1.2.3MTT检测细胞增殖 在各组细胞培养至48 h时加入20 μl(5 g/L)的MTT溶液,继续孵育4 h;弃去多余培养基并加入150 μl二甲基亚砜(DMSO)振荡反应10 min,酶标仪检测490 nm处吸光度(OD)值。细胞存活率(%)=实验组OD值/空白对照组OD值×100%。每组重复3次。
1.2.4ELISA法检测IFN-γ和TNF-α的表达水平 各组细胞,离心取上清,按ELISA试剂盒说明书进行检测。
1.2.5qRT-PCR检测miR-130-5p和H19的表达水平 收集各组细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA纯度和浓度。使用TaKaRa反转录试剂盒将RNA反转录成cDNA,按照TaKaRa 荧光定量试剂盒使用说明配制反应体系,以β-actin为内参进行PCR扩增,每个样品重复3次,循环条件为95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量采用2-△△Ct法计算。
1.2.6Western印迹检测HLA-G蛋白的表达 收集各组细胞,加入RIPA裂解液裂解,4℃,12 000 r/min离心15 min,收集蛋白上清液,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE后转至PVDF膜上,5%脱脂奶粉封闭液室温封闭1 h。分别加入一抗(1∶1 000),4℃孵育过夜,TBST洗膜;加入二抗(1∶2 000)室温孵育2 h,TBST洗涤3次,每次10 min,后在暗室中曝光显影,再浸入定影,最后洗去残液晾干,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和GAPDH条带的比值作为蛋白表达水平。每个蛋白样品重复3次。
1.2.7荧光素酶报告基因检测实验检测H19和miR-130-5p及miR-130-5p和HLA-G的靶向调控 TargetScan数据库显示H19和HLA-G 3′UTR区域有miR-130-5p结合位点。构建野生型(WT)和突变型(MUT)基因靶点H19和HLA-G的3′UTR-荧光素酶表达载体(WT-H19、WT-HLA-G、MUT-H19和MUT-HLA-G),取对数生长期PC-3细胞接种于24孔板(5×104个/孔),待细胞生长至80 %融合时,用LipofectamineTM2000将WT-H19、WT-HLA-G、MUT-H19和MUT-HLA-G组细胞分别转染miR-NC和miR-130-5p。依据说明书要求,使用荧光素酶报告基因检测仪进行双荧光素酶报告实验测定。实验结果以荧光素酶活性和Renilla活性的比值进行统计学分析。实验重复3次。
1.3统计学分析 采用SPSS20.00软件行t检验,方差分析。
2 结 果
2.1H19、miR-130-5p在PC细胞DU-145、PC-3和人正常前列腺上皮细胞RWPE-1中的表达 相较于人正常前列腺上皮细胞RWPE-1,PC细胞DU-145、PC-3中miR-130-5p的表达水平显著降低;H19的表达水平显著升高(P<0.05)。见表1。

表1 H19和miR-130-5p的表达
2.2干扰H19表达的PC-3细胞与NK细胞共培养后对PC-3细胞存活率及对NK细胞产生细胞因子的影响 si-NC组比较,si-H19组PC-3细胞与NK细胞共培养后H19的表达水平显著降低(P<0.05)。与si-NC组比较,si-H19组PC-3细胞与NK细胞共培养后对PC-3细胞存活率显著降低(P<0.05)。与si-NC组比较,si-H19组PC-3细胞与NK细胞共培养后NK细胞中IFN-γ、TNF-α的表达水平显著升高(P<0.05)。与si-NC组比较,si-H19组PC-3细胞HLA-G蛋白的表达水显著降低(P<0.05)。见表2,图1。

表2 抑制H19表达的PC-3细胞与NK细胞共培养后对PC-3细胞存活率及对NK细胞产生细胞因子的影响
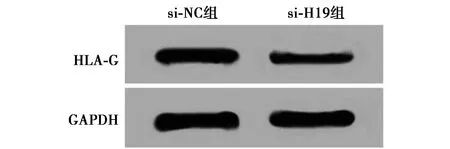
图1 抑制H19对HLA-G蛋白表达的影响
2.3H19靶向调控miR-130-5p的表达 通过TargetScan数据库预测到H19与miR-130-5p存在结合位点见图2。转染野生型H19基因表达载体WT-H19后,与miR-NC组比较,miR-130-5p组WT-H19前列腺癌PC-3细胞的荧光素酶活性显著降低(P<0.05);而转染突变型H19基因表达载体MUT-H19后,与miR-NC组比较,miR-130-5p组MUT-H19前列腺癌PC-3细胞的荧光素酶活性差异不显著。见表3。与pcDNA3.1组(0.45±0.04)比较,pcDNA3.1-H19组PC-3细胞中miR-130-5p的表达水平(0.15±0.01)显著降低;与si-NC组(0.48±0.04)比较,si-H19组PC-3细胞中miR-130-5p的表达水平显著升高(0.75±0.04,P<0.05)。
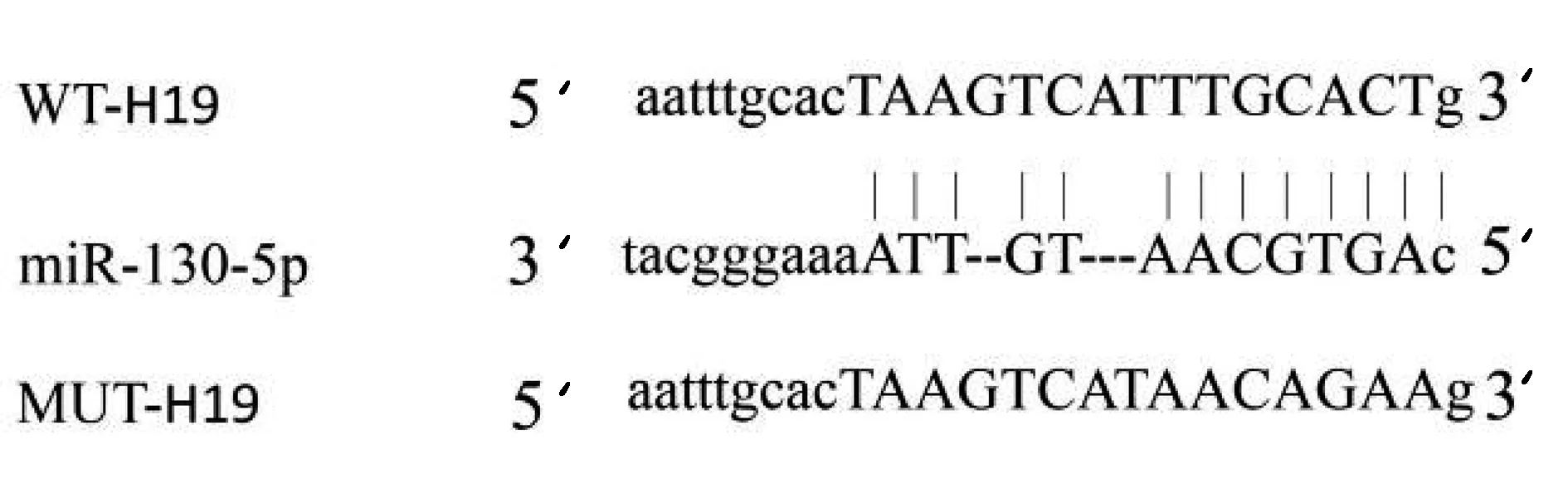
图2 H19和miR-130-5p的互补序列

表3 双荧光素酶报告实验
2.4过表达miR-130-5p的PC-3细胞与NK细胞共培养后对PC-3细胞存活率及对NK细胞产生细胞因子的影响 miR-NC组比较,miR-130-5p组PC-3细胞与NK细胞共培养后miR-130-5p的表达水平显著升高(P<0.05)。与miR-NC组比较,miR-130-5p组PC-3细胞与NK细胞共培养后对PC-3细胞存活率显著降低(P<0.05)。miR-NC组比较,miR-130-5p组PC-3细胞与NK细胞共培养后NK细胞中IFN-γ、TNF-α的表达水平显著升高(P<0.05)。与miR-NC组比较,miR-130-5p组PC-3细胞HLA-G蛋白的表达水显著降低(P<0.05)。见图3,表4。

图3 过表达miR-130-5p对HLA-G蛋白表达的影响
表4 过表达miR-130-5p的PC-3细胞与NK细胞共培养后对PC-3细胞存活率及对NK细胞产生细胞因子的影响
2.5抑制miR-130-5p表达的PC-3细胞与NK细胞共培养后能逆转干扰H19增强NK细胞对PC-3细胞的杀伤作用 与si-NC组比较,si-H19组PC-3细胞与NK细胞共培养后miR-130-5p的表达水平显著升高;与si-H19+anti-miR-NC组比较,si-H19+anti-miR-130-5p组PC-3细胞与NK细胞共培养后miR-130-5p的表达水平显著降低(P<0.05)。与si-NC组比较,si-H19组PC-3细胞与NK细胞共培养后对PC-3细胞存活率显著降低;与si-H19+anti-miR-NC组比较,si-H19+anti-miR-130-5p组PC-3细胞与NK细胞共培养后对PC-3细胞存活率显著升高(P<0.05)。与si-NC组比较,si-H19组PC-3细胞与NK细胞共培养后NK细胞中IFN-γ、TNF-α的表达水平显著升高;与si-H19+anti-miR-NC组比较,si-H19+anti-miR-130-5p组PC-3细胞与NK细胞共培养后NK细胞中IFN-γ、TNF-α的表达水平显著降低(P<0.05)。与si-NC组比较,si-H19组PC-3细胞HLA-G蛋白的表达水显著降低;与si-H19+anti-miR-NC组比较,si-H19+anti-miR-130-5p组PC-3细胞HLA-G蛋白的表达水显著升高(P<0.05)。见表5,图4。
表5 抑制miR-130-5p表达的PC-3细胞与NK细胞共培养后能逆转干扰H19增强NK细胞对PC-3细胞的杀伤作用
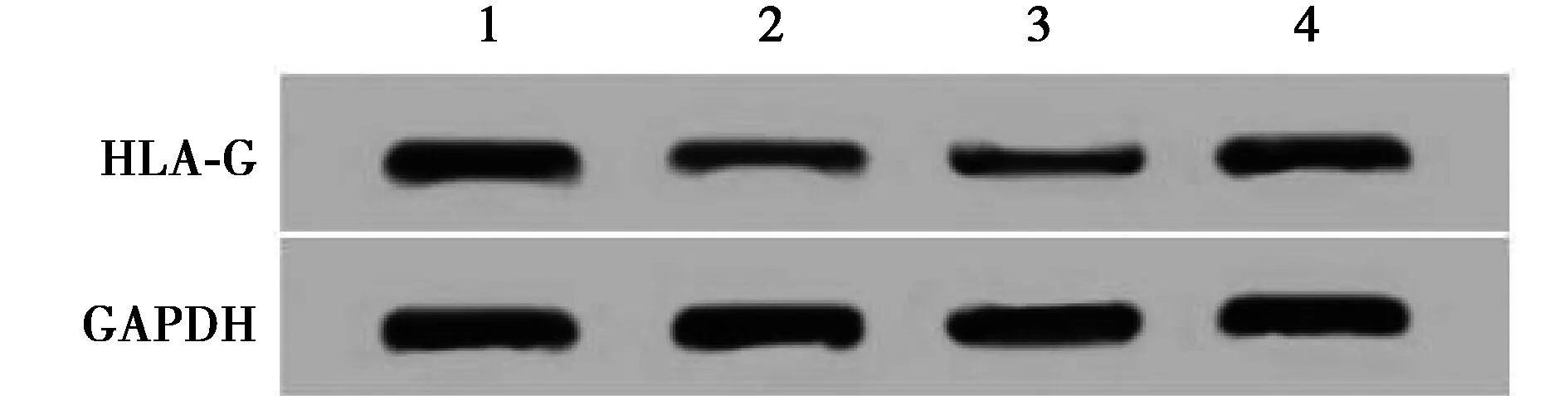
1~4:si-NC组、si-H19组、si-H19+anti-miR-NC组、si-H19+anti-miR-130-5p组图4 抑制miR-130-5p表达能逆转干扰H19对HLA-G蛋白表达的影响
2.6miR-130-5p靶向调控HLA-G的表达 通过TargetScan数据库预测到HLA-G与miR-130-5p存在结合位点,见图5。转染野生型HLA-G基因表达载体WT-HLA-G后,与miR-NC组比较,miR-130-5p组WT-HLA-G前列腺癌PC-3细胞的荧光素酶活性显著降低(P<0.05);而转染突变型HLA-G基因表达载体MUT-HLA-G后,miR-NC组比较,miR-130-5p组MUT-HLA-G前列腺癌PC-3细胞的荧光素酶活性差异不显著,见表6。与miR-NC组(0.86±0.04)比较,miR-130-5p组PC-3细胞中HLA-G的表达水平显著降低(0.51±0.02,P<0.05);与anti-miR-NC组(0.89±0.04)比较,anti-miR-130-5p组PC-3细胞中HLA-G的表达水平显著升高(1.19±0.05,P<0.05)。见图6。

图5 HLA-G得3'UTR含有miR-130-5p的互补序列

表6 双荧光素酶报告实验
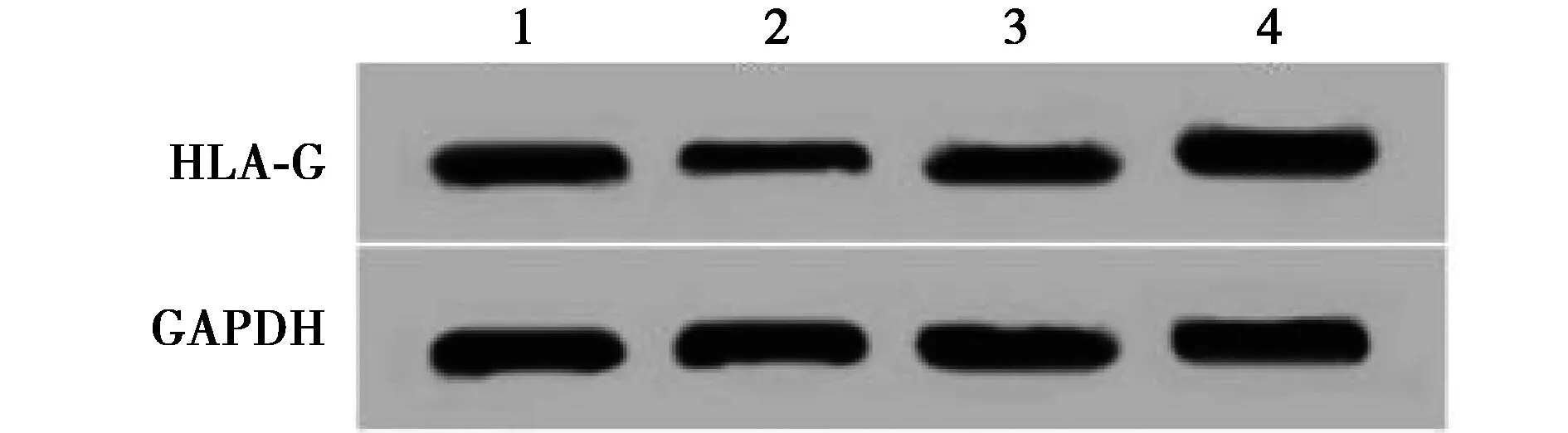
1~4:miR-NC组、miR-130-5p组、anti-miR-NC组、anti-miR-130-5p组图6 HLA-G和miR-130-5p的互补序列及HLA-G蛋白的表达
3 讨 论
随着对PC肿瘤免疫学等研究的深入,靶向免疫治疗被认为是PC较有前景的治疗方式〔6〕。NK细胞无需特异性抗原就可以直接杀伤靶细胞,可溶解细胞,分泌细胞因子,有强的抵御肿瘤的能力〔7〕。但肿瘤细胞仍能逃避NK细胞的杀伤,因此增强NK细胞抗肿瘤活性和提高NK细胞特异性杀伤力对于肿瘤的治疗至关重要〔8〕。研究发现抑制IL-6能增强NK细胞对PC的免疫杀伤能力,抑制了肿瘤的生长〔9〕。硼替佐米能增强PC细胞对NK细胞介导细胞杀伤作用的敏感性〔10〕。而非编码RNA在免疫细胞活化和功能中也发挥重要作用,长链非编码RNA(LncRNA)AK036396通过Fcnb能够有效调控粒细胞样髓源性抑制细胞免疫抑制功能进而影响机体抗肿瘤免疫〔11〕。LncRNA H19在PC中呈现高表达,抑制其表达可有效抑制PC细胞的糖代谢和生长〔12〕。本研究结果也显示在PC细胞中H19高表达,而且还发现干扰H19表达可以促进NK细胞释放IFN-γ和TNF-α,抑制与NK细胞共培养的PC-3细胞的存活,即增强NK细胞对PC-3细胞的杀伤作用。
miRNA参与各种免疫细胞的产生、增殖、发育及免疫应答过程中,通过调节相关靶基因的表达发挥着重要的调控作用〔13〕。降低miR-378和miR-30e的表达可增强NK细胞杀伤能力〔14〕。而miR-130-5p对NK细胞的影响未见报道,研究发现miR-130b-5p在肾癌组织和细胞系中高表达,参与肾癌的发生发展相关,可作为肾癌肿瘤标志物〔15〕。miR-130b-5p通过靶向RASAL1促进胃癌细胞的增殖,迁移和侵袭〔16〕。miR-130b过表达可通过增殖阻断基因和细胞衰老激活的表观遗传调控有效诱导PC细胞生长停滞〔17〕。miR-130b通过下调MMP2抑制前列腺癌转移〔5〕。本研究结果显示PC细胞中miR-130-5p低表达,过表达miR-130-5p抑制PC-3细胞的存活,即增强NK细胞的杀伤力。
HLA-G属于非经典的HLA-Ⅰ类分子,一种免疫调节分子,在多种肿瘤中异常表达,参与肿瘤免疫逃逸机制〔18〕。HLA-G能与NK表面受体结合,参与调控NK细胞免疫功能,抑制NK细胞的杀伤作用,调节NK细胞表面受体及细胞因子的表达〔19〕。肿瘤细胞中HLA-G表达可抑制NK细胞的杀伤活性〔20〕。且因HLA-G诊断PC的敏感度和特异度较高,可作为PC的早期筛查和诊断的有效肿瘤标志物〔21〕。研究发现万珂通过下调HLA-Ⅰ类分子的表达可增强NK细胞对PC的杀伤能力〔22〕。HLA-G多是通过miRNA介导调控发挥作用,研究发现在人绒癌JEG-3细胞中miR-133负性调控HLA-G的表达〔23〕,miR-152也能靶向调控HLA-G的表达〔24〕。LncRNA HOTAIR通过抑制胃癌细胞中的miR-152来促进HLA-G的表达〔25〕。本研究发现H19靶向调控miR-130-5p的表达,而miR-130-5p靶向调控HLA-G的表达,干扰H19表达和过表达miR-130-5p均抑制HLA-G蛋白的表达,说明H19可通过miR-130-5p间接调控HLA-G的表达。
