Neuman干预模式在肝移植术后高血糖患者中的应用效果
2020-12-23周利平崔恒盛俊胡婕夏雪峰
周利平 崔恒 盛俊 胡婕 夏雪峰
[摘要] 目的 探究Neuman干預模式应用于肝移植术后高血糖患者中的应用效果。 方法 选取2018年1月—2019年1月南京大学医学院附属南京鼓楼医院收治的肝移植术患者86例,采用随机数字表法分为对照组和观察组,各43例。对照组给予常规干预模式,观察组给予Neuman干预模式。比较两组血糖控制情况、治疗相关指标变化情况及术后并发症发生率及患者家属满意度。 结果 干预后,两组空腹血糖及餐后2 h血糖水平均低于干预前,且观察组低于对照组,差异有高度统计学意义(P < 0.01);观察组干预后切口愈合时间、血糖达标时间及住院时间均短于对照组,血糖达标时胰岛素用量低于对照组,差异均有高度统计学意义(均P < 0.01);观察组干预后术后并发症发生率低于对照组,差异有统计学意义(P < 0.05);观察组患者家属满意度高于对照组,差异有统计学意义(P < 0.05)。 结论 Neuman干预模式应用于肝移植术患者中,可有效控制患者的血糖情况,改善其治疗相关指标变化情况,同时对于降低术后并发症发生率具有重要意义,值得推广。
[关键词] Neuman干预模式;肝移植术;血糖控制;术后并发症
[中图分类号] R473.6 [文献标识码] A [文章编号] 1673-7210(2020)10(a)-0155-04
Application effect of Neuman intervention model in patients with hyperglycemia after liver transplantation
ZHOU Liping CUI Heng▲ SHENG Jun HU Jie XIA Xuefeng
Department of General Surgery, Nanjing Drum Tower Hospital, Nanjing University Medical College, Jiangsu Province, Nanjing 210008, China
[Abstract] Objective To investigate the effect of Neuman intervention model in patients with hyperglycemia after liver transplantation. Methods From January 2018 to January 2019, 86 patients with liver transplantation admitted to Nanjing Drum Tower Hospital of Nanjing University Medical College were selected and divided into control group and observation group by random number table method, 43 in each group. The control group was given routine intervention mode, while the observation group was given Neuman intervention mode. The blood sugar control, the change of treatment-related indicators and the incidence of postoperatre complications and familys′ satisfaction were compared between the two groups. Results After intervention, fasting blood glucose and 2 h postprandial blood glucose levels in both groups were lower than those before intervention, and the observation group was lower than the control group, with high statistically significant differences (P < 0.01); the incision healing time, blood glucose compliance time, and hospital stay time of observation group were all shorter than the control group, and the insulin consumption was lower than that of the control group when the blood glucose reached the standard, the differences were statistically significant (all P < 0.01); the incidence of postoperative complications in the observation group was less than in the control group, the difference was statistically significant (P < 0.05). The satisfaction of the family in observation group was higher than the control group, and the difference was statistically significant (P < 0.05). Conclusion Neuman intervention model can effectively control the blood sugar of patients after liver transplantation, improve the changes of treatment-related indicators, and reduce the incidence of postoperative complications, it is worth promoting.
[Key words] Neuman intervention model; Liver transplantation; Blood sugar control; Postoperative complications
目前,慢性肝炎、肝硬化及肝癌等疾病发病率逐渐升高,肝移植术是治疗肝脏疾病晚期最为有效的手段之一[1]。但由于肝移植术属于异体移植,在术后患者会出现不同程度的免疫损伤、急性应激反应等,因此在术后患者需要使用免疫制剂类与类固醇类激素,导致其自身激素分泌异常,使其血糖升高[2-3]。血糖升高为肝移植术后患者最为常见的并发症,机体血糖升高达到一定状态后,会对手术切口、病情恢复等带来较大的影响,进而影响患者的预后效果。移植肝在早期尚未适应新机体,血糖过高会加重肝糖原合成负担,损伤患者的肝脏[4]。因此,给予有效干预以控制机体血糖情况显得尤其重要。常规干预模式包括生命体征监测、生化指标监测及饮食指导等干预,较为注重患者的疾病情况,但对于患者的心理与精神方面的关注度不高,导致其心理状态不佳,难以配合术后各项干预工作。Neuman干预模式界定了患者生理、心理、社会文化、发展与精神等5个变量,变量之间相互作用,通过实施有效干预使患者能够维持稳定的状态,进而改善其预后情况[5-6]。为探究应用于肝移植术患者更为有效的干预模式,本研究将Neuman干预模式应用于肝移植术患者中,并探究其对血糖控制情况、治疗相关指标变化情况与术后并发症发生率的影响。结果报道如下:
1 资料与方法
1.1 一般资料
选取2018年1月—2019年1月南京大学医学院附屬南京鼓楼医院(以下简称“我院”)收治的肝移植术患者86例,采用随机数字表法分为对照组和观察组,各43例。对照组男24例,女19例;年龄55~75岁,平均(67.85±6.54)岁;病程3~7年,平均(5.12±1.23)年;疾病类型:原发性肝癌19例,肝炎后肝硬化8例,胆汁性肝硬化6例,急性肝衰竭10例;肝脏储备功能分级(Child-Pugh):A级12例,B级27例,C级4例。观察组男25例,女18例;年龄55~75岁,平均(67.91±6.47)岁;病程3~7年,平均(5.03±1.14)年;疾病类型:原发性肝癌18例,肝炎后肝硬化9例,胆汁性肝硬化5例,急性肝衰竭11例;Child-Pugh:A级10例,B级28例,C级5例。两组一般资料比较,差异无统计学意义(P > 0.05),具有可比性。本研究经医院医学伦理委员会审批通过。
1.2 纳入标准
均为首次接受肝移植手术;术后出现高血糖,即空腹血糖≥7.00 mmol/L、餐后2 h血糖≥11.10 mmol/L;接受胰岛素注射控制血糖;均自愿参与本研究,并签署知情同意书。
1.3 排除标准
术前存在高血糖;合并心脑血管、神经系统等疾病;存在精神疾病;存在沟通、认知障碍。
1.4 方法
1.4.1 对照组 给予常规干预模式,具体如下:①生命体征监测:医护人员密切监测患者的意识与瞳孔变化,持续对其进行心电监护,同时定时测量其血氧饱和度、体温、血压等指标的变化情况;若患者出现低体温现象,采用电热毯保暖或调高病房内的温度等。②生化指标监测:医护人员对患者的电解质、肝功能与肾功能等生化指标实施动态监测,按照生化指标检查结果、医嘱等适量给予患者补充蛋白质、利尿药物,以防患者出现低蛋白症而造成营养不良性腹水。③24 h出入量监测:医护人员观察并记录患者24 h内的出入量;记录患者胆汁的排出量与黏稠度,判断其是否存在排斥反应;记录患者的尿量,在其尿量少时注意检查尿管是否存在扭曲、堵塞等情况,适当增减利尿药物的用量。④饮食指导:在术后24 h内以肠外营养为主,按照移植肝代谢特点,给予患者适量葡萄糖、氨基酸、白蛋白等,并通过静脉补液提供能量,但在此过程中注意机体水电解质平衡;在术后24 h后给予肠内营养,减少静脉补液量;在术后4~5 d,在患者胃肠功能恢复正常后,可给予流质食物,并逐步过渡至半流质、软食,同时医护人员鼓励患者摄入高蛋白、高碳水化合物、低脂肪的饮食,严格限制脂肪的摄入。
1.4.2 观察组 给予Neuman干预模式,包括应激源、机体防御与干预措施,主要经三级预防模式进行,具体如下:①一级预防:医护人员在术前为患者营造舒适的病房环境,确保病房内通风性、采光性良好,确保室内湿度、温度适宜;在患者入院后及时对其进行心理干预,向患者及其家属介绍病房的相关设置,为其解决疑虑;医护人员在术前向患者讲解手术相关流程,向患者讲明在术中配合医生的重要性,并告知其在术后可能发生的并发症及预防措施,让患者能够以良好心态进行手术,减少其压力源;为患者播放手术相关视频,向其展示成功手术的案例,协助其树立战胜疾病的自信心。②二级预防:医护人员在术后密切监测患者的血糖情况,以便早期发现其血糖升高或其他并发症情况;若患者出现血糖升高情况时,医护人员及时告知医生,给予患者早期用药,并从饮食、训练、教育等方面对患者进行干预,密切观察患者血糖升高后造成的感染、切口难以愈合等情况;加强对患者心理状态的关注,及时缓解其心理压力。③三级预防:在患者身体状况趋于稳定后给予三级预防,告知患者术后规律饮食的重要性,并鼓励患者家属给予患者支持与监督。
1.5 观察指标
1.5.1 血糖控制情况 观察并记录干预前后患者的血糖控制情况,包括空腹血糖、餐后2 h血糖指标。
1.5.2 治疗相关指标变化情况 记录干预后患者切口愈合时间、血糖达标时间(空腹血糖<7.00 mmol/L,且餐后2 h血糖<11.10 mmol/L)、血糖达标时胰岛素用量与住院时间。
1.5.3 术后并发症发生率 观察并记录在干预后患者出现肺部感染、肾衰竭等并发症的发生情况。
1.5.4 满意度 采用我院自制满意度调查问卷对两组家属满意度进行评价,主要分为十分满意、一般、不满意3个等级,满意度=(十分满意+一般)例数/总例数×100%。
1.6 统计学方法
采用SPSS 25.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,组间比较采用t检验;计数资料采用例数和百分率表示,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
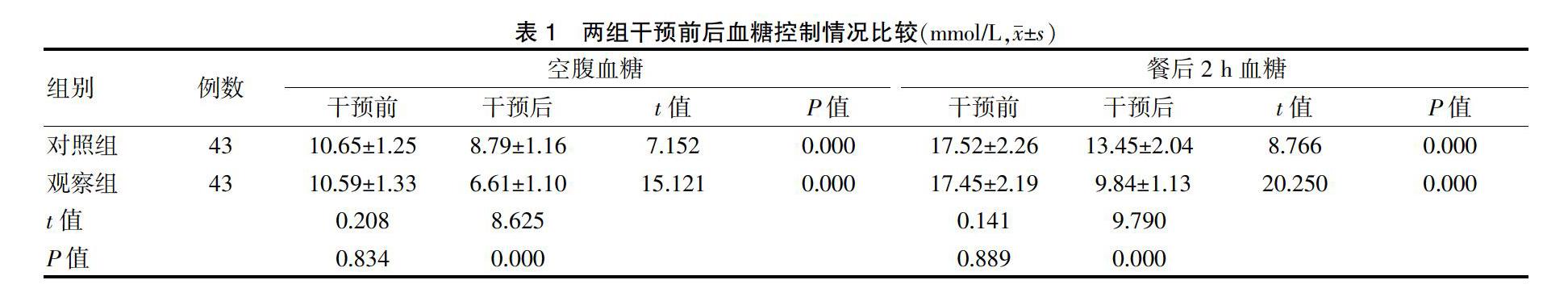
2.1 两组干预前后血糖控制情况比较
干预后,两组空腹血糖及餐后2 h血糖水平均低于干预前,且观察组低于对照组,差异有统计学意义(P < 0.05)。见表1。
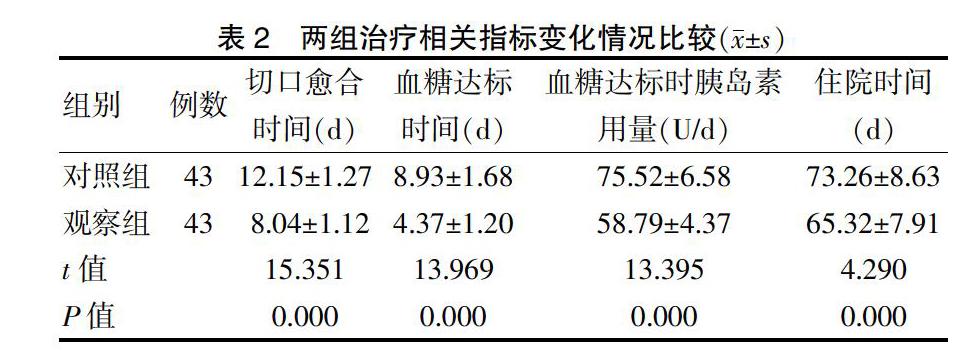
2.2 两组治疗相关指标变化情况比较
干预后,观察组切口愈合时间、血糖达标时间及住院时间均短于对照组,血糖达标时胰岛素用量低于对照组,差异均有统计学意义(均P < 0.05)。见表2。
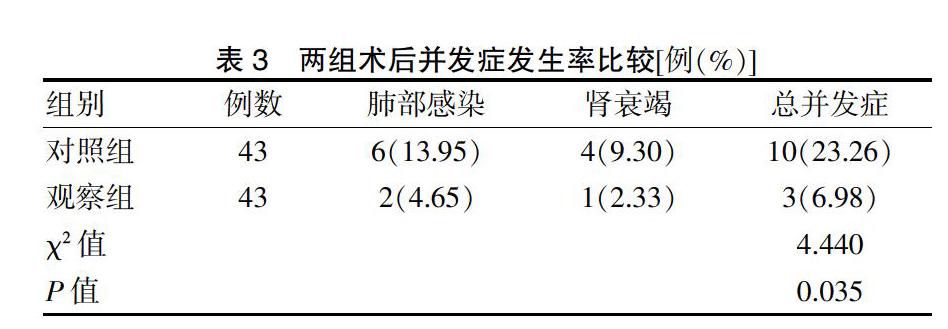
2.3 两组术后并发症发生率比较
干预后,观察组术后并发症发生率低于对照组,差异有统计学意义(P < 0.05)。见表3。
2.4 两组患者家属满意度比较
观察组满意度高于对照组,差异有统计学意义(P < 0.05)。见表3。
3 讨论
3.1 Neuman干预模式对肝移植术患者血糖控制情况的影响
肝移植手术应激、术后大剂量激素与免疫抑制的使用,极易导致术后患者血糖升高[7]。大剂量糖皮质激素的使用会导致机体胰岛素的分泌降低、胰高血糖素的分泌增高,同时会导致胰岛素降血糖的效率下降,最终使患者血糖升高,而持续高血糖会对患者的肾功能带来一定损害,影响术后患者的康复进程[8-9]。在本研究中,观察组干预后血糖控制情况优于对照组(P < 0.05)。其原因为Neuman干预模式能够将患者的生理、心理与社会进行有机结合,密切监测患者的血糖情况,在出现高血糖情况时医护人员能够及时告知医生,尽早给予针对性治疗,并从饮食、知识教育等方面对患者进行干预,使其了解血糖控制对于疾病康复的重要性,积极配合干预工作。此外,医护人员还会给予患者一定心理干预,避免其心理应激过高而导致血糖升高,进而有效改善患者的血糖控制情况[10-11]。
3.2 Neuman干预模式对肝移植术患者治疗相关指标变化情况的影响
肝脏为维持机体血糖稳定的主要器官,在肝移植后肝脏早期功能较差,导致机体对血糖敏感性降低,使机体内环境处于紊乱状态,血糖升高,进而延长切口愈合时间[12-13]。在本研究中,观察组干预后治疗相关指标变化情况优于对照组(P < 0.05)。其原因为Neuman干预模式能够有效分析围术期患者的压力源,如病房环境、亲属关系等,医护人员在干预时能够有效结合压力源实施干预,如向患者讲解病房环境、鼓励家属给予患者支持等,缓解患者对陌生环境的恐惧感,同时还能够加强患者及其家属之间的联系,改善其心理状态,促使其切口愈合,改善治疗相关指标变化情况[14-15]。
3.3 Neuman干预模式对肝移植术患者术后并发症发生率及满意度的影响
肝移植术是原发性肝癌、急性重症肝炎的主要治疗方式,但手术过程中操作较为复杂、手术耗时较长、手术创伤较大,在术后还需要给予患者激素、免疫抑制剂等药物,使机体内环境不稳定,血糖控制情况不佳[16-17]。持续高血糖会使机体白细胞吞噬功能出现异常,易出现感染。在手术过程中,由肝脏合成的血管活性物质会进入机体的血液循环中,导致肾脏损伤,严重时会出现肾衰竭,加重患者病情[18]。在本研究中,观察组干预后术后并发症发生率低于对照组,且观察组较对照组满意度更高(P < 0.05)。其原因为Neuman干预模式包括一级预防、二级预防与三级预防,在不同阶段给予患者不同的干预,如在一级预防中,能够为患者营造良好住院环境,确保室内通风性良好,避免出现空气污染等;在二级预防中,密切监测患者生命体征变化,做到早期发现、早期治疗,进而有效减少患者肺部感染、肾衰竭等并发症的发生,且患者由于病情明显改善,满意度更高[19-21]。
综上所述,Neuman干预模式应用于肝移植术患者中,可有效控制患者的血糖情况,改善其治疗相关指标变化情况,减少术后患者肺部感染、肾衰竭等并发症的发生,值得临床推广。
[参考文献]
[1] 徐琪.护理干预对肝移植术后患者肺部真菌感染的观察[J].中国卫生标准管理,2019,10(4):165-167.
[2] 解恩博,轩凤慧,孙晓东,等.肝移植术后早期并发症的危险因素分析[J].临床肝胆病杂志,2018,34(6):1282-1288.
[3] 吴英,任辉,廖睿,等.同伴支持对肝移植术后患者心理及生活质量的影响[J].中国护理管理,2018,18(12):1700-1704.
[4] Niazi S,Schneekloth T,Taner CB. Elderly recipients of liver transplantation:impact of age and psychosocial variables on outcome [J]. Curr Opin Organ Transplant,2017, 22(6):588-592.
[5] 成建斌,江雪梅,劉鹏,等.肝癌肝移植术后复发的干预措施疗效评价:网状荟萃分析[J].中华移植杂志:电子版,2018,12(4):183-187.
[6] 冷艳娜,王瑜贵,雷联会,等.Neuman护理模式对肝移植术后患者血糖控制的影响[J].齐鲁护理杂志,2018,24(6):74-76.
[7] 胡维昱,王建红,胡骁,等.肝移植术后中期肝脏血流动力学与肝功能异常的关系[J].器官移植,2016,7(4):296-300.
[8] Samuel D,Coilly A. Management of patients with liver diseases on the waiting list for transplantation:a major impact to the success of liver transplantation [J]. BMC Med,2018,16(1):113.
[9] 樊嘉,史穎弘,田孟鑫.肝癌肝移植术后肿瘤复发的防治策略[J].中华消化外科杂志,2019,18(1):20-23.
[10] 孟稼祥,万平,薛峰,等.儿童肝移植术后病原菌感染的危险因素分析[J].肝胆外科杂志,2017,25(6):412-415.
[11] 吕少诚,王苑,潘冰,等.肝移植术后肺部感染的诊治及其危险因素[J].中华肝胆外科杂志,2018,24(6):371-375.
[12] 李彩霞,卢惠娟,徐建鸣,等.肝移植术后代谢并发症危险因素及管理措施的研究进展[J].护理研究,2017,31(20):2433-2436.
[13] Jackson KR,Cameron A. Liver Transplantation:Candidate Selection and Organ Allocation in the United States [J]. Int Anesthesiol Clin,2017,55(2):5-17.
[14] 陆建文,董健,张谞丰,等.肠道微生态与肝移植及肝移植术后缺血性胆道病变的关系[J].器官移植,2016,7(4):315-319.
[15] 王海清,李磊,杨家印.肝癌肝移植术后的复发机制与防治策略[J].中华肝脏病杂志,2018,26(2):93-97.
[16] 陈榕,江涛,张冬华,等.原发性肝癌患者肝移植术后无激素免疫抑制方案的临床疗效[J].中华肝胆外科杂志,2017,23(9):602-606.
[17] Lieber SR,Schiano TD,Rhodes R. Should living donor liver transplantation be an option when deceased donation is not [J]. J Hepatol,2018,68(5):1076-1082.
[18] 王海.临床护理协调员在小儿亲体肝移植中的作用[J].上海护理,2018,18(1):57-58.
[19] 唐绪容,周蓉,屈虹,等.肝移植患儿术中压力性损伤发生特征及影响因素分析[J].中国护理管理,2019,19(8):1153-1158.
[20] 韩永仕,韦中余,张蓉.成人原位肝移植术后早期急性肺损伤危险因素的临床研究[J].中国医药导报,2016, 13(20):124-127.
[21] 孟繁秀,徐钧.肝移植术后早期急性肾功能损伤的研究现状[J].中国现代医生,2018,56(1):159-164.
(收稿日期:2020-01-10)
