MARCH5通过诱导上皮间质转化促进肝癌细胞转移
2020-12-23
(陕西省人民医院 肝胆外科,陕西 西安 710068)
线粒体是细胞内调控代谢、凋亡与氧化还原稳态等多种重要生物学过程的细胞器[1]。线粒体并不是以孤立静止的形式存在于细胞浆中,而是处在动态的分裂与融合平衡中,以此对自身的形态与功能进行调控[2]。目前已在包括肝癌在内的多种恶性肿瘤中证实了线粒体分裂与融合的异常及其在促进肿瘤恶性增殖与转移中的作用[3-4]。
MARCH5[membrane-associated ring finger(C3HC4)5]是线粒体外膜定位的E3泛素连接酶,可通过调控线粒体分裂与融合关键蛋白的泛素化降解而调控线粒体的分裂与融合[5]。但目前MARCH5在肝癌中的表达与生物学作用均尚不清楚。本项目首次用生物信息学方法分析了MARCH5在肝癌中的表达与临床意义,并进一步用体外细胞迁移与侵袭实验分析了MARCH5在肝癌细胞转移中的调控作用。
1 材料和方法
1.1 生物信息分析
利用整合的在线分析网站UALCAN[6]对MARCH5在肝癌中的表达及其与患者预后的相关性进行分析,数据信息来源于TCGA(The Cancer Genome Atlas,癌症基因组图谱)数据库。
1.2 细胞实验分析
1.2.1 人肝癌细胞系:人肝癌细胞HLE购自日本JCRRB(Japanese Cancer Research Resources Bank)细胞库,细胞常规培养于含10%胎牛血清(HyClone公司)的DMEM培养液中,细胞培养箱设定温度为37 ℃,CO2浓度为5%。
1.2.2 转染:siRNA下调或表达载体上调HLE细胞中MARCH5表达:首先,由上海吉玛生物公司合成两条靶向MARCH5的siRNA干扰片段,序列为:siRNA#1:5’-GCACUUGGGAGUAAUUUGA-3’;siRNA#2:5’-GCACACGUGUCCGAUUUAU-3’,随后将siRNA转染HLE细胞,大致流程为:将3×105个HLE细胞接种至6孔板内培养12 h,随后以Lip2000脂质体为介质进行siRNA转染,方法严格按Lip2000说明书,先用无血清培养液分别稀释siRNA干扰片段与脂质体Lip2000。随后将二者混合后加入细胞中,培养箱中培养6 h后更换含10%胎牛血清的新鲜培养液继续培养24 h。MARCH5表达载体由唐都医院普通外科实验室赠送,载体转染同样使用脂质体Lip2000为介质,转染方法与siRNA转染方法相同。
1.2.3 qRT-PCR检测MARCH5 mRNA表达水平:RNA提取采用商品化RNA提取试剂盒(OMEGA公司,货号R6688),操作严格按说明书进行,提取获得总RNA后进一步用反转录试剂盒(TAKARA公司,货号RR037A)反转录合成cDNA,随后进行MARCH5与上皮间质标志分子E-cadherin、ZO-1、N-cadherin与Vimentin的表达检测。上述分子PCR扩增引物序列为:MARCH5(F-5’-GTCCAGTGGTTTACGTCTT GG-3’;R-5’-CCGACCATTATTCCTGCTGC-3’),E-cadherin(F-5’-ATTTTTCCCTCGACACCCGAT-3’;R-5’-TCCCAGGCGTAGACCAAGA-3’),ZO-1(F-5’-CGACCAGATCCTCAGGGTAA-3’;R-5’-TCCATAG GGAGATTCCTTCTCA-3’),N-cadherin(F-5’-AGCT CCATTCCGACTTAGACA-3’;R-5’-CAGCCTGAGC ACGAAGAGTG-3’),Vimentin(F-5’-GACGCCATCA ACACCGAGTT-3’;R-5’-CTTTGTCGTTGGTTAGCT GGT-3’),内参β-actin(F-5’-TCGCCTTTGCCGATCC G-3;R-5’-ATGATCTGGGTCATCTTCTCG-3’)。最终,上述分子在各组细胞中的相对表达量计算采用2-△△Ct法。
1.2.4 Western blotting检测MARCH5蛋白表达水平:对HLE细胞中MARCH5表达进行siRNA干涉或过表达处理后用含蛋白酶抑制剂的裂解液裂解细胞并离心收集蛋白上清,加入SDS上样缓冲液煮沸5 min,然后将各组细胞蛋白加入聚丙烯酰胺凝胶中进行电泳分离,将凝胶中电泳分离的蛋白转至PVDF膜上,5%脱脂牛奶中封闭1 h后加入1:1 000稀释过的MARCH5抗体(Novus公司,货号NBP2-21583)并于室温孵育3 h,PBS洗膜3次后加入二抗继续于室温孵育2 h,PBS洗膜3次后即可在化学发光仪中对最终结果进行观察。
1.2.5 划痕实验检测细胞迁移能力:对HLE细胞中MARCH5表达进行siRNA干涉或过表达处理,之后消化并离心收集细胞,将3×105个细胞接种至6孔板内,培养12 h后沿着直尺用枪头划线,显微镜下对细胞划痕进行拍照,随后将细胞置于培养箱中培养48 h后再次对细胞划痕进行拍照。最后,用Image J图像处理软件对各组细胞的相对迁移距离进行分析。
1.2.6 Transwell侵袭实验检测细胞侵袭能力:同样,首先对HLE细胞中MARCH5表达进行siRNA干涉或过表达处理,之后消化并离心收集细胞,将1×105个细胞接种至含基质胶的Transwell小室内,小室上层培养液不含血清,下层培养液含血清。将小室中细胞置于培养箱中培养48 h,取出后用结晶紫染色5 min并用PBS清洗3次,最后置于显微镜下对各组发生侵袭的细胞进行计数。
1.3 统计学分析
2 结果
2.1 肝癌组织中MARCH5表达显著上调
对TCGA数据库中肝癌与正常肝组织中MARCH5表达进行分析,结果发现:MARCH5在肝癌组织中表达显著高于正常肝组织(P<0.001) (图1A)。此外,MARCH5在发生淋巴转移的肿瘤组织中表达显著高于未发生淋巴转移的肝癌组织(图1B)。
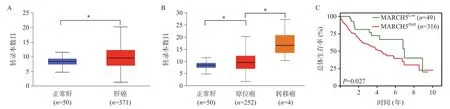
图1 生物信息学分析MARCH5在肝癌中的表达及其与患者预后的相关性分析
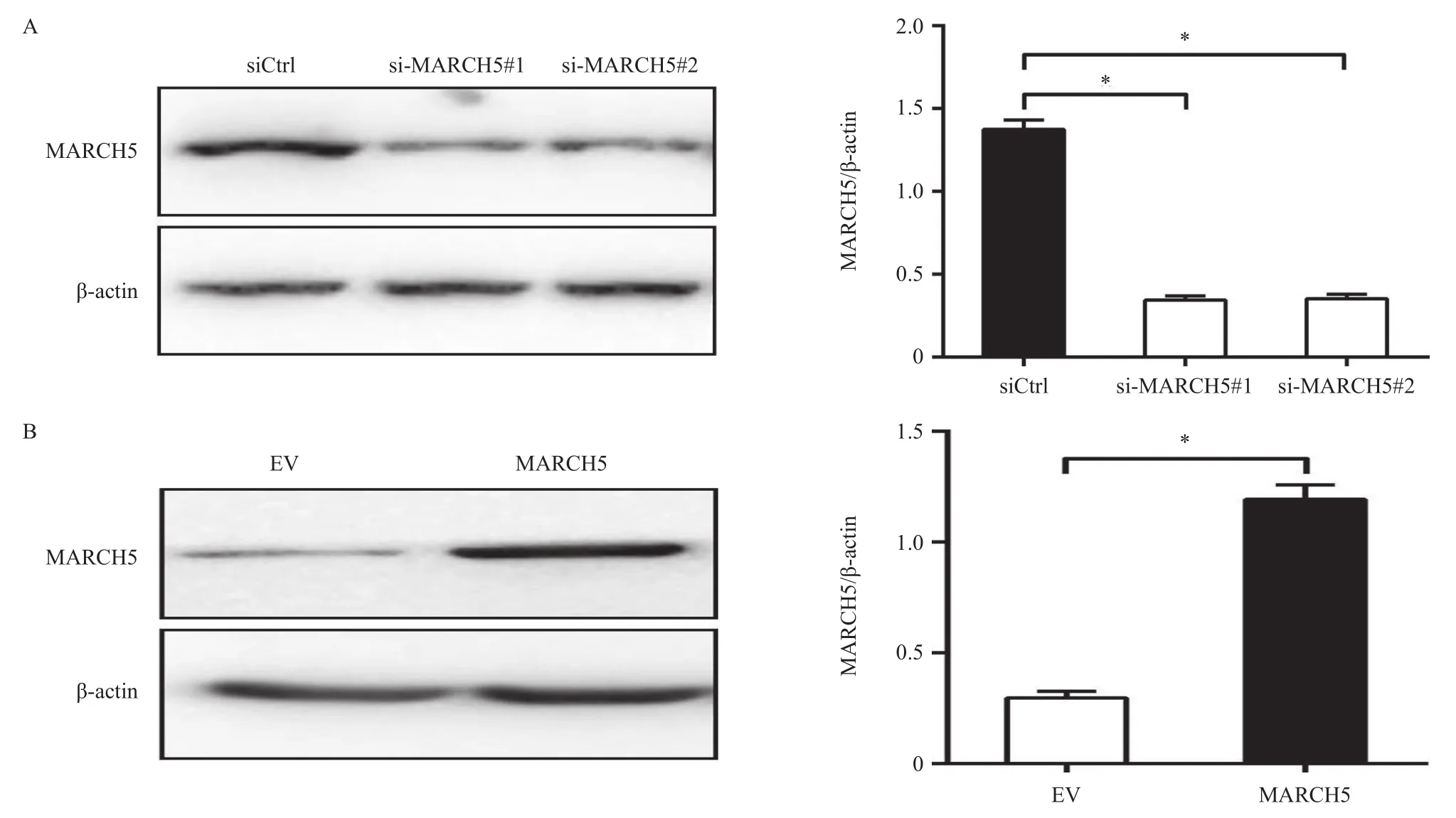
图2 Western blotting检测HLE细胞中MARCH5在蛋白表达水平的干涉(A)与过表达(B)效率
进一步在TCGA数据库中对MARCH5表达与肝癌患者预后相关性进行分析后发现(图1C):MARCH5高表达肝癌患者较MARCH5低表达肝癌患者具有显著更差的预后。
2.2 MARCH5可显著促进肝癌细胞的迁移能力
转染两条siRNA 24 h后,HLE细胞中MARCH5表达均显著下调 [siCtrl vs si-MARCH5#1 vs si-MARCH5#2:(1.37±0.03) vs (0.34±0.02) vs (0.35±0.01),F=698.3,P<0.0001](图2A),而转染MARCH5表达载体后,肝癌HLE细胞中MARCH5表达显著升高[EV vs MARCH5:(0.30±0.02) vs (1.19±0.04),t=21.82,P<0.0001](图2B),表明本试验所采用的干涉与过表达细胞模型可用于后续MARCH5功能的研究。
首先,分别干涉或过表达MARCH5后,利用划痕实验分析对肝癌细胞迁移能力的影响,结果发现:与对照组相比,干涉MARCH5表达后HLE细胞的相对迁移距离显著变短[siCtrl vs si-MARCH5#1 vs si-MARCH5#2:(1.00±0.05) vs (0.41±0.02) vs (0.39±0.03),F=104.2,P<0.0001](图3A),而过表达MARCH5后HLE细胞的迁移距离显著变长[EV vs MARCH5:(1.00±0.03) vs (1.51±0.05),t=8.895,P<0.001](图3B),表明MARCH5促进了肝癌细胞的迁移能力。
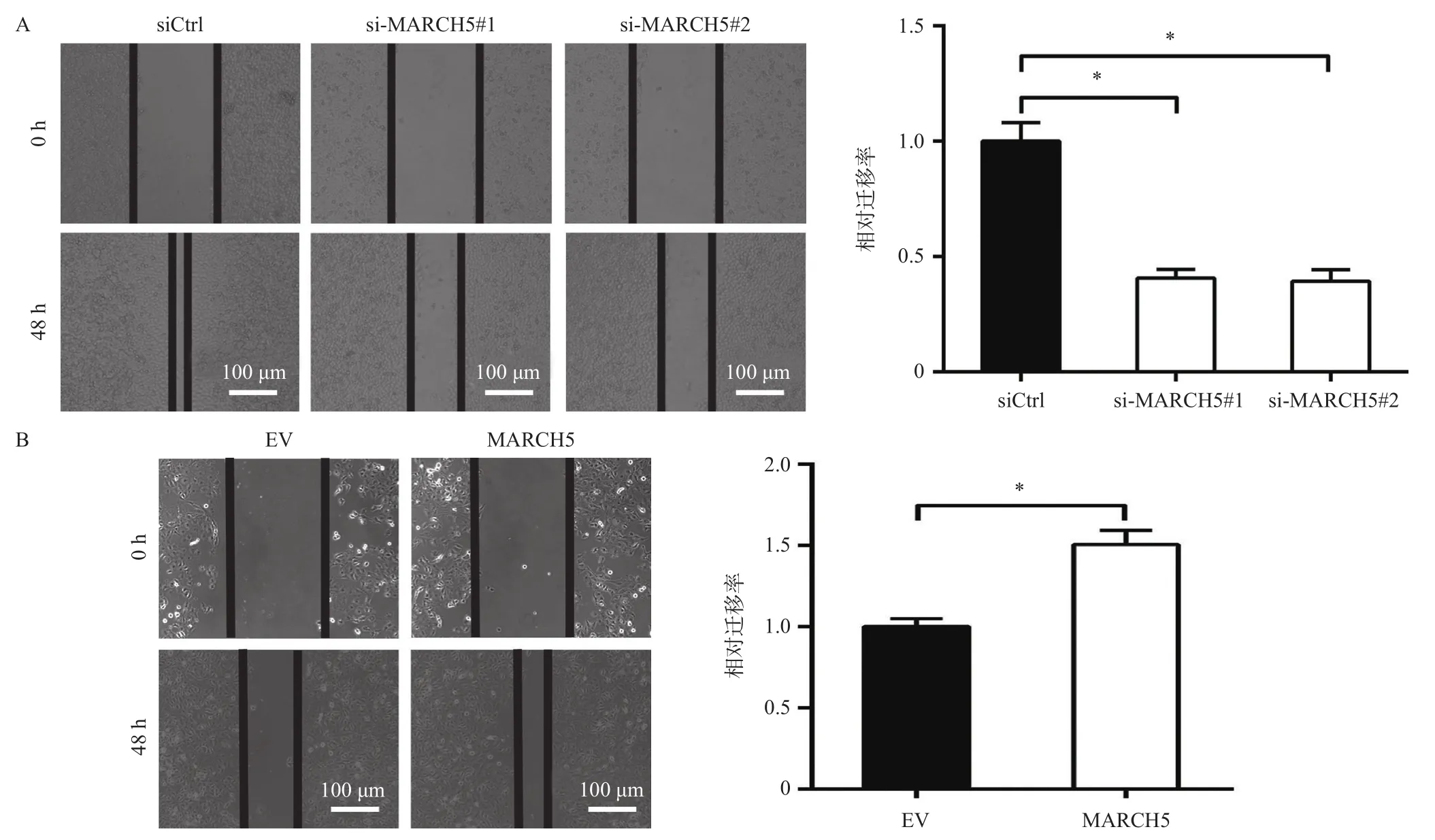
图3 划痕实验分析干涉(A)与过表达(B)MARCH5对HLE细胞迁移能力的影响(×100)
2.3 MARCH5可显著促进肝癌细胞的侵袭能力
进一步,分别干涉或过表达MARCH5后,利用Transwell侵袭实验分析对肝癌细胞侵袭能力的影响,结果发现:干涉MARCH5表达后,侵袭至基质胶底部HLE细胞的数显著减少 [siCtrl vs si-MARCH5#1 vs si-MARCH5#2:(48.67±3.76) vs (15.33±1.45) vs(17.67±1.45),F=56.66,P=0.0001](图4A),而过表达MARCH5后,侵袭至基质胶底部的HLE细胞数显著增多 [EV vs MARCH5:(23.00±1.16) vs (39.67±2.33),t=6.402,P=0.0031](图4B),表明MARCH5促进了肝癌细胞的侵袭能力。
2.4 MARCH5可诱导肝癌细胞发生上皮间质转化
上皮间质转化是肿瘤细胞获得转移潜能的重要因素之一,为初步探讨MARCH5促进肝癌细胞迁移与侵袭的分子机制,我们利用qRT-PCR实验分析了干涉或过表达MARCH5对上皮间质转化标志分子(上皮E-cadherin与ZO-1;间质N-cadherin与Vimentin)表达的影响,结果发现:干涉MARCH5表达后,HLE细胞中上皮细胞标志分子E-cadherin [siCtrl vs si-MARCH5#1 vs si-MARCH5#2:(1.00±0.05) vs(2.02±0.05) vs (2.07±0.07),F=110.3,P<0.0001]与ZO-1 [siCtrl vs si-MARCH5#1 vs si-MARCH5#2:(1.00±0.02) vs (1.64±0.03) vs (1.64±0.05),F=114.3,P<0.0001]表达显著上调,而间质细胞标志分子N-cadherin [siCtrl vs si-MARCH5#1 vs si-MARCH5#2:(1.00±0.04) vs (0.39±0.02) vs (0.40±0.03),F=110.2,P<0.0001]与Vimentin [siCtrl vs si-MARCH5#1 vs si-MARCH5#2:(1.00±0.03) vs (0.56±0.02) vs (0.57±0.04),F=60.65,P<0.0001]表达显著下调(图5A)。相反,过表达MARCH5后HLE细胞中上皮细胞标志分子E-cadherin [EV vs MARCH5:(1.00±0.05) vs(0.38±0.01),t=11.45,P=0.0003]与ZO-1[EV vs MARCH5:(1.00±0.05) vs (0.51±0.04),t=8.091,P=0.0013]表达显著降低,而间质细胞标志分子N-cadherin [EV vs MARCH5:(1.00±0.05) vs (1.49±0.06),t=6.556,P=0.0028]与Vimentin [EV vs MARCH5:(1.00±0.05) vs (1.89±0.05),t=11.70,P=0.0003]表达显著升高,表明MARCH5诱导肝癌细胞发生了上皮间质转化。
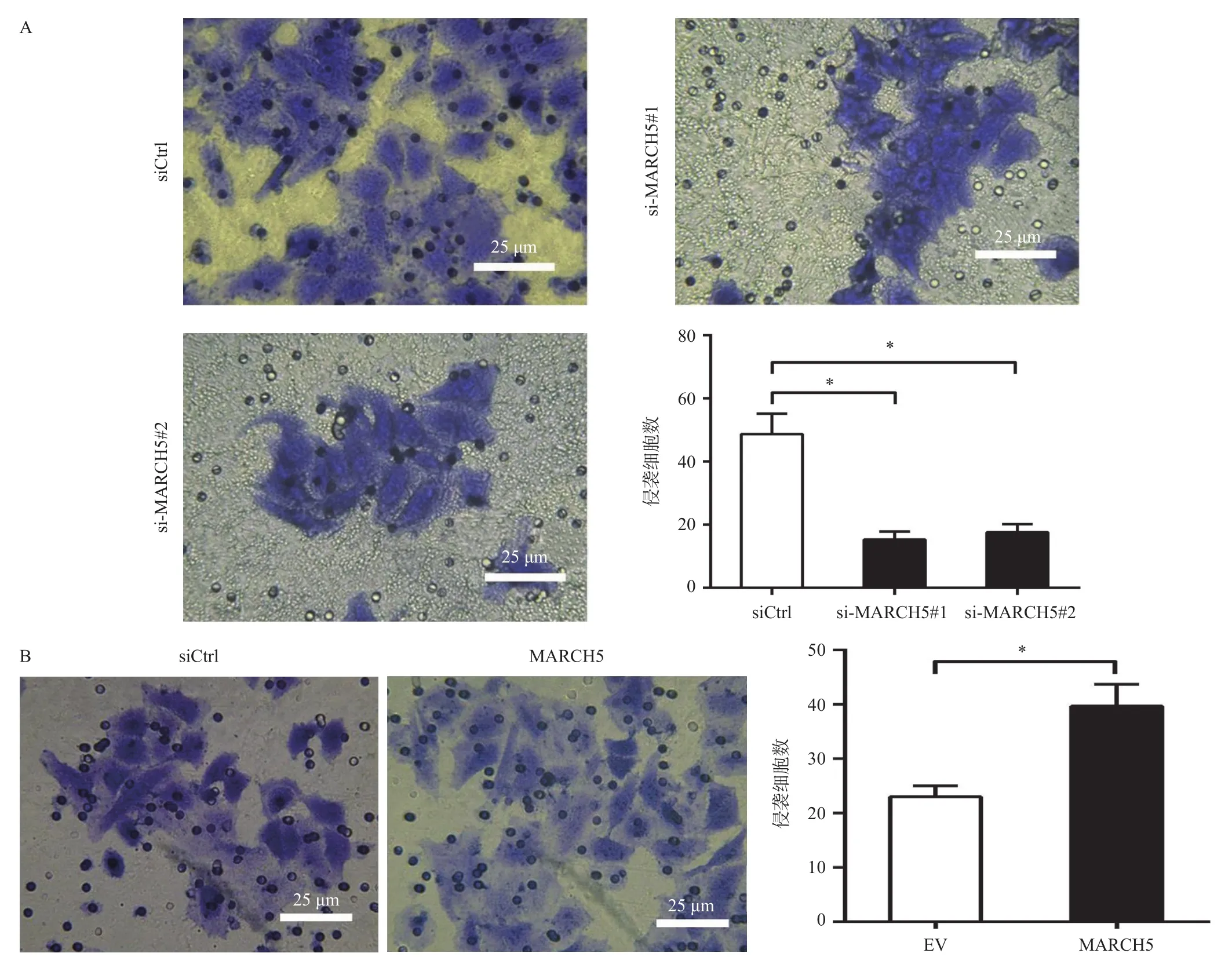
图4 Transwell侵袭实验分析干涉(A)与过表达(B)MARCH5对HLE细胞侵袭能力的影响(×400)
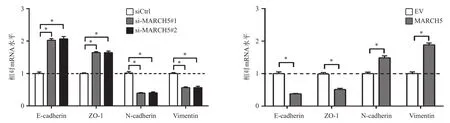
图5 qRT-PCR分析干涉(A)与过表达(B)MARCH5对HLE细胞上皮间质转化标志分子mRNA表达的影响
3 讨论
线粒体是细胞内参与物质与能量代谢、细胞凋亡、钙离子与氧化还原稳态调控的重要细胞器,其主要通过动态的分裂与融合调控自身形态与功能[7]。线粒体动力相关蛋白DRP1与线粒体融合蛋白MFN1是调控线粒体分裂融合的关键蛋白[2],以往已在多种恶性肿瘤中证实了DRP1与MFN1表达的异常[3-4],其中包括肝癌[8]、乳腺癌[9]、大肠癌[10]、肺癌[11]、胰腺癌[12-13]及皮肤鳞癌[14]等,表明线粒体分裂融合关键蛋白及其介导的线粒体分裂融合异常与肿瘤的发生密切相关。
MARCH5是定位于线粒体外膜的E3泛素连接酶,其可通过泛素化调节DRP1与MFN1等线粒体分裂融合蛋白表达而参与细胞的线粒体分裂与融合调控[5,15]。乳腺癌组织中MARCH5表达显著高于癌旁组织,MARCH5表达上调促进了乳腺癌细胞的增殖与转移[16];MARCH5促进了卵巢癌细胞的自噬与转移[17];miR-373表达下调可通过上调MARCH5表达而促进鼻咽癌细胞的侵袭与转移[18];MARCH5具有促进宫颈癌细胞增殖与侵袭迁移的作用[19]。上述研究共同提示,MARCH5在促进肿瘤恶性进展中发挥了重要作用。但目前,MARCH5在肝癌中的表达与生物学作用均尚不十分清楚,有待系统研究。
本研究利用生物信息分析方法,首次在肝癌TCGA数据中分析了MARCH5的表达及其与患者预后的关系,结果发现肝癌中MARCH5表达显著上调并与患者较差预后密切相关,提示MARCH5是肝癌中重要的癌基因并有望成为肝癌潜在的预后分子标志物。此外还发现,MARCH5在发生淋巴转移的肿瘤组织中表达显著高于未发生淋巴转移的肿瘤组织,表明MARCH5可能促进了肝癌的转移,与推测结果一致。随后的细胞实验发现,下调MARCH5表达可显著抑制肝癌细胞的迁移与侵袭能力,而过表达MARCH5则可显著促进肝癌细胞的迁移与侵袭能力,进一步证实了MARCH5在促进肝癌转移中的作用。对MARCH5促进肝癌细胞迁移与侵袭分子机制的初步研究发现,下调MARCH5表达后肝癌细胞的上皮细胞标志分子E-cadherin与ZO-1表达显著上调,而间质细胞标志分子N-cadherin与Vimentin表达显著下调。相反,过表达MARCH5后HLE细胞中上皮细胞标志分子E-cadherin与ZO-1表达显著降低,而间质细胞标志分子N-cadherin与Vimentin表达显著升高,提示MARCH5可能通过诱导上皮间质转化而促进肝癌细胞的迁移与侵袭。以往在乳腺癌中研究也证实MARCH5通过诱导EMT促进肿瘤的转移[16],表明上皮间质转化是MARCH5促进肿瘤转移的重要机制。与MARCH5功能类似,MARCH8也被证实具有促进宫颈癌细胞迁移、侵袭与增殖的作用[20]。卵巢癌中的研究发现,MARCH8在卵巢癌中表达明显上调,下调MARCH8后卵巢癌细胞的增殖能力均被显著抑制[21]。以上研究表明E3泛素连接酶MARCH家族成员表达异常在肿瘤发生发展中发挥了重要的促进作用。
本研究存在三个尚未回答的科学问题:(1)是什么因素导致了肝癌组织中MARCH5的表达上调;(2)MARCH5是通过何种机制促进了肝癌细胞的上皮间质转化;(3)MARCH5是否是通过调控DRP1泛素化及线粒体分裂而参与对肝癌细胞侵袭迁移的调控。以上三个科学问题均有待未来研究中进一步阐明。