结直肠癌肝转移同期腹腔镜与开腹手术的疗效比较:倾向性评分匹配分析
2020-12-23叶星照毛瑞波陈熙益蒋飞照李绍堂
叶星照,毛瑞波,陈熙益,蒋飞照,李绍堂
(1.温州医科大学附属第一医院 结直肠肛门外科,2.温州医科大学附属第二医院 胸外科,浙江 温州325000)
结直肠癌(colorectal cancer,CRC)是常见的恶性肿瘤之一,其发病率和病死率在全球所有癌症中分别排第三(10.2%)和第二(9.2%)[1]。肝脏是结直肠癌最常见的转移器官,约40%的结直肠癌患者最终会出现肝转移,其中约15%~20%的患者在初诊时即合并同步肝转移[2]。完整手术切除为结直肠癌肝转移(colorectal cancer liver metastases,CRLM)患者提供了长期生存和治愈的机会。虽然手术切除的重要性已得到共识,但其策略及手术时机仍存在争议[3]。传统的分期切除为先切除肠道原发肿瘤,再行肝转移灶切除术。近年来,为了整体治疗的合理安排,“肝脏优先模式”的分期切除也已开展应用[4]。有研究显示,结直肠癌和肝转移灶的开腹一期联合切除是安全可行的[5-6]。
腹腔镜在结直肠和肝脏手术中得到广泛应用[7-8]。同期行腹腔镜切除结直肠癌和肝转移灶也已逐步开展[9-10],然而数据仍有限。本研究采用倾向性评分匹配方法对CRLM患者进行组间1:1匹配,比较在温州医科大学附属第一医院接受同期腹腔镜切除术和开腹手术CRLM患者的临床资料,探讨同期腹腔镜切除术的安全性和近期疗效,现报道如下。
1 资料和方法
1.1 一般资料
收集我院临床数据库中2011年1月至2020年8月接受一期联合手术的CRLM患者资料。纳入标准:(1)原发灶和肝转移灶均进行根治性切除;(2)经术后病理证实为CRLM;ASA分级≤3级。剔除标准:(1)合并严重的重要脏器功能障碍;(2)原发灶采取Miles手术的患者。共纳入79例,其中接受开腹手术的31例,接受腹腔镜手术的48例(双腔镜方式19例,腔镜与开腹混合方式29例)。
1.2 倾向性评分匹配
为了减少回顾性研究所带来的选择偏倚,我们采用了SPSS软件的倾向性评分匹配(propensity scores matching,PSM)功能,将相关的协变量包括性别、年龄、ASA分级、BMI、术前白蛋白、T分期和N分期纳入Logistic回归模型,计算得到相应的倾向性评分,然后采取最邻近匹配法对两组患者进行1:1匹配,最终各纳入24例。
1.3 手术方法
纳入的48例患者中29例由同时具备结直肠和肝脏手术经验的外科医师进行,另外的19例一期联合手术由经验丰富的结直肠外科医师、肝胆外科医师合作进行。患者在全身麻醉后采用分腿位或低截石位。
开腹组原发灶位于右半或横结肠时可与肝脏手术共用右侧肋缘下切口,位于其他部位时多采用正中切口,通过延长切口进行肝脏手术。
腔镜组原发灶腔镜手术一般采用经典的五孔法,肝脏腔镜手术可以与前者共用部分穿刺孔,并根据肝转移灶的位置再增加1~3个穿刺孔。
对于肝脏手术,术中采用超声探头对肝转移灶进行探查和准确的定位,用电凝钩在距肿块边缘1 cm的肝实质表面做预切除线,减少切缘阳性的风险(图1A)。此外,术中B超还能用于判断肿瘤与周围血管的关系,保留必要的血管。对于肿块较大,预估术中出血较多的患者,可预留阻断带,通过肝门血流阻断法(Pringle法)减少出血(图1B)。直径较小的肝转移灶多采用非解剖性切除,如肝脏局部剜除和楔形切除(图1C),直径较大的可行解剖性切除。肝脏实质的离断一般采用超声刀,遇到肝血管和胆管时用Hem-o-lok夹闭再离断(图1D)。创面予双极电凝止血,较大的可缝合止血。
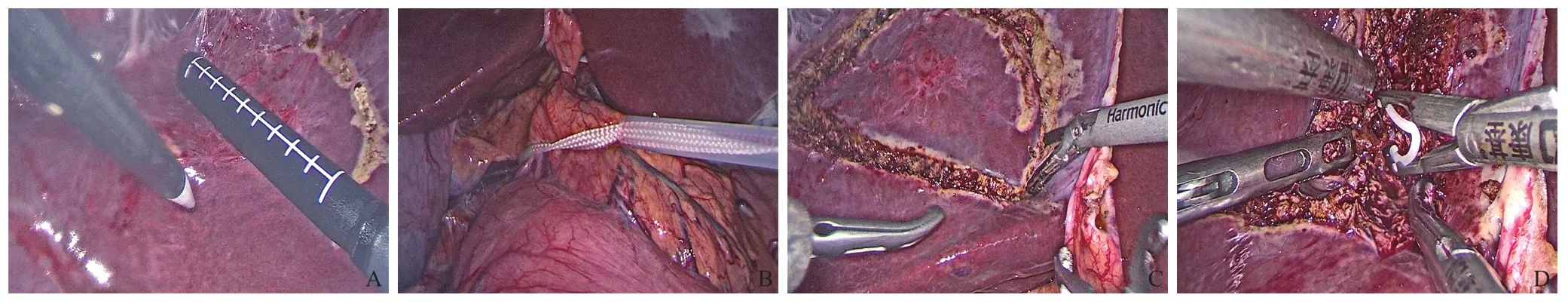
图1 腹腔镜下肝转移灶切除术中操作
1.4 观察指标
观察指标包括术中指标(手术时间、术中输血),术后一般指标(并发症发生率、围术期病死率、二次手术率、肛门排气时间、开始流质饮食时间、腹腔引流管留置时间、住院费用、术后住院时间)和术后实验室指标(术后第1天总胆红素、直接胆红素、谷丙转氨酶、红细胞和白细胞计数)。
1.5 统计学分析
利用SPSS 25.0软件对临床数据进行统计分析,对于连续变量,符合正态分布用(±s)表示,组间比较采用Student’s t检验;不符合正态分布用中位数(范围)表示,组间比较采用Mann-Whitney U检验。分类变量结果表示为[例(%)],采用χ2检验或Fisher确切概率法。P<0.05认为差异有统计学意义。
2 结果
2.1 两组倾向性匹配情况
经倾向性评分1:1匹配后,开腹组(开腹一期联合切除)与腔镜组(腹腔镜一期联合切除)各纳入24例,两者患者临床病理特征均无统计学差异,具有可比性(见表1)。其中腔镜组9例原发灶和转移灶均采用腹腔镜手术,15例采用腹腔镜联合开腹手术。

表1 倾向性匹配后两组临床病理特征比较
2.2 围术期指标比较
两组均无围手术期死亡,二次手术率和术中输血率差异无统计学意义。开腹组和腔镜组的并发症发生率分别为41.7%和54.2%(P=0.386),具体并发症发生率如表2所示,差异无统计学意义(P>0.05)。相比开腹组,腔镜组手术时间明显延长[(274±57)min vs (190±53)min,P<0.001],肛门排气时间缩短[4(2~11)d vs 5(3~15)d,P=0.005),而开始流质饮食时间、腹腔引流管留置时间、术后住院时间和住院费用差异无统计学意义。
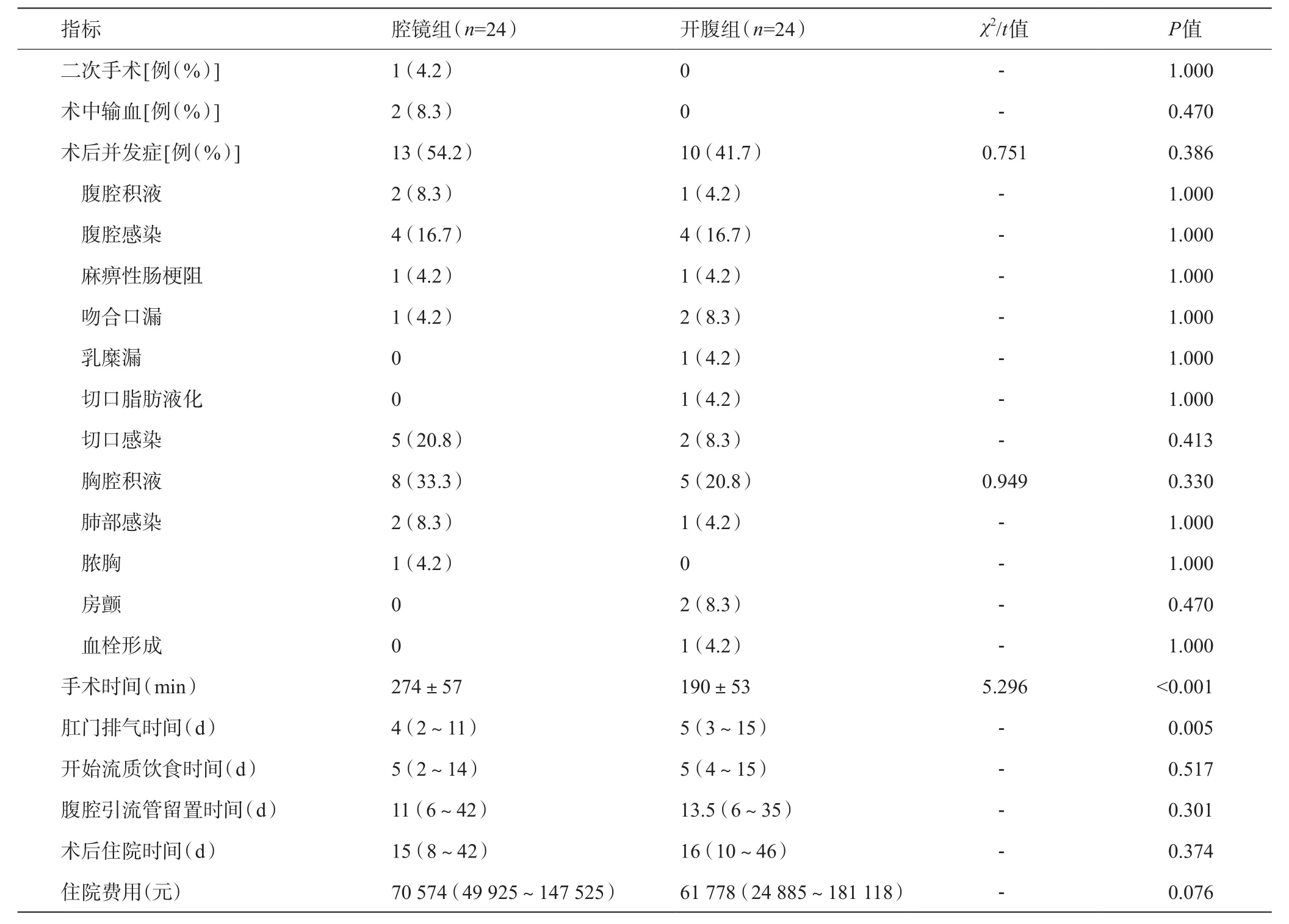
表2 两组围术期指标比较

表3 两组术后第1天实验室指标比较
实验室指标方面,两者术后第1天总胆红素、直接胆红素、谷丙转氨酶、红细胞计数无统计学差异。腔镜组术后第1天白细胞计数比开腹组低[(10.3±3.7)×109/L vs (12.4±3.5)×109/L,P=0.047],具体见表3。
3 讨论
肝脏是结直肠癌血行转移最主要的靶器官,手术完全切除结直肠癌及肝转移灶是目前治疗CRLM的最佳方法。肝转移灶完全切除或达到“无疾病证据”状态的患者的5年生存率可达30%~50%[11-12],10年生存率为24%[13],而无法切除者5年生存率低于5%[14]。目前,CRLM的最佳手术策略尚未确定,其方式大致可分为两类,即同期切除和分期切除。和传统的分期切除比,同期切除有避免二次手术、降低肿瘤进展几率、减少患者手术风险、节省经济开支等优势,近年来也得到关注和开展[15-16]。也有研究显示,实施同期切除术的术后病死率、严重并发症发生率、5年生存率与分期手术大致相当[17]。但开腹同期手术通常需要大切口,尤其当原发病灶不在右半结肠时。腹腔镜手术避免了腹部大切口,同时有局部解剖视野放大的优势,目前腹腔镜结直肠癌手术已在临床广泛应用。但腹腔镜下同期切除术的安全性和有效性有待于进一步研究和探索。
和开腹手术相比,腹腔镜同期切除需要同时有丰富的腹腔镜肠切除和肝切除经验的医师共同合作实施,故前期临床开展相对受限。前瞻性随机对照研究也较难实施,故回顾性分析和良好的匹配以减少偏倚是合适的研究选择。在前期将两者回顾性分析[18]对比的基础上,本研究进一步采用倾向性评分匹配法进行研究,结果显示:两组并发症发生率、围术期病死率、二次手术率、术中输血率、开始流质饮食时间、术后住院时间和住院费用差异均无统计学意义。相比开腹组,腔镜组术后肠道功能恢复时间缩短,考虑与腹腔镜术中肠管暴露时间短,手术切口小,术后疼痛轻,下床活动时间提早有关。腔镜组手术时间更长,前期研究[18]报道不同,考虑与手术团队腹腔镜操作熟练度及病例选择存在偏倚有关。腹腔镜组术后第1天白细胞计数更低,其原因可能与开放手术可诱导高水平的促炎因子有关[19]。
在开展腹腔镜肠肝同期切除过程中,肠、肝的切除顺序是个值得讨论的话题。有学者考虑到腹腔镜肝切除手术有一定中转开腹率,为了避免开腹后二次建立气腹使肠原发肿瘤切除及肠吻合困难;或者在肠道肿瘤有症状如梗阻等情况时,建议先行处理原发肿瘤。支持“肝脏优先”者则认为肝切除术中长时间门静脉阻断会导致肠黏膜淤血水肿,不利于肠吻合口的愈合。笔者发现个别先行肠道切除的患者中,术后肝创面感染的几率有所增加,考虑与术中肠腔开放,共用器械等因素有关。故笔者认为切除顺序应视具体情况而定,若原发灶无症状,肝病灶切除难度可控,肝脏优先是一个合适的选择。综上所述,CRLM腹腔镜同期联合切除安全可行,与开腹手术相比,具有一定的临床优势。
本研究仍存在一定的局限性。(1)数据来自单一中心,病例时间跨度较长。后期若有多中心、大样本量的试验将为二者对比提供更充分数据。(2)尽管本研究采用倾向性评分匹配法减少了选择偏倚,但仍不如前瞻性随机对照试验,后续若能开展相应的随机对照研究将值得期待。