长余辉纳米诊疗剂的设计策略与应用研究进展
2020-12-23张绍安练惠旺陈星中
康 茹, 张绍安, 练惠旺, 陈星中, 李 杨*
(1. 广东工业大学 物理与光电工程学院, 广东 广州 510006;2. 广州医科大学 生物医学工程系, 广东 广州 511436; 3. 广东技术师范大学 光电工程学院, 广东 广州 510665)
1 引 言
长余辉发光是一种独特的光学现象,不同于短寿命的光致发光,长余辉发光能够在停止激发后仍然维持长达数秒、数小时甚至数天的持久发光[1-4]。长余辉发光的独特性质主要取决于发光离子和有效陷阱[5-7]。其过程是发光中心在高能光激发下,电子从基态跃迁到激发态,而激发态部分电子跃迁到基质导带成为自由电子时,部分电子被陷阱所捕获;被捕获的电子在热激活或者其他物理作用下逃离陷阱,当其重新跃迁回发光中心基态时,形成了长余辉发光。这种特殊的激发/发射分离现象,避免了光学成像中自体荧光和激发光在生物组织体内光散射的干扰。因此,长余辉纳米材料具备其他荧光标记物所不具有的高分辨率、大成像面积和更便捷的操作模式等优势[8-14]。近几年,长余辉纳米材料在生物活体成像应用领域逐渐成为了研究热点。
目前,生物医学诊疗一体化需求激增,长余辉纳米诊疗剂具有高分辨的成像诊断、良好的生物相容性与可控的药物负载释放治疗等优势,在临床应用上日益突显出良好的应用前景。然而,现有无机长余辉材料的单一功能限制了其在生物医学诊疗方面的应用前景,同时由于其无机属性使得钝化表面难以改性或负载药物[15-21]。
近年来,针对生物医学诊疗集成一体化需求,科研工作者提出了多种长余辉纳米材料的设计策略,为发展集成化长余辉纳米诊疗剂开辟了新道路与方向[22-23]。为解决上述问题,长余辉纳米材料的开发应遵循以下策略:(1)具有稳定的余辉性能(初始余辉强度较强且余辉持续时间长);(2)颗粒尺寸大小应适用于生物体内(<200 nm);(3)具备示踪、载药-释放等功能。因此,如何设计长余辉纳米诊疗剂是一项具有挑战性的研究课题。
目前,已发表的长余辉纳米材料综述文章都聚焦于长余辉纳米材料的合成方法和生物应用方面。例如,Wang等总结了长余辉纳米材料在生物传感、生物成像和癌症治疗方面的最新成果[3]。Sun等论述了长余辉纳米材料在生物成像-诊断应用领域的研究成果[10]。Liang等总结了近红外长余辉纳米材料的合成和应用,讨论了近红外长余辉材料的发光机理[24]。然而,缺乏对长余辉纳米诊疗剂设计策略的综述。
本综述论述了多种长余辉纳米诊疗剂的设计策略,对如何解决关键问题进行分析与讨论,归纳了长余辉纳米诊疗剂在生物成像和医学诊疗方面的进展,总结了长余辉纳米诊疗剂的优越性、在未来面临的挑战和应用前景。
2 长余辉纳米诊疗剂的设计策略
根据长余辉纳米诊疗剂的强余辉、小尺寸、多功能的设计标准,综合近几年来不同的设计策略,我们归纳了以下几种结构的长余辉纳米诊疗剂。表1给出了不同设计策略对长余辉纳米诊疗剂余辉特性和形态影响的比较。
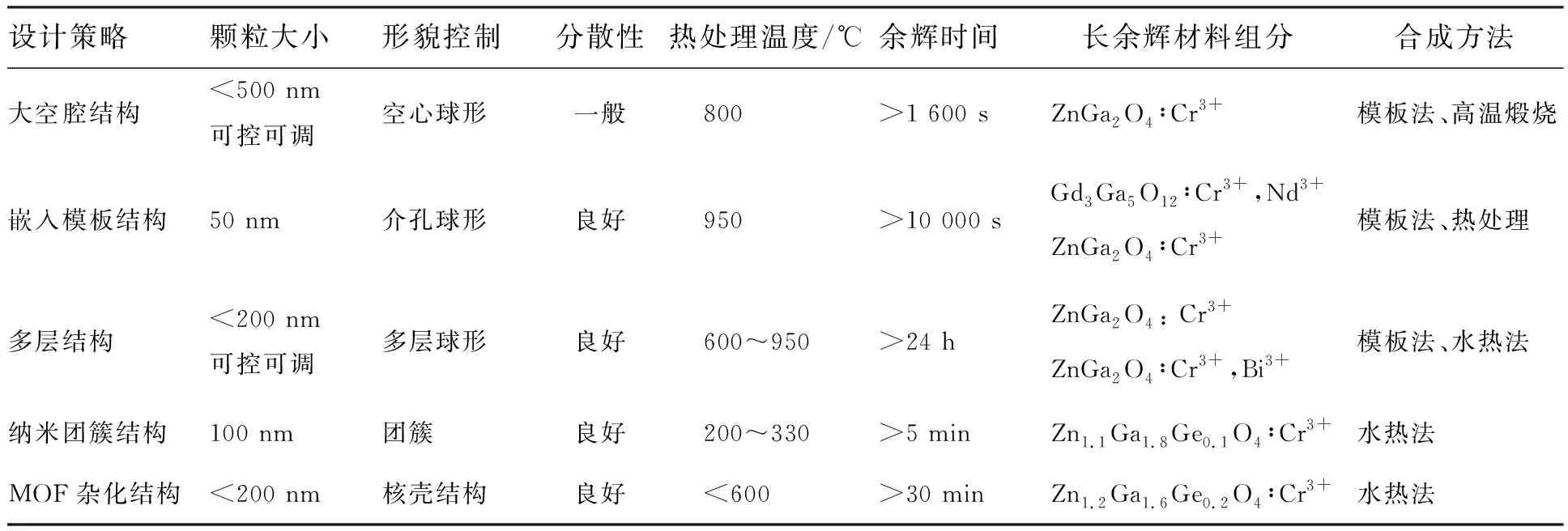
表1 在颗粒大小、形貌控制、分散性、热处理温度和余辉时间方面,长余辉纳米诊疗剂的设计策略比较Tab.1 Comparison of design strategies of persistent luminescence nanotheranostics in terms of particle size, morphology control, dispersion, heat treatment temperature and afterglow time
2.1 大空腔结构设计
负载药物的纳米载体要求具备较大的表面积与体积比,而长余辉纳米材料在传统的设计策略下不易达到该条件,且本身无机表面的钝化作用进一步加大了负载药物的难度。下面介绍的长余辉纳米诊疗剂的设计策略利用了长余辉材料构建异型结构从而增大其表面积(图1)[25],与普通的规则球体纳米材料相比,该结构具有大空腔和介孔结构,可实现化学药物或光敏剂高效率的负载[25-27]。
这种设计策略用碳球作为模板,通过水热法将长余辉材料覆盖在碳球的表面形成壳层,在高温下煅烧,碳球受热变成二氧化碳排出,留下了长余辉材料壳层,形成一个表面带有气孔的空腔(图1(a))。这种设计策略的巧妙之处在于:(1)在碳球受热排出过程中可以形成空腔和气孔,增加了长余辉纳米材料的表面积,从而有利于有机物的吸附或嫁接;(2)由于温度升高,碳球气化排出,壳层产生了一定程度收缩,使得该方法不仅有利于形成有效陷阱,而且避免了纳米晶体团聚现象[28];(3)通过调整碳球模板的尺寸大小实现长余辉纳米材料的尺寸可控可调(图1(b)~(d))。与调整升温速度、煅烧温度、反应时间等传统方法相比,该策略突破了传统方法的束缚,过程简便,易于合成尺寸可控、大比表面积、高性能的长余辉纳米材料,为实现多功能纳米诊疗剂提供了可能。
除此之外,为实现长余辉纳米材料载药-释放功能,需要对空腔长余辉纳米材料进行水分散性和生物相容性的性能改善,以进一步完善长余辉纳米诊疗剂的构建。BSA(牛血清白蛋白)可以有效地将疏水性的长余辉纳米材料转变为亲水性,从而改善其水相稳定性。 Wang等使用BSA对空腔结构的长余辉纳米颗粒进行表面修饰[25],然后利用DOX(阿霉素)作为模型药物,研究了BSA表面修饰的、空腔结构的长余辉纳米颗粒载药和释放功能。结果表明,无论是体外细胞实验还是活体实验均展示了这种长余辉纳米诊疗剂的药物负载-释放能力以及对癌细胞或肿瘤的治疗效果。
在已报道的纳米诊疗剂研究中,也有类似的设计策略(图1(e))。Zhang等设计了具有空腔的Si/C纳米球作为DOX的载体[26]。而用同样具备大空腔的长余辉纳米诊疗剂作为药物载体,可以更好地发挥激发-发射分离的独特光学现象的优势,避免了成像中自体荧光和激发光在生物组织体内光散射的干扰。

图1 (a)大空腔结构设计示意图;(b)~(d)碳球的尺寸分别为150,300,500 nm情况下合成的大空腔结构的长余辉纳米诊疗剂的TEM(透射电子显微镜)图[25];(e)制备空腔PEG-Si/C-DOX NP的示意图[26]。Fig.1 (a)Synthesis and functionalization of the hollow near-infrared(NIR) PLNPs. (b)-(d)TEM images of the synthesizing hollow PLNPs on 150, 300, 500 nm-sized carbon spheres, respectively[25]. (e)Schematic illustration of fabrication of hollow mesoporous PEG-Si/C-DOX NP[26].
2.2 嵌入模板设计
具有大表面积和孔体积的介孔二氧化硅纳米颗粒(mSiO2)可以作为各种治疗剂的有效载体[29-30],而且mSiO2经过官能团、超分子或聚合物修饰后,可实现药物载药与释放功能以及药物输送过程的高度可控性[31-33]。借鉴于这种效果,若是可以通过某种设计策略把长余辉纳米材料嵌入到以mSiO2为模板的介孔中,则可以构建一体化的长余辉纳米诊疗剂。与上述构建自身异型的大空腔结构的长余辉纳米诊疗剂不同的是,嵌入模板结构的长余辉纳米诊疗剂是通过mSiO2模板的多介孔结构以增大表面积,并且介孔可以作为控制长余辉纳米材料尺寸的框架。
这种嵌入模板结构设计策略大致分为两步,第一步是合成mSiO2模板,对于合成mSiO2的技术已经比较成熟,许多研究已证明通过简单的化学方法就能合成mSiO2,如Qian等在2009年通过水解和缩合方法合成了形貌尺寸均匀的mSiO2[34]。第二步是将原材料相应的硝酸化合物溶液按比例混合,再加入mSiO2模板搅拌均匀,将混合物烘干后经高温热处理得到嵌入模板结构的长余辉纳米诊疗剂[35-36]。这样合成的长余辉纳米颗粒嵌在mSiO2模板的介孔中,不会因高温而造成颗粒的团聚和过量生长(图2(a))。这种嵌入模板结构与大空腔结构有异曲同工之处,既能解决高温下尺寸增大而低温下余辉强度低的问题,又能增大表面积,为后续的表面修饰和药物负载提供了良好的表面特性。在Shi等的研究中,对于构建嵌入模板结构的长余辉纳米诊疗剂,他们采用简单直接的溶液搅拌混合的方法在mSiO2表面负载DOX[35]。图2(b)~(d)显示了这种结构的载药和释放能力,在紫外线吸收光谱中可观察到该长余辉纳米诊疗剂和DOX在490 nm有同样的吸收峰,然后在37 ℃的PBS(磷酸缓冲盐溶液)中,60 h后有接近94%的DOX得到释放。根据人类结肠癌细胞HT29活性实验显示,负载了DOX的长余辉纳米诊疗剂有着更好的抑制癌细胞活性的效果(图2(d))。Li等用同样的设计策略构建了长余辉纳米诊疗剂(图2(e)~(f))[36]。在TEM和高分辨率TEM(HRTEM)图像(图2(g)~(h))中,可以观察到微小的黑点(ZnGa2O4长余辉纳米颗粒)均匀地出现在纳米管的纳米通道中,且长余辉纳米颗粒约为2.6 nm。证明了这种设计策略有效地限制了长余辉纳米颗粒的尺寸大小,并且可以实现颗粒形貌的均一性。
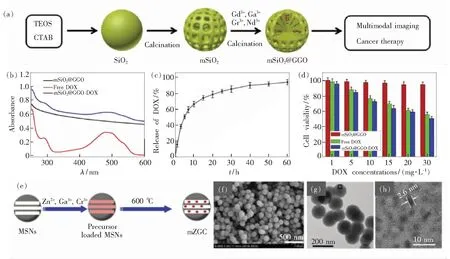
图2 (a)嵌入模板结构设计示意图;(b)mSiO2@GGO纳米材料、游离DOX和mSiO2@GGO-DOX的紫外-可见吸收光谱;(c)在37 ℃的PBS中,载有DOX的mSiO2@GGO纳米材料中DOX的释放曲线;(d)mSiO2@GGO纳米材料、培养24 h 后游离DOX和mSiO2@GGO-DOX在不同浓度下对HT29细胞的细胞活性检测[35];(e)嵌入模板结构设计示意图(MSNs为介孔二氧化硅纳米颗粒);(f)mZGC的场发射扫描电子显微镜(FESEM)图像;(g)mZGC的TEM图像;(h)mZGC的HRTEM图像[36]。Fig.2 (a)Schematic illustration of the preparation of the mSiO2@GGO for multimodal imaging and cancer therapy. (b)UV-Vis absorbance spectra of mSiO2@GGO nanoparticles, free DOX and mSiO2@GGO. (c)Release profile of DOX from DOX-loaded mSiO2@GGO nanoparticles in PBS at 37 ℃. (d)Cell viabilities of the mSiO2@GGO nanoparticles, free DOX and mSiO2@GGO-DOX against HT29 cells at different concentrations for 24 h[35]. (e)Illustration of the synthesis of PL-functionalized MSNs. (f)FESEM images of mZGC. (g)TEM images of mZGC. (h)HRTEM images of mZGC[36].
2.3 多层结构设计
双层结构的长余辉材料,例如在表面涂覆硅的长余辉纳米材料已被多次报道,并且在材料表面涂覆硅也已成为表面修饰的常规手段(图3(a))[37-39]。进一步研究和开发这种具有良好生物相容性的二氧化硅涂层体系的长余辉纳米材料,对生物成像和药物治疗等应用都具有益处。近年来出现的多层结构长余辉纳米诊疗剂,不仅表现出高强度的余辉和较长的余辉时间,还能够抵御高温影响,在形貌和尺寸方面保持规则和均匀,并且由于二氧化硅涂层的修饰作用,提高了水环境分散性。Dai等通过使用二氧化硅涂层制备形态可控的模板,设计合成了余辉性能增强的Gd2O3@mSiO2/ZGOCB(Zn0.97Ga2O3.97∶0.01Cr3+,0.02Bi3+)多层壳/核结构(图3(b))[40]。Lin等通过多层结构的设计策略,搭建了单分散均匀形态以及具有良好生物相容性的长余辉纳米诊疗剂[41]。
与大空腔结构和嵌入模板结构的高载药性相比,在保证高强度余辉前提下,长余辉纳米颗粒的单分散性是这种多层结构设计策略的一大亮点,这对深层组织和体内长时间的生物成像提供了巨大帮助。这种设计策略是通过水热法使长余辉纳米材料附着在纳米球模板表面,最后在长余辉纳米材料的外层再涂覆一层二氧化硅涂层(图3(c))。由于硅球易于合成且形貌尺寸易于调控,用硅球作为模板可以方便地对长余辉纳米材料的尺寸大小进行调控。此外,最外层的二氧化硅涂层可以很好地把每个长余辉纳米材料分隔开,在高温处理下有效地防止颗粒团聚,有利于设计单分散的纳米材料。传统水热法合成的长余辉纳米材料ZnGa2O4∶Cr3+分别经过600,800,950 ℃的温度处理后,导致了不同程度的团聚现象,并且随热处理温度越升高,团聚现象越严重(图3(d)~(g))。而经过多层结构设计的ZnGa2O4∶Cr3+,同样在600,800,950 ℃的温度处理后,可以明显观察到纳米材料依旧保持良好的分散性(图3(h)~(k))。
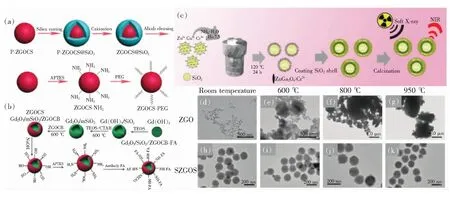
图3 (a)ZGOCS(ZnGa1.997O4∶Cr0.001Sn0.002)的制备和表面功能化示意图[38];(b)多层核/壳结构纳米探针Gd2O3@mSiO2/ZGOCB的合成示意图[40];(c)多层结构设计示意图;(d)~(g)未煅烧的ZnGa2O4∶Cr3+纳米材料和分别在600,800,950 ℃的空气中煅烧4 h后的ZnGa2O4∶Cr3+纳米材料的TEM图像;(h)~(k)未煅烧的SZGOS纳米材料和在空气中分别在600,800,950 ℃下煅烧4 h后的SZGOS纳米材料[41]。Fig.3 (a)Schematic of the preparation and surface functionalization of ZGOCS[38]. (b)Schematic illustration of the synthesis of the core/shell structure nanoprobe Gd2O3@mSiO2/ZGOCB[40]. (c)Schematic illustration of the synthesis of SiO2@ZnGa2O4∶Cr3+@SiO2. TEM images of ZnGa2O4∶Cr3+ nanoparticles without calcination(d) and ZnGa2O4∶Cr3+ nanoparticles after calcination for 4 h in air at 600, 800, 950 ℃((e)-(g)), respectively. (h)SZGOS nanoparticles without calcination. (i)-(k)ZGOS nanoparticles after calcination for 4 h in air at 600, 800, 950 ℃, respectively[41]
2.4 纳米团簇设计
纳米团簇结构指的是一种或两种以上的纳米材料以确定的几何排列通过自组装的方式团聚成纳米尺寸大小的团簇,通过不同的纳米材料杂化从而结合不同纳米材料的特性,如光学特性、电化学特性、表面特性等[42-43]。通常,设计杂化纳米簇结构的过程是用疏水基团修饰长余辉纳米材料的表面,然后经修饰的纳米材料在两亲性溶剂中进行多组分自组装。多组分自组装是一种利用相邻纳米材料相互作用而组装的并具有把各种先进材料的新功能和新性能进行集成的新颖且有效的方法[44-45]。如2014年Chen等报告了一种将磁性纳米粒子与荧光量子点共同组装而形成的磁性荧光超纳米粒子,可用作体内多光子和磁共振双峰成像探头(图4(a))[44]。2008年,Kim等搭建了多功能聚合物纳米团簇医学平台,负载在聚合物纳米颗粒中的Fe3O4纳米团簇赋予了聚合物颗粒的磁性引导,提高了靶向效率(图4(b))[45]。
2017年, Qiu等报道了一种由上转换纳米材料和长余辉纳米材料组成的杂化纳米团簇,通过结合二者的光学特性,用980 nm激光进行激发,并在700 nm处显示余辉,以实现生物窗口的近红外波段激发-发射,提供了一种极佳的消除自发荧光的方法[42]。他们选用了油酸作为修饰长余辉纳米材料和上转换纳米材料的疏水溶剂,并置于DTAB(十二烷基三甲基溴化铵)中采用蒸发诱导方法进行自组装,随后长余辉纳米材料和上转换纳米材料同时被包裹在DTAB胶束内。最后对该纳米团簇结构用PEG(聚乙二醇)对纳米团簇进行表面修饰(图4(c)~(d))。PEG具有良好的水溶性、分散性,并与许多有机物组分有良好的相溶性[46-47],已成为近年来常用作修饰长余辉纳米材料或其他纳米材料的表面修饰剂[16,48]。这种具有纳米团簇结构的长余辉纳米诊疗剂可以达到在生物体内被近红外光反复激发的目的,极大地提高了生物成像的信噪比,并显示了其作为更有效的癌症早期诊断工具的潜力。
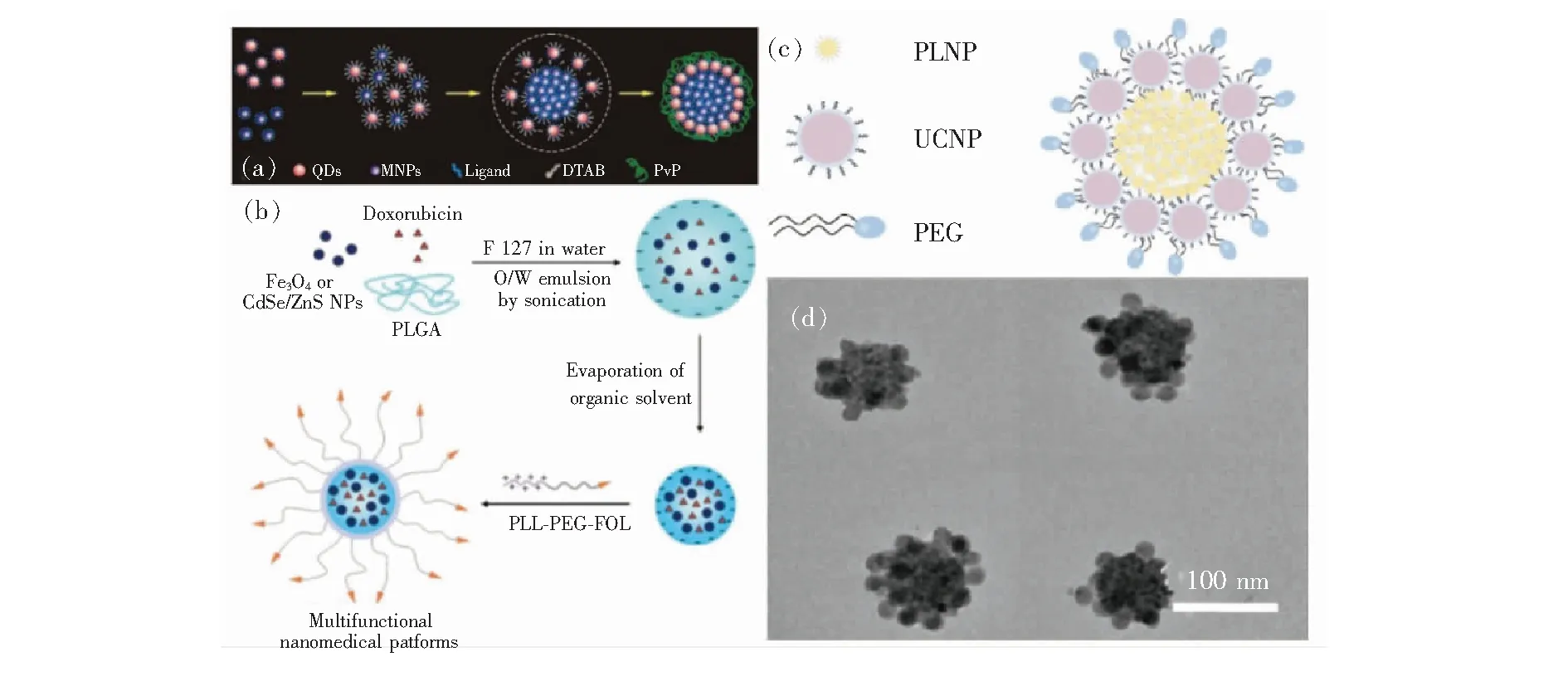
图4 (a)CS-SPs(core-shell supernanoparticles)纳米团簇的形成示意图[44];(b)多功能聚合物纳米团簇的合成过程[45];(c)纳米团簇设计及修饰示意图;(d)纳米团簇场发射透射电镜图[42]。Fig.4 (a)Schematic of the formation of the CS-SPs[44]. (b)Synthetic procedure for the multifunctional polymer nanoparticles[45]. (c)Schematic diagram of hybrid nanocluster(NCPL-NC) composed of upconversion nanoparticles and PLNPs. (d)TEM image of UCPL-NCs[42].
2.5 MOF杂化设计
2012年,Lu等在NatureChemistry上发表了一篇有关将纳米材料可控地包封到MOF(金属有机框架)中的论文,提出了一种封装策略可同时控制MOF基质中掺入的纳米材料的尺寸、组成、分散性以及空间分布,为有机-无机材料杂化及其生物应用提供了一种新的思路和方法(图5(a))[49]。MOF是永久的微孔材料,通过在适当的溶剂中将金属离子与有机配体组装在一起而合成[50-52]。MOF还具有晶体结构,通常具有较大的表面积、均匀且可调谐的腔。这些特性使它们在多个领域中得到了应用,包括气体存储[53]、化学分离[54]、催化[55]、传感[56]和药物输送[57-58]等。
Lv等利用MOF优异的表面特性,开创了MOF杂化的长余辉纳米诊疗剂的设计策略,以MOF作为长余辉纳米材料的框架能够更好地扩展生物方面的应用(图5(f))[59]。由于MOF是具备周期性微孔表面特性的金属有机化合物,比上述所介绍的大空腔结构以及嵌入模板结构都更易于负载药物,比如,MOF对DOX的负载量可高达93.2%。

图5 (a)ZIF-8中纳米颗粒的受控包封方案[49];(b)MOF杂化的长余辉纳米诊疗剂(PLNPs@ZIF-8)的合成;(c)长余辉纳米颗粒的TEM图像;(d)ZIF-8的TEM图像;(e)PLNPs@ZIF-8 的TEM图像[57];(f)MOF杂化的长余辉纳米诊疗剂用于成像和癌症治疗的设计示意图;(g)在37 ℃下,pH值为7.4,6.5和5.5的PBS中ZGGO@ZIF-8-DOX纳米粒子的DOX释放曲线;(h)针对不同浓度的ZGGO@ZIF-8、ZGGO@ZIF-8-DOX和DOX的4T1细胞活性检测[59]。Fig.5 (a)Scheme of the controlled encapsulation of nanoparticles in ZIF-8 crystals[49]. (b)Synthesis of long-lasting NIR persistent luminescent MOF (PLNPs@ZIF-8). TEM images of PLNPs(c), ZIF-8(d) and as-prepared PLNPs@ZIF-8(e)[57]. (f)Schematic illustration of the preparation of the ZGGO@ZIF-8 for multimodal imaging and cancer therapy. (g)Cumulative DOX release profiles of ZGGO@ZIF-8-DOX nanoparticles in PBS with pH values of 7.4, 6.5 and 5.5 at 37 ℃. (h)Cell viability of 4T1 cells against different concentrations of ZGGO@ZIF-8, ZGGO@ZIF-8-DOX and DOX. The cells were incubated at 37 ℃ for 24 h in the dark. Error bars were based on means±standard deviation(n=6)[59].
另外,人体正常的大部分体液pH=7.2~7.4,而肿瘤周围的环境为微酸性[60-61],在微酸性环境下,负载DOX的MOF材料能够快速释放且释放得更充分,这对于实现肿瘤定点药物释放是十分有利的(图5(g))。图5(h)的结果表明,MOF杂化的长余辉纳米诊疗剂中负载的DOX可以在4T1细胞(小鼠乳腺癌细胞)中有效释放。由此可见,这种MOF杂化的长余辉纳米诊疗剂可实现无激发延迟成像以及pH响应药物递送的双重功能。2019年,Zhao等同样通过MOF框架构建了长余辉纳米长余辉诊疗剂[57]。在这篇报道中,MOF杂化的长余辉纳米诊疗剂是通过表面吸附诱导的自组装方法在长余辉纳米颗粒上原位生长MOF制备而成的(图5(b))。图5(c)~(e)表明,一个MOF框架可包封多个长余辉纳米颗粒,在仅包封一个长余辉纳米颗粒(图5(f))的基础上,增加了MOF与长余辉纳米颗粒杂化封装设计的可控可调性。
3 长余辉纳米诊疗剂应用
长余辉纳米诊疗剂的开发和设计已经引起了广泛关注。这是由于长余辉纳米诊疗剂在生物医学领域(例如诊断性活体成像/示踪和药物负载-释放治疗)显示出了巨大的应用潜力,为癌症诊断和治疗提供了更多的可能性。
3.1 生物成像/示踪
肿瘤转移的早期发现对肿瘤的诊断和治疗是非常重要的,也是具有挑战性的。在过去的十年中,已经报道了许多长余辉材料以提供独特的光信号作为光学生物标记或生物探针[12,62-63]。这些长余辉纳米诊疗剂展示了在癌症早期诊断、致癌机理分析以及癌症治疗方面的应用潜力。Chuang等报道了长余辉纳米诊疗剂对RAW 264.7细胞的非侵入性长期体内追踪[64]。Liu等报道了长余辉纳米诊疗剂对乳腺癌细胞的实时追踪以及对切除手术的指导[65]。Zhao等制备了含有水凝胶的长余辉纳米诊疗剂用于靶向和无自发荧光的肿瘤转移成像[21]。除此之外,在活体成像中,基于长余辉纳米诊疗剂的长余辉成像具有更高的SNR(信噪比)、易于操作和高穿透性的特点,Qiu等报道了一种由上转换纳米材料和长余辉纳米材料组成的杂化纳米团簇。如图6(a)~(b)所示,这种纳米团簇诊疗剂能够在体内激活长余辉进行活体成像,并且由于能在生物窗口反复激发,余辉持续时间不再是长余辉生物成像的限制[42]。从猪肉覆盖实验(图6(c))和体内成像实验(图6(d)~(g))中可以看出,在980 nm的激发下,这种纳米团簇的信噪比高达124.5,具有很强的穿透能力和高信噪比。Lu等报道了用于PL/CT(长余辉发光/电子计算机断层扫描)双峰成像的长余辉纳米诊疗剂(图6(h)~(i)),这种具有多模成像功能的纳米诊疗剂可以作为具有高信噪比和良好空间分辨率的肿瘤成像的潜在工具[66]。生物成像可以直观地表征个体水平,甚至细胞和分子水平上生物体的病理变化。因此,细胞成像和活体成像可用于动态监测肿瘤发生和发展过程中的关键分子水平事件和癌症转移。
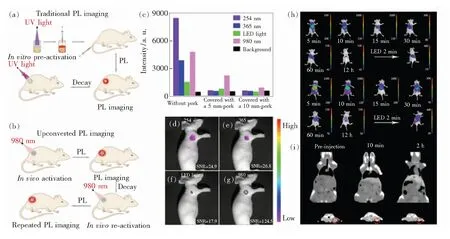
图6 (a)传统的紫外光激发长余辉生物成像示意图;(b)近红外光激发长余辉生物成像示意图;(c)96孔板中200 μL、3 mg/mL 的纳米团簇水溶液在不覆盖猪肉、覆盖5 mm猪肉、10 mm猪肉的情况下,在体外不同波长激发光源(254 nm、365 nm、白色发光二极管LED以及980 nm)的余辉成像的平均强度,其中254,365,980 nm光的功率强度为100 mW/cm2,而白色LED光的功率则为10 W;(d)~(g)注射分别被254 nm、365 nm、LED和980 nm的光激活的纳米团簇(50 μL,3 mg/mL)后,在裸鼠的淋巴结处检测到体内淋巴结图像[42];(h)尾静脉注射长余辉纳米诊疗剂后HepG2荷瘤裸鼠的体内长余辉发光成像;(i)尾静脉注射长余辉纳米诊疗剂后HepG2荷瘤小鼠的体内CT成像[66]。Fig.6 (a)Schematic diagram of traditional UV-light-charged PL bioimaging. (b)Schematic diagram of NIR-light-charged UCPL bioimaging. (c)Mean intensity of PL imaging activated at different wavelengths of light in vitro, 200 μL of the 3 mg/mL UCPL-NC aqueous solution in a 96-well plate activated at 254 nm light, 365 nm light, white light-emitting diode(LED) light, or 980 nm laser covered without pork, with 5 mm of pork, or 10 mm of pork. The power intensity of 254 nm light, 365 nm light, and 980 nm laser was 100 mW/cm2, and the power of the white LED light was 10 W. (d)-(g)In vivo lymphatic images were detected at the lymph nodes of the nude mice after the injection of UCPL-NCs(50 μL, 3 mg/mL) activated at 254 nm light, 365 nm light, LED light, or 980 nm laser[42]. (h)In vivo persistent luminescence imaging of HepG2 tumorbearing nude mice after tail vein injection. (i)In vivo CT imaging of HepG2 tumor-bearing mice through tail vein injection[66] .
3.2 药物负载-释放
癌症的治疗方法包括手术切除、放射治疗以及化学治疗等。其中化学治疗是最常用的癌症治疗方法之一,但其耐药性和对健康组织的副作用或毒性等缺点限制了其临床疗效。而传统的肿瘤切除手术一般采用CT、核磁共振(MRI)、超声显像、造影等方式对肿瘤的位置和形状进行导航及定位,存在定位不准确、定位时间长以及对人体有毒副作用等缺点[67]。
近年来,研究人员进一步探索了长余辉纳米诊疗剂在癌症治疗中的应用。因为长余辉发光可用于确定治疗所需的准确位置和时间,被称为“影像引导疗法”[68-69]。这些具有高药物存储容量和出色的长余辉发光能力的长余辉纳米诊疗剂显示出作为药物载体和释放治疗的潜力。
Chen等构建了脂质体包裹的长余辉纳米颗粒作为新型诊疗剂。由于脂质体具有生物相容性和生物降解性的突出优点,该新型诊疗剂已被广泛用作生物医学应用的药物载体[70]。Feng等开发了类似树莓状的Zn1.07Ga2.34Si0.98O6.56∶Cr (SiZGO)长余辉纳米诊疗剂,用于增强长余辉成像和化疗效果[71]。Lv等评估了ZGGO@ZIF-8-DOX(MOF杂化的长余辉纳米诊疗剂)对4T1肿瘤小鼠的化疗效果[57]。4组肿瘤小鼠内注射30 μL的PBS、ZGGO@ZIF-8(0.54 mg/mL)、游离DOX(0.50 mg/mL)和ZGGO@ZIF-8DOX(1.04 mg/mL)作对比(图7(a)),ZGGO@ZIF-8-DOX组比游离DOX组具有更高的肿瘤抑制率,这可能归因于DOX从ZIF-8框架的延迟释放作用(图7(b)~(c))。实验证明了MOF杂化的长余辉纳米诊疗剂具有突破性的治疗作用,在ZGGO@ZIF-8-DOX实验组中明显地观察到肿瘤细胞的坏死和凋亡,这表明ZGGO@ZIF-8纳米诊疗剂是一种有潜力的药物载体,可以在体内肿瘤治疗中实现响应性药物释放。然而,除了这些设计策略外,对于长余辉纳米诊疗剂的靶向性和治疗效率还需要做更多的努力。
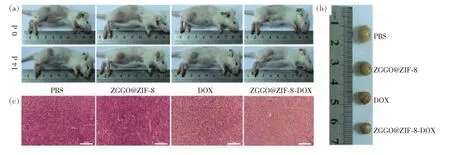
图7 (a)治疗前(0 d)和治疗后(14 d)各组荷瘤小鼠的代表性照片;(b)14 d后切除的肿瘤的照片;(c)在14 d之内,苏木精和曙红对肿瘤组织的染色(比例尺代表50 μm)[57]。Fig.7 (a)Representative photographs of tumor-bearing mice for each group before(0 d) and after(14 d) therapy. (b)Typical photographs of excised tumors in 14 d. (c)Hematoxylin and eosin staining of tumor tissues in 14 d. Scale bars represent 50 μm[57].
4 总结与展望
本文介绍了几种用于生物成像和治疗的长余辉纳米诊疗剂的设计策略,这些设计的结构主要包括大空腔结构、嵌入模板结构、多层结构、纳米团簇结构和MOF杂化结构。
聚焦于生物医学诊疗面向一体化进程和长余辉纳米材料功能单一的问题,主要的技术难点在于两方面的矛盾:(1)长余辉发光强度和形貌尺寸的博弈矛盾;(2)无机表面钝化和多功能化要求的矛盾。通过长余辉纳米诊疗剂的多种设计策略已经从以下这几个方面提高了其功能性:(1)光学性能。由于设计策略的独特优势,如大空腔设计、介孔二氧化硅模板、二氧化硅涂层的高温保护机制,长余辉纳米诊疗剂仍可通过高温煅烧产生强烈的余辉。(2)纳米尺寸。由于模板的限制作用,如碳球的蒸发、介孔二氧化硅的微孔以及MOF周期性的微孔,即使在高温下也可以防止长余辉纳米诊疗剂的生长和附聚。(3)生物相容性。由于纳米材料的钝化表面,难以在生物体中实现良好的流动性和相容性。但是,通过有机大分子或聚合物的修饰或封装,使长余辉纳米诊疗剂具有更好的分散性和稳定性。(4)功能化。通过介孔结构能够嫁接生物大分子或药物,以及MOF结构对于微酸性环境的响应性药物释放,都能够进一步拓展长余辉纳米诊疗剂在治疗方面的功能。
然而,长余辉纳米诊疗剂在临床应用中仍然存在很大的挑战。对于临床应用,除了诊疗剂的构建外,还需要付出更多的努力,例如功效、价格、临床安全性和降解等。未来可进一步以核酸或细胞膜辅助构建长余辉纳米诊疗剂,发展无毒且“仿生”的长余辉纳米诊疗剂[72-73]。尽管长余辉纳米诊疗剂仍处于发展阶段,但近阶段的研究成果显示了其优异特性以及巨大潜力,使得它们会继续对生物应用领域产生重大影响。我们相信长余辉纳米诊疗剂是未来癌症诊断和治疗的有力候选者,希望这篇综述可以为开发新型长余辉纳米诊疗剂和多种应用发现新的潜力和提供新的方向。
