植物乳杆菌FEED8对小鼠抗氧化作用的研究
2020-12-23闫刘慧王小鹏金庭飞刘作文刘力
闫刘慧,王小鹏,金庭飞,刘作文,刘力
(1.广东益可维健康科技有限公司,广州 510663;2.河南花花牛乳业集团股份有限公司,郑州 450000;3.福成五丰食品股份有限公司,廊坊 065200;4.北京食品营养与人类健康高精尖创新中心,中国农业大学,北京 100083)
氧化损伤因机体参与氧化应激而导致多种慢性系统疾病,也体现了机体衰老发生与发展的基础病理代谢过程[1,2],这种代谢过程进一步会诱发炎症、癌症、阿尔兹海默症、心脑血管疾病、肺部疾病、肝脏疾病等慢性疾病,也会导致细胞、组织乃至器官不可逆性的衰老[3~7],导致机体损伤。当机体的活性氧(reactive oxygen species,ROS)与自由基的生成能力超过清除能力时,活性氧与自由基积累会使得机体氧化还原系统的平衡被打破,对机体造成不可逆影响。丙二醛(MDA)是膜脂过氧化产生的,MDA在细胞内积累会造成一定的氧化损伤,破坏机体细胞内的核酸、蛋白质、脂质等[8,9]。因此,抗氧化系统对于抵抗氧化应激反应、降低氧化损伤、维持氧化还原平衡具有重要作用[10]。抗氧化系统主要包括两种氧化剂——酶类抗氧化剂和非酶类抗氧化剂,测定抗氧化剂的抗氧化水平可通过测定总抗氧化能力(Total antioxidant capacity,T-AOC)进行[9]。其中,酶类抗氧化剂主要是催化体内氧化酶的毒性产物H2O2的分解[11],主要包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(CAT)、巯基依赖型抗氧化系统(如:谷胱甘肽过氧化物酶GSH-Px)等[12];非酶类抗氧化剂主要包括水溶性抗氧化剂(如:维生素C、硫辛酸LA、尿酸UA)和脂溶性抗氧化剂(如:维生素A、维生素E、辅酶Q10、虾青素)[13~15]。目前抗氧化活性评价方法有四类:体外化学方法模拟法(如:清除自由基、抑制脂质过氧化、螯合金属离子等),优点是方便且快速,缺点是外界环境因素干扰较大[16,17];抗氧化活性细胞模型法(如:人源或动物源细胞系的抗氧化细胞模型),优点是相对精准,缺点是未考虑体内环境的复杂性,因此只能作为体内实验前的预判断[18];抗氧化活性体内研究法(如:动物氧化模型),优点是能直接且清晰判断抗氧化能力,缺点是耗时长、成本高[19];抗氧化活性分子生物学研究法,可以深入探究起氧化作用的具体生物活性物质[20]。近几年关于肠道微生态的研究日益增多,益生菌对于机体抗氧化作用也日益突出,其机制主要从三方面考虑:促进ROS清除、提高抗氧化酶活性、保护DNA免受氧化损伤[21~24]。本试验通过抗氧化活性体内研究法,建立小鼠氧化损伤模型,探究一株植物乳杆菌抗氧化作用的效果。
1 材料与方法
1.1 材料与试剂
实验菌株:植物乳杆菌(Lactobacillus plantarumFEED8,保藏编号为CGMCC No.15029 ),分离自广西巴马长寿老人肠道;实验动物:KM雄性小鼠,SPF级,2月龄,18~22g(广东省实验动物中心);无乳杆菌小鼠饲料(上海斯莱克实验动物有限责任公司,饲喂前经辐射灭菌);D-半乳糖(中国医药集团上海化学试剂公司);GSH-Px 试剂盒、SOD试剂盒、T-AOC试剂盒、MDA试剂盒,蛋白定量测试盒(南京建成生物工程研究所)。
1.2 仪器与设备
高压灭菌锅(型号GI54DWS,zealway公司);多功能生化培养箱(型号ZSD-1160,TOKYO RIKAKIKAI CO.LTD);电热恒温鼓风干燥箱(型号DHG-9076A,上海精宏实验设备有限公司);低温高速离心机(型号3K30,德国Satorious公司);紫外-可见分光光度计(型号UV-2800,尤尼柯(上海)仪器有限公司);匀浆器(德国普鲁克公司)。
1.3 试验方法
1.3.1 植物乳杆菌活菌体菌悬液的制备
将植物乳杆菌按照107CFU/mL的接种量分别接种于500mL的MRS液体培养基中,37℃厌氧培养18h,4 500g离心15min收集菌体,菌体沉淀重悬于质量分数10%(w/v)的脱脂乳中,分别配制成2×106CFU/mL的低剂量菌悬液、2×108CFU/mL的中剂量菌悬液、2×1010CFU/mL的高剂量菌悬液。
D-半乳糖溶液:D-半乳糖以灭菌生理盐水配制成60mg/mL溶液,使用前用0.22微孔滤膜过滤除菌。
1.3.2 试验分组
50只小鼠适应一周后,随机分组,每组10只。分组编号、组别、处理方式见表1。期间每3d称重1次,调整灌胃量,连续灌服45d,灌胃量为0.1mL/kg/d。试验期间小鼠自由饮食,12h灯照/黑暗循环。
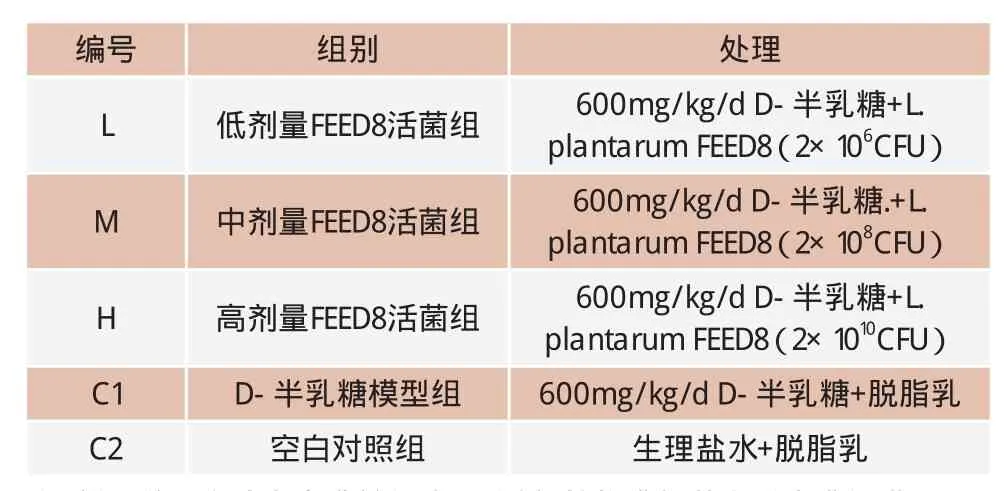
表1 动物实验分组情况(n=10)
1.3.3 检测指标处理
取上述步骤中连续给予样品45d的实验小鼠,于末次灌胃后称重,并禁食12h,眼球取血并用颈椎脱臼法处死小鼠。肝素钠抗凝管收集血液,3 000g离心10min,上清液0℃低温保藏备用。解剖小鼠,取出脑和肝脏,分别称取0.1~0.2g脑和肝脏组织,加入9倍体积的生理盐水,于匀浆器中制成10%的组织匀浆液,3 000g离心10min,分别取上清液0℃低温保藏备用。通过生化试剂盒分别测GSH-Px活力、SOD活力、T-AOC含量、MDA含量和蛋白含量。各测试方法按照试剂盒说明书进行。
1.4 统计学分析
所有数据均用统计软件SPSS22.0进行单因素方差分析,应用Duncans法进行多重比较,通过t检验进行显著性分析,显著性水平均设定为P〈0.05。各项指标结果以“平均值±标准差”(mean±SD)表示。
2 结果与分析
2.1 试验前后各组小鼠体重变化
试验前后对各组小鼠进行体重测定,结果如图1所示。各组小鼠体重均有所增加。与C2组相比,C1组小鼠增重明显放缓,说明造模成功,造模对小鼠生长有不利影响;与C1组相比,L、M、H组小鼠体重均增加,且M、H组增重较C1组有显著性,说明植物乳杆菌FEED8中高剂量对小鼠生长有显著促进作用;L、M、H组比较,小鼠增重随FEED8浓度增加而增大,说明该菌株在实验浓度范围内小鼠增重与浓度呈正相关。
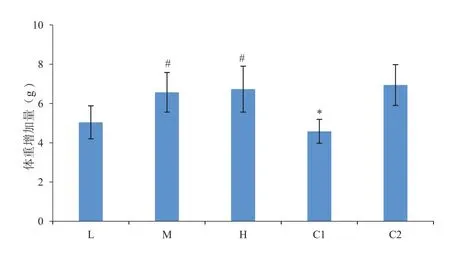
图1 试验前后各组别小鼠体重变化对比
2.2 植物乳杆菌FEED8对小鼠血清指标的影响
植物乳杆菌FEED8对小鼠血清GSH-Px活力、SOD活力、T-AOC含量、MDA含量的影响如图2所示。与C2相比,C1小鼠血清中的GSH-Px活力、SOD的活力、T-AOC含量显著降低,而MDA含量显著升高,说明衰老小鼠造模成功。与C1相比,L、M、H小鼠血清GSH-Px活力、SOD活力,T-AOC含量升高,MDA含量降低,除SOD活力外,M、H组差异显著,说明植物乳杆菌FEED8对小鼠血清具有抗氧化效果,且在实验浓度范围内抗氧化效果随浓度升高而增强。
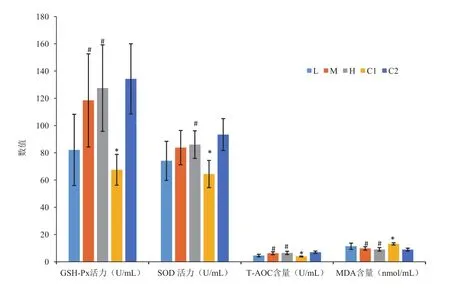
图2 不同组别小鼠血清抗氧化指标对比
2.3 植物乳杆菌FEED8对小鼠脑指标的影响
植物乳杆菌FEED8对小鼠脑GSH-Px活力、SOD活力、T-AOC含量、MDA含量的影响如图3所示。与C2组相比,C1组小鼠脑中的GSH-Px和SOD活力、T-AOC含量均显著降低,而MDA含量显著升高,说明衰老小鼠造模成功。与C1相比,M、H组小鼠脑GSH-Px活力、SOD活力显著提升,L、M、H组小鼠脑T-AOC含量均显著提升,且M、H组小鼠脑MDA含量显著降低,说明植物乳杆菌FEED8对小鼠脑具有抗氧化效果,且在实验浓度范围内抗氧化效果随浓度升高而增强。

图3 不同组别小鼠脑抗氧化指标对比
2.4 植物乳杆菌FEED8对小鼠肝脏指标的影响
植物乳杆菌FEED8对小鼠肝脏GSH-Px活力、SOD活力、T-AOC含量、MDA含量的影响如图4所示。与C2组相比,C1组小鼠肝脏中的GSH-Px活力、SOD活力、T-AOC含量均显著降低,而MDA含量显著升高,说明衰老小鼠造模成功。与C1组相比,M、H组小鼠肝脏GSH-Px活力、SOD活力、T-AOC含量显著提高,且H组MDA含量明显降低,说明植物乳杆菌FEED8对小鼠肝脏具有抗氧化效果,且在实验浓度范围内抗氧化效果随浓度升高而增强。
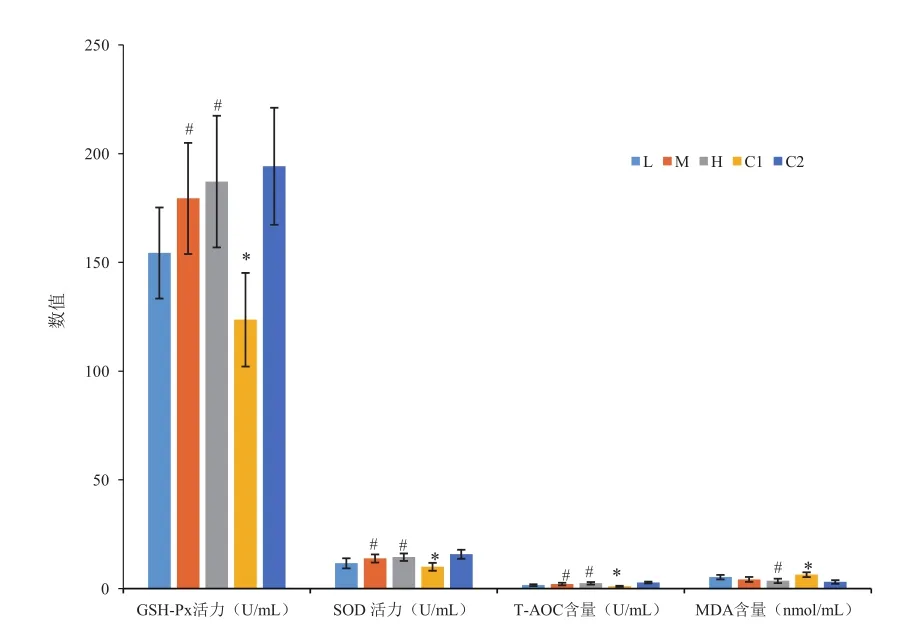
图4 不同组别小鼠肝脏抗氧化指标对比
3 结论
植物乳杆菌FEED8对D-半乳糖致衰小鼠抗氧化系统的试验表明,与模型组相比,灌胃该菌组小鼠血清、脑、肝脏中SOD活性、GSH-Px活性和T-AOC含量均有升高,MDA含量均有降低,且FEED8中高剂量组数据与模型组相比大多差异显著,三个组织试验结果一致,说明植物乳杆菌FEED8具有抗氧化能力,且随浓度增加抗氧化能力增强。植物乳杆菌FEED8的抗氧化作用,可能与肠道菌群通过参与氧化应激、炎性反应、免疫反应、代谢作用等多种途径[25]影响机体对氧化损伤和组织修复能力有关,其机理仍需进一步探究。
