血管紧张素转换酶基因多态性与我国慢性心力衰竭易感性分析
2020-12-22白强胡紫薇兰晓栋高积慧
白强,胡紫薇,兰晓栋,2,高积慧
心力衰竭(心衰)是指由于心脏结构或功能异常导致心室充盈或射血能力受损所致的一组复杂临床综合征,为各种心脏病的严重和终末阶段。发达国家的心衰患病率为1.5%~2.0%,≥70岁人群患病率≥10%。中国最近的流行病学调查显示,我国35~74岁成人心衰患病率为0.9%[1],心衰患者的死亡率和再住院率居高不下。心衰始于心肌损伤,导致病理重塑,最终出现左心室扩大。肾素-血管紧张素-醛固酮系统(RAAS)作为人体内主要的体液调节系统,在心衰代偿期可以通过水钠潴留、外周血管收缩及增强心肌收缩等维持心脏输出;但在失代偿期可以导致细胞毒性,引起心肌纤维化,导致心率失常及泵衰竭。血浆血管紧张素转换酶(ACE)水平与遗传密切相关,目前已知约有160多个ACE基因多态性位点,其中大部分为单核苷酸多态性(SNPs),目前研究较多的是插入/缺失(I/D)多态性。ACE的多态性与高血压、冠心病、糖尿病肾病,扩张性心肌病、脑卒中等密切相关[2-5]。但与心衰还存在争论,不同人群在ACE基因多态性及与疾病的易感性是有差异的,目前未有针对中国地区ACE的多态性与心衰关联性的Meta分析研究,所以本文开展了ACE基因多态性与心衰易感性的研究。
1 资料与方法
1.1 纳入与排除标准纳入标准:①研究对象:为中国地区心衰患者;②干预措施:病例组为经症状、体征及影像学检查确诊的心衰患者;③对照:对照组为普通健康人群;④结局指标:ACE多态性基因频率;⑤研究设计:病例-对照研究或队列研究;文献类型中文和英文文献。
排除标准:①研究对象非心衰患者;② 动物实验及综述;③数据不全或数据有误;④重复性文献。
1.2 资料来源与检索策略参考系统综述和荟萃分析优先报告的条目,由2名人员共同进行文献检索。用血管紧张素转换酶、肽基二肽酶A、肾素-血管紧张素系统和基因多态性和心衰、慢性心衰、舒张性心衰、收缩性心衰、射血分数保留性心衰、射血分数降低性心衰等,为主题或关键字对PubMed、EMbase、CNKI、CBM、VIP和WanFang数据库检索,搜收集国内外ACE I/D基因多态性与HF发病风险关联性的病例-对照研究或队列研究,文献检索截止时间为2019年10月1日。此外检索纳入文献及相关综述的参考文献,并对在Google及百度学术进行检索,补充未纳入上述数据库文献。
1.3 质量评估与数据提取2名研究者独立地按照纳入和排除标准筛选文献、提取资料,并交叉核对。若存在争议,通过讨论方式达成一致或交由第三方解决。资料提取内容包括:第一作者、发表年份、研究地点、基因型检测方法、病例组和对照组基因型和等位基因分布及其频数、偏倚风险评价的关键要素等。采用NOS量表(Newcastle-Ottawa Scale)评估文献质量,>4分为高质量[6]。
1.4 统计学处理应用Stata 13.1软件进行Meta分析。以DD vs. II、DI vs. II、DD vs. DI+II、DD+DI vs. II、遗传模型,初步探讨其相关性。异质性评价:若P>0.1且I2<50%,提示研究间异质性较小,采用固定效应模型进行统计分析;反之则选择随机效应模型。通过亚组分析进行异质性来源的探讨。采用OR值及95%CI作为效应指标,P<0.05视为有统计学意义。敏感性分析采用逐个排除研究的方法评价结果的稳定性;发表偏倚评价采用Egger检验[7]。
2 结果
2.1 文献检索结果初检共获得相关文献341篇,经逐层筛选后,最终纳入13篇文献[8-20],英文文献2篇,中文文献11篇,文献筛选流程见图1。
2.2 纳入研究的基本特征纳入的13篇文献均为病例-对照研究,纳入心衰患者1524例健康对照1576例,合计样本量为3100例。纳入地区广东5篇[8-12]、福建1篇[13]、海南1篇[14]、台湾2篇[15,16]、辽宁1篇[17]、山东1篇[18]、湖南1篇[19]、湖北1篇[20]。其中4[11,14,17,18]个研究对照组不符合HWE平衡。5[9,11-14]个研究明确名族为汉族。基因型检测均为PCR和PCR-RFLP。具体见表1。
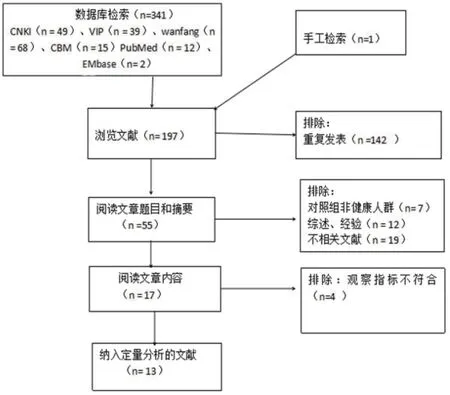
图1 文献筛选流程图
2.3 Meta分析结果异质性检验各遗传模型异质性均较大(I2>50%,P<0.01),选用随机效应模型进行数据合并,结果显示D等位基因增加HF患者风险,差异有显著性(OR=1.684,95%CI:1.466~1.936,P=0.02),各基因模型进行结果为,DD vs. II模型(OR=2.295,95%CI:1.893~2.782,P=0.02);DD vs. DI+II I模型(OR=1.971,95%CI:1.679~2.313,P=0.000);DD+DI vs. II模型(OR=1.593,95%CI:1.364~1.861,P=0.006)。但DI vs. II模型,差异无统计学意义(OR=1.265,95%CI:1.067~1.500,P=0.106)。
进一步根据地区进行亚组分析,异质性检验发现:4种模型中台湾地区的异质性高,且在各模型中无统计学意义。另外除DI vs. II、DD+DI vs. II模型中广东+福建+海南地区异质性高,其余遗传模型异质性均较低。表明按地域进行亚组分析后,各组异质性显著降低。但D vs. I组在湖南和湖北地区的差异无统计学意义(OR=0.829,95%CI:0.621~1.108,P=0.206)。根据是否符合哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)进行亚组分析,表明是否符合 HWE未对结论产生明显影响。具体见表2与表3及图2~6。

表1 纳入研究的基本特征、NOS评分
2.4 敏感性分析本文对上述 5个基因模型的合并效应量进行了敏感性分析。在逐一排除纳入文献后,Meta分析结果变化不大,说明结果可信度较高(图7)。
2.5 发表偏倚分析Egger回归法量化检测未见发表偏倚(D:I为0.757、DD vs. II为0.905、DI vs. II为0.657、DD vs. DI+II为0.673及DD+DI vs. II为0.679),具体见表2。

表2 Meta分析结果及Egger值
3 讨论
ACE[21]基因由26个外显子和25个内含子构成。一个287 bp的DNA片段,是否在第16内含子中决定了ACE基因 I/D多态性,I等位基因为含有本片段,D等位基因为不含本片段。产生I/I、I/D、D/D三种不同的基因型[22,23]。ACE基因的多态性可能导致血压升高,但对于ACE基因多态性对HF的发生的争论一直存在,部分研究发现D等位基因与心衰的易感性有关[24-26],但另一部分则认为ACE I/D多态和HF之间没有显著的关联[27,28]。不同人群在ACE 基因多态性及与疾病的易感性是有差异的,为此我们专门针对中国地区开展ACE的多态性与心衰的研究。
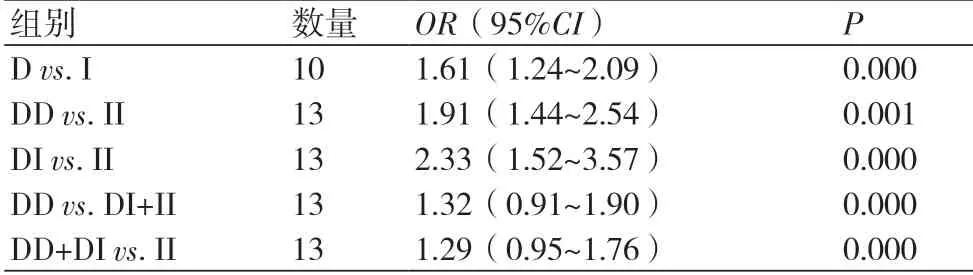
表3 HWE平衡Meta分析
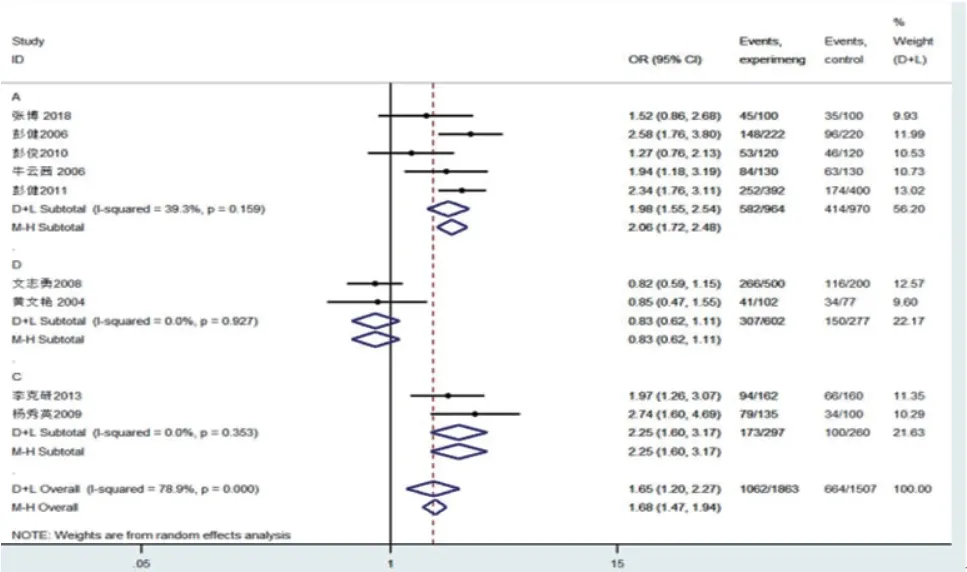
图2 D vs. I Meta分析
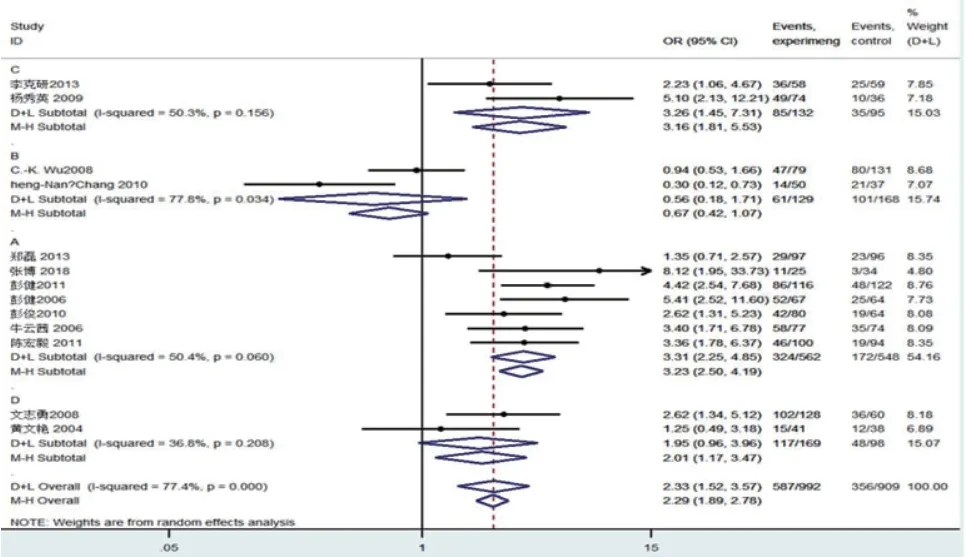
图3 Dd vs. II模型Meta分析

图4 DI vs. II 模型Meta分析

图7 逐一排查敏感性分析
本次研究发现,与I等位基因相比,ACE基因I/D多态位点D等位基因增加心衰患者风险,因此认为,该ACE基因I/D多态性中D等位基因与心衰的易感性有关。研究表明ACE基因I/D多态性和多种心血管疾病或病理因素有关。在高血压合并代谢综合征的患者,其胆固醇水平和ACE II基因型明显相关[29]。ACE多态性中DD基因型与冠心病有显著关联,是冠心病的主要致病基因[30]。ACE基因I/D多态性与亚洲人群脑梗死的易感性相关,DD基因型可能是高血压合并脑梗塞发病的独立危险因素[31]。在对于少数名族壮族的研究中发现,高血压患者ACE基因I/D多态性与血压盐敏感无明确相关性,与左室肥厚存在相关性[32]。ACE基因I/D多态性可能是能上调血浆中血管紧张素Ⅱ(AngⅡ)的浓度而导致各种疾病。AngⅡ是肾素-血管紧张素-醛固酮系统(RAAS)中最最要的环节,AngⅡ可导致炎症、氧化应激、心肌纤维化,进而心室的重塑[33]。尽管在代偿期,AngⅡ可使外周阻力血管持续收缩,血容量增大,回心血量增加,心脏前后负荷增加,同时心率加快,心肌收缩力增强,维持心脏的正常射血功能。但长时间的刺激,细胞水平上,AngⅡ通过作用于AngⅡ受体使心肌肥厚和纤维化,这是心衰的重要病理基础。进入失代偿期后心肌纤维化、心室重塑会导致左室舒张顺应性降低,左室充盈压升高,射血分数及心输出量降低,影响了心脏的收缩和舒张功能,加重了心衰的发生。因此本研究发现的ACE基因I/D多态性对心衰的易感可能与血管紧张素Ⅱ的浓度改变有关。台湾地区的Meta分析示,ACE基因I/D与HF患者风险无关。显示不同地区的的ACE基因I/D与HF易感性不同,可能和不同人群有关。
本研究存在一些缺陷:第一,台湾地区的异质性的存在可能会影响结果的准确性;第二,个别文献质量不高,可能对结果造成一定影响;第三,影响ACE基因I/D因素较多,如发病年龄、性别、用药等,本次研究未能排除这些干扰因素。
综上所述,当前证据显示ACE的D等位基因是中国大陆地区HF的危险因素,考虑纳入文献数据之间的异质性因素,本研究结论仍需优化的多中心、大样本量的研究进行验证。
