??生姜ZoWRKY1基因的克隆及其与6-姜酚生物合成的相关性分析?
2020-12-21唐建民齐力旺贺小婷蒋雨欣李哲馨
唐建民 齐力旺 贺小婷 蒋雨欣 李哲馨
摘 要:生姜(Zingiber officinale Roscoe)是药食兼用的高附加值特色经济作物,姜辣素是生姜的核心药用成分,6-姜酚则是姜辣素的主要成分。以川渝特色生姜品种竹根姜根茎为研究材料,克隆ZoWRKY1基因并分析其在竹根姜不同发育阶段的表达及其与6-姜酚含量增量的相关性,探讨不同浓度NaCl胁迫下ZoWRKY1与6-姜酚合成酶基因ZoPAL、ZoC4H和Zo4CL的表达及其相关性。结果表明:克隆的ZoWRKY1基因cDNA全长1 026 bp, 登录号为MT414710;氨基酸序列分析显示ZoWRKY1属于WRKY家族的第二类成员;ZoWRKY1的表达水平在竹根姜发育的第二阶段即播种后1个月左右高度上调,且与6-姜酚含量增量存在显著的相关性;在25 g/L NaCl胁迫下,ZoWRKY1与6-姜酚合成酶基因ZoPAL、ZoC4H和Zo4CL高度上调表达,且ZoWRKY1与ZoC4H和Zo4CL的表达存在显著相关性,推测ZoWRKY1基因与ZoC4H及Zo4CL基因存在调控关系并进一步影响6-姜酚的生物合成。
关键词:生姜;WRKY转录因子;6-姜酚合成;相关性
中图分类号:Q786 文献标识码:A文章编号:1006-060X(2020)10-0001-05
Abstract: Ginger (Zingiber officinale Rosc.) is a special economic crop with high added value for both medicine and food. Pungent prinsiple is the core medicinal component of ginger, and 6-gingerol is the main component of pungent prinsiple. ZoWRKY1 gene was cloned from rhizomes of Zhugen Ginger in Sichuan and Chongqing. The expression of ZoWRKY1 gene in different developmental stages and its correlation with 6-gingerol content increment were analyzed. The expression and correlation of ZoWRKY1 and 6-gingerol synthase genes ZoPAL, ZoC4H and Zo4CL under different concentrations of NaCl stress were investigated. The results showed that the full length cDNA of ZoWRKY1 gene was 1026 bp and the accession number was MT414710; amino acid sequence analysis showed that ZoWRKY1 belonged to the second class member of WRKY family; the expression level of ZoWRKY1 was highly up-regulated in the second stage of Zhugen Ginger development about one month after sowing, and there was a significant correlation between ZoWRKY1 expression and 6-gingerol content increment; under 25 g/L NaCl stress, the expression of ZoWRKY1 and 6-gingerol synthetase genes ZoPAL, ZoC4H and Zo4CL were highly up-regulated, and the expression of ZoWRKY1was significantly correlated with the expression of ZoC4H and Zo4CL. It is speculated that there is a regulatory relationship between ZoWRKY1and ZoC4H and Zo4CL genes, and further affect the biosynthesis of 6-gingerol.
Key words: ginger (Zingiber officinale Rosc.); WRKY transcription factor; 6-gingerol synthesis; correlation
生姜(Zingiber officinale Rosc.)是姜科(Zingiber-aceae)姜属(Zingiber)多年生宿根草本单子叶植物,也是药食两用的经济作物。姜辣素(pungent prinsiple)是生姜中的辛辣味物质和药用核心成分[1-4]。姜酚类(gingerols)物质是姜辣素的主要成分,尤以6-姜酚含量最高,可达姜辣素含量的75% 以上。含有苯丙烷结构的物质都是通过苯丙烷代谢途径直接或者间接生成的。目前在已知的包括6-姜酚在内的含有苯丙烷結构的物质生物合成通路中,苯丙氨酸氨裂解酶(phenylalanine ammonia lyase,PAL)、肉桂酸-4-羟化酶(cinnamate 4-hydroxylase,C4H)、4-香豆酸辅酶A连接酶(4-coumarate:CoA ligase,4CL)等酶在6-姜酚的合成过程中扮演着重要角色[5-6]。大量试验数据表明这些酶基因控制着苯丙烷类代谢物的合成。在阿月浑子和银杏树中,PAL基因的表达量与黄酮含量均表现出正相关关系[7-8]。通过胁迫处理降低菊花C4H基因表达量,也会导致黄酮类物质量的减少[9]。桉树中下调C4H的表达会导致木质素含量减少18.9%[10]。在短莛飞蓬和凹唇姜中,4CL基因的表达水平与黄酮类物质的积累呈现显著的正相关性[11-12]。在烟草或拟南芥中抑制PAL、C4H、4CL的表达,均会导致木质素含量的降低,并造成木质素构成的改变[13]。将C4H反义基因转入紫花苜蓿,发现与野生型相比,基因沉默植株木质素含量均有不同程度的降低[14]。
植物中诱导型基因的表达主要受转录水平的调控,而在转录水平上起主要作用的是各类转录因子。WRKY转录因子在植物木质素、黄酮类等苯丙烷类物质合成过程中起着重要的调控作用。欧洲葡萄VvWRKY2基因可激活木质素生物合成途径中VvC4H的表达,进而调控木质素的合成与积累,这一功能在烟草中获得验证[15]。在毛白杨PtrWRKY25超量表达的转基因株系中木质素含量相较于野生型减少约1倍,表明PtrWRKY25可能主要在木质素合成途径中发挥作用[16]。其他植物如苜蓿、云杉等也有WRKY转录因子参与调控木质素合成的相关报道[17-18]。拟南芥中,AtWRKY23能通过上调编码黄酮生物合成途径相关酶基因的表达来刺激黄酮类生物合成,且该调控机制与生长素信号途径密切相关[19]。葡萄中筛选的VvWRKY26转录因子在花青素合成中具有重要的调控作用[20]。过表达苜蓿MdWRKY11基因可促进F3H、FLS、DFR、ANS和UFGT的表达,进而导致苹果愈伤组织中黄酮和花青素的积累量增加[21]。
植物在与环境相互作用时获得了一系列的防卫反应机制,在应对外界各种生物和非生物的胁迫时,植物能通过体内抗性基因的表达,合成并积累次生代谢产物来抵御逆境胁迫以减轻伤害[22]。根据前期已经获得的竹根姜肉质根、地下根茎、地上茎及叶片的RNA-seq測序结果[23],筛选到23个WRKY基因(ZoWRKY),按顺序编号为1~23,其中有5个ZoWRKY(命名为ZoWRKY1~ZoWRKY5)在地下根茎中高度表达。其中ZoWRKY1 基因被盐胁迫诱导后表达量变化较大。该研究重点对ZoWRKY1进行克隆与生物信息学分析,探索其在竹根姜发育不同阶段以及不同浓度盐胁迫下的表达,并结合6-姜酚含量及其生物合成关键酶基因的表达量分析,阐释 ZoWRKY1与6-姜酚合成可能存在的调控关系,以期为ZoWRKY1在生姜6-姜酚生物合成调控中的功能研究奠定基础,并为实现植物化学物质合成与积累的人工调控提供依据。
1 材料与方法
1.1 试验材料及样品采集
选取川渝特色生姜品种竹根姜[24] “渝姜1号”作为研究材料,每年4月开始种植母姜(催芽1个月),10月采收。 根据不同的研究内容分别采样。(1)不同发育阶段竹根姜样品采集:每月15日采集第一分支子姜根茎材料,4月15日—9月15日共6个阶段,记为stage 1~stage 6。(2)NaCl胁迫下竹根姜样品采集:对播种一个月的竹根姜植株叶片喷施不同浓度NaCl溶液(浓度分别为0、25、50、75、100和125 g/L)[25],2 d喷施一次,第10天收获地下根茎。上述样品采集后均置于液氮中快速冷冻,于-80℃冰箱保存备用。
1.2 总RNA提取与cDNA合成
样品总RNA提取采用RNAiso Plus Total RNA 提取试剂盒(Takara,大连),琼脂糖凝胶电泳检测结果显示各阶段样品28S和 18S RNA 清晰可见且无降解,利用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒(TransGen,北京)反转录合成cDNA。
1.3 基因克隆与序列分析
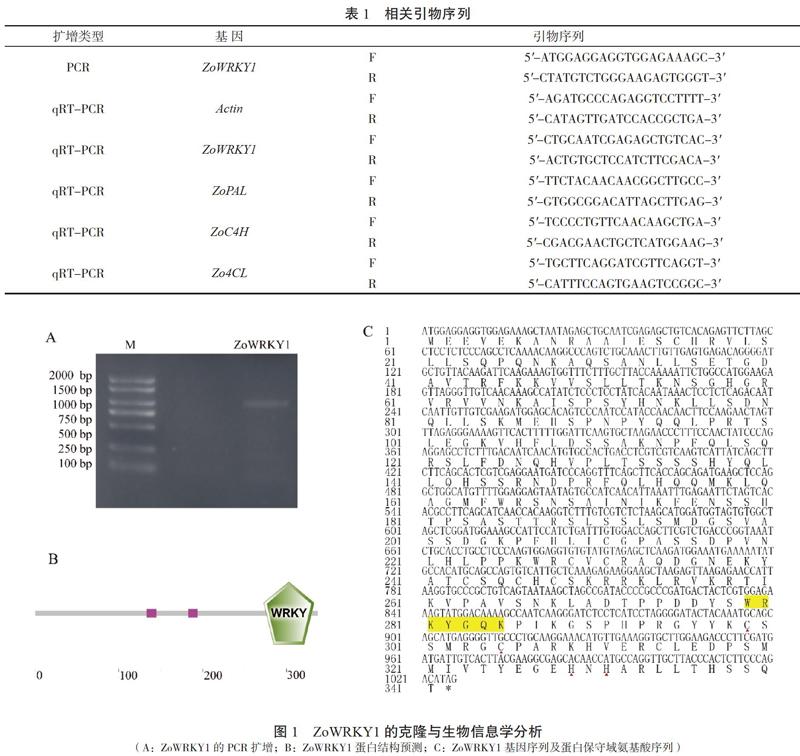
根据转录组测序结果设计ZoWRKY1基因序列的特异引物(表 1),以不同发育阶段竹根姜混合cDNA为模板进行 PCR 扩增,反应体系(20 μL):0×Buffer 10 μL、1.5 mmol/ L Mg2+ 1.5 μL、0.1 mmol/ L dNTPs 4 μL、0.4 μmol/ L F、R引物各0.5 μL、0.5 U rTaq DNA 聚合酶0.2 μL、200 ng/μL cDNA 模板1 μL、ddH2O 2.3 μL。PCR 扩增反应程序:95℃ 5 min;95℃ 10 s,56℃ 30 s,72 ℃ 1 min,35个循环;72℃ 7 min。PCR扩增产物于1.0%的琼脂糖凝胶电泳检测。扩增产物条带单一,切胶回收后连接至克隆载体,克隆试剂盒选用pEASY-Blunt Simple Cloning Kit,转化大肠杆菌Top10,筛选阳性克隆,对菌液进行PCR检测和测序验证。采用DNAman软件分析ZoWRKY1序列组分,并采用在线工具http://smart.embl-heidelberg.de/预测其蛋白结构。
1.4 qRT-PCR分析
将不同发育阶段及NaCl胁迫处理的竹根姜根茎组织cDNA分别稀释10倍作为反应模板,采用TB GreenTM Premix Ex TaqTM (Tli RNaseH Plus)试剂盒(Takara,大连)在qTOWER2.0实时荧光定量PCR系统(Analytik Jena,德国)进行qRT-PCR检测与分析。引物序列如表1所示。反应体系(20 μL):cDNA 2 μL、TB Green Ⅱ 10 μL、引物各0.8 μL、ddH2O 6.4 μL。反应条件:95℃ 30 s;95℃ 5 s,55℃ 15 s,72℃ 10 s,40个循环。
1.5 相关性分析
前期采用LC-MS技术测得不同发育阶段竹根姜中6-姜酚的含量。6-姜酚各阶段增量为各阶段6-姜酚总量减去其前一阶段6-姜酚总量。采用IBM SPSS Statistics18.0统计软件进行相关性分析。
2 结果与分析
2.1 生姜ZoWRKY1基因的克隆与序列分析
从竹根姜转录组测序文库中获得ZoWRKY1 基因的 cDNA 序列,在NCBI中进行BLASTx比对及 ORF 分析,显示该序列具有完整的ORF,推测其为全长基因。设计其特异性引物,以不同发育阶段竹根姜根茎组织混合cDNA 为模板,进行 PCR 扩增,产物与预期大小相符(图1A)。将 PCR 产物连接到pMD19-T 载体上, 测序后获得竹根姜ZoWRKY1基因的cDNA序列,全长1 026 bp, 利用DNAman软件对ZoWRKY1基因序列进行分析,结果显示其编码的蛋白质由341个氨基酸组成。ZoWRKY1基因 cDNA 的序列信息已提交到 NCBI Genbank,登录号为MT414710。经NCBI比对,该基因与姜目芭蕉科小果野蕉MdWRKY21(XM_018829735)的同源性高达92%。氨基酸序列分析结果显示,ZoWRKY1含有1个 WRKY保守结构域以及2个LCR(low complexity region)区域,并包含有C2H2 型锌指结构(图1B和 C),说明ZoWRKY1属于WRKY家族的第二类成员。
2.2 ZoWRKY1在生姜不同发育阶段的表达
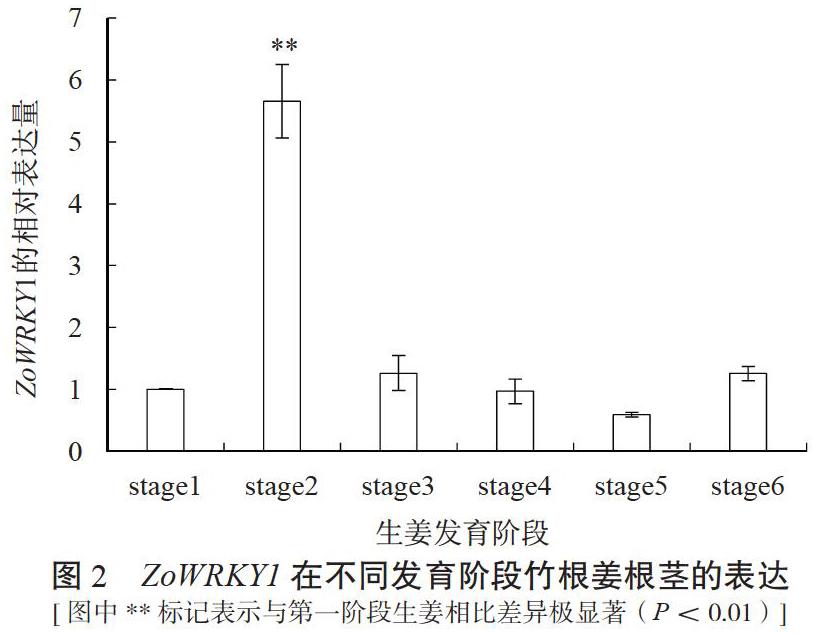
采用qRT-PCR技术检测了竹根姜不同发育阶段ZoWRKY1基因的表达水平,结果如图2所示,ZoWRKY1基因的表达在竹根姜发育过程中变化明显,竹根姜早期发育阶段,即催芽播种后1~2个月(对应stage 2—3)时表达量骤然上升,较播种时增加了5倍之多;随后几个月的表达水平则大幅下降,与刚播种时差异不明显。
2.3 ZoWRKY1表达量与6-姜酚含量增量的相关性分析
经测定,stage 1~stage 6竹根姜样品中6-姜酚含量分别为182.37、498.47、528.56、486.70、478.14、489.34 μg/g。采用IBM SPSS Statistics18.0统计软件对ZoWRKY1基因的表达量与6-姜酚含量增量进行了相关性分析,结果显示,ZoWRKY1基因的表达与6-姜酚含量相关系数为0.831 (P=0.040<0.05)。由此推测,竹根姜ZoWRKY1基因的表达水平与6-姜酚含量呈正相关关系。
2.4 ZoWRKY1及6-姜酚合成途径酶基因在NaCl胁迫下的表达
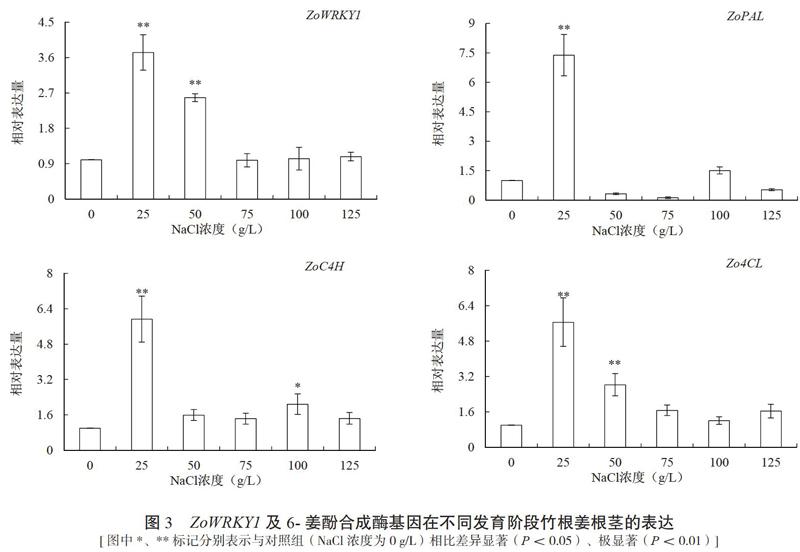
以不同浓度NaCl处理的竹根姜根茎cDNA为模板进行ZoWRKY1基因以及6-姜酚合成途径酶基因ZoPAL、ZoC4H和Zo4CL的qRT-PCR分析,结果如图3所示,以0 g/L NaCl胁迫处理为对照组,当NaCl胁迫浓度为25、50 g/L时,ZoWRKY1基因表达量迅速增加,分别上调了2.73、1.58倍;但随着NaCl浓度的继续增加,ZoWRKY1基因的表达量又回落至对照组水平。而6-姜酚合成途径相关酶基因ZoPAL、ZoC4H和Zo4CL 的表达量均在低盐浓度(25 g/L)胁迫下高度表达,且与对照组差异极显著。
进一步采用IBM SPSS Statistics18.0统计软件对6-姜酚生物合成途径相关酶基因与ZoWRKY1的表达量进行了相关性分析,结果显示,ZoC4H与Zo4CL基因的表达与ZoWRKY1相关系数分别为0.842(P=0.036<0.05)和0.965(P=0.002<0.01),均表现出显著相关性;而ZoPAL基因的表达与ZoWRKY1的相关系数为0.794(P=0.059>0.05),并未表现出显著相关性。由此推测生姜ZoWRKY基因与ZoC4H与Zo4CL的表达存在正相关关系。
3 结论与讨论
转录因子基因工程技术是开展植物次生代谢遗传改良的有效途径,相比于合成酶基因,转录因子对次生代谢的调控能力更全面、更显著,也更具改良前景。近年来相继发现多个转录因子家族参与植物次生代谢产物的调控,WRKY转录因子是其中的研究热点之一。
该研究克隆到一个可能与生姜6-姜酚合成存在重要调控关系的WRKY转录因子ZoWRKY1。qRT-PCR及相关性分析结果显示,ZoWRKY1的表达水平在竹根姜发育的第二阶段,即播种后一个月左右高度上调(图2),且与6-姜酚含量增量存在显著的相关性。由此推测6-姜酚的合成存在阶段特异性,即播种一个月左右大量合成,在后期发育阶段少量合成并逐渐积累。理论上讲“姜是老的辣”,如果姜辣素是生姜主要的辣味物质,那么随着生姜的生长发育其姜辣素含量应逐渐增加;在生長发育早期,根茎辣味不浓,即姜辣素含量应该不高。然而该研究发现,6-姜酚在竹根姜发育早期大量合成,说明6-姜酚虽然是竹根姜药用核心成分,但可能并非决定其辛辣程度的唯一指标,推测竹根姜辛辣物质为其他姜辣素成分。
盐胁迫是影响作物最常见的非生物胁迫之一。在25 g/L NaCl胁迫下,ZoWRKY1在根茎中高表达,说明ZoWRKY1参与生姜的耐低盐逆境应答,这与前人研究报道的WRKY转录因子参与植物抗逆反应相一致[26-27]。结合ZoWRKY1的表达与6-姜酚含量增量存在显著的相关性结果,推测在低浓度盐胁迫下ZoWRKY1的表达增加与6-姜酚的生物合成有关,而采用25或50 g/L NaCl胁迫处理可诱导6-姜酚合成酶基因ZoPAL、ZoC4H和Zo4CL高度上调表达(图3)则进一步验证了这个猜想。6-姜酚生物合成途径相关酶基因与ZoWRKY1的表达量相关性分析结果显示,ZoWRKY1与ZoC4H和Zo4CL的表达存在显著相关性,推测ZoWRKY1与ZoC4H及Zo4CL基因存在调控关系并进一步影响6-姜酚的生物合成,但还需试验进一步证实。
综上所述,该研究克隆到竹根姜WRKY转录因子基因ZoWRKY1,并发现该基因受低盐逆境胁迫诱导高度上调表达;ZoWRKY1与6-姜酚生物合成酶基因ZoC4H和Zo4CL的表达存在显著相关性,推测ZoWRKY1可能与6-姜酚生物合成存在重要调控关系。
参考文献:
[1] Weng C J,Wu C F,Huang H W,et al. Anti-invasion effects of 6-shogaol and 6-gingerol,two active components in ginger,on human hepatocarcinoma cells[J]. Molecular Nutrition & Food Research,2010,54(11):1618-1627.
[2] Chakraborty D,Mukherjee A,Sikdar S,et al. [6]-Gingerol isolated from ginger attenuates sodium arsenite induced oxidative stress and plays a corrective role in improving insulin signaling in mice[J]. Toxicology Letters,2012,210(1):34-43.
[3] Li Y L,Xu B,Xu M,et al. 6-Gingerol protects intestinal barrier from ischemia/ reperfusion-induced damage via inhibition of p38 MAPK to NF-κB signalling[J]. Pharmacological Research,2017,119:137-148.
[4] Abolaji A O,Ojo M,Afolabi T T,et al. Protective properties of 6-gingerol-rich fraction from Zingiber officinale (Ginger) on chlorpyrifos-induced oxidative damage and inflammation in the brain,ovary and uterus of rats[J]. Chemico-Biological interactions,2017,270:15-23.
[5] Ramirez-Ahumada M D C,Timmermann B N,Gang D R. Biosynthesis of curcuminoids and gingerols in turmeric(Curcuma longa)and ginger(Zingiber officinale):Identification of curcuminoid synthase and hydroxycinnamoyl-CoA thioesterases[J]. Phytochemistry,2006,67(18):2017-2029.
[6] Koo H J,McDowell E T,Ma X Q,et al. Ginger and turmeric expressed sequence tags identify signature genes for rhizome identity and development and the biosynthesis of curcuminoids,gingerols and terpenoids[J]. BMC Plant Biology,2013,13:27.
[7] Hao G P,Du X H,Zhao F X,et al. Role of nitric oxide in UV-B-induced activation of PAL and stimulation of flavonoid biosynthesis in Ginkgo biloba callus[J]. Plant Cell Tissue and Organ Culture,2009,97(2):175-185.
[8] Nadernejad N,Ahmadimoghadam A,Hosseinifard J,et al. Evaluation of PAL activity,phenolic and flavonoid contents in three pistachio(Pistacia vera L.)cultivars grafted onto three different rootstocks[J]. Journal of Stress Physiology & Biochemistry,2013,9(3):84-97.
[9] Liu W,Zhu D W,Liu D H,et al. Comparative metabolic activity related to flavonoid synthesis in leaves and flowers of Chrysanthemum morifolium in response to K deficiency[J]. Plant Soil,2010,335:325-337.
[10] Sykes R W,Gjersing E L,Foutz K,et al. Down-regulation of p-coumaroyl quinate/shikimate 3′-hydroxylase (C3′ H) and cinnamate 4-hydroxylase (C4H) genes in the lignin biosynthetic pathway of Eucalyptus urophylla ×E. grandis leads to improved sugar release[J]. Biotechnology for Biofuels,2015,8(1):128.
[11] 何慕涵,蘇文华,张光飞,等. 不同地区短葶飞蓬总黄酮含量与PAL和4CL酶活性的比较[J]. 中国农学通报,2012,28(25):179-183.
[12] Ata N,Yusuf N A,Tan B C,et al. Expression profiles of flavonoid-related gene,4 coumarate:coenzyme A ligase,and optimization of culturing conditions for the selected flavonoid production in Boesenbergia rotunda[J]. Plant Cell Tissue and Organ Culture,2015,123(1):47-55.
[13] Rastogi S,Dwivedi U N. Manipulation of lignin in plants with special reference to O-methyltransferase [J]. Plant Science,2008,174(3):264-277.
[14] Chen F,Dixon R A. Lignin modification improves fermentable sugar yields for biofuel production[J]. Nature Biotechnology,2007,25(7):759-761.
[15] Guillaumie S,Mzid R,Méchin V,et al. The grapevine transcription factor WRKY2 influences the lignin pathway and xylem development in tobacco [J]. Plant Molecular Biology,2010,72(1/2):215-234.
[16] He H S,Dong Q,Shao Y H,et al. Genome-wide survey and characterization of the WRKY gene family in Populus trichocarpa[J]. Plant Cell Reports,2012,31(7):1199-1217.
[17] Naoumkina M A,He X Z,Dixon R A. Elicitor-induced transcription factors for metabolic reprogramming of secondary metabolism in Medicago truncatula[J]. BMC Plant Biology,2008,8:132.
[18] Pavy N,Boyle B,Nelson C,et al. Identification of conserved core xylem gene sets:conifer cDNA microarray development,transcript profiling and computational analyses[J]. New Phytologist,2008,180(4):766-786.
[19] Grunewald W,De Smet I,Lewis D R,et al. Transcription factor WRKY23 assists auxin distribution patterns during Arabidopsis root development through local control on flavonol biosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(5):1554-1559.
[20] Amato A,Cavallini E,Zenoni S,et al. A grapevine TTG2-like WRKY transcription factor is involved in regulating vacuolar transport and flavonoid biosynthesis[J]. Frontiers in Plant Science,2017,7:1979. DOI:10.3389/fpls.2016.01979.
[21] Wang N, Liu W J, Zhang T L,et al. Transcriptomic analysis of red-fleshed apples reveals the novel role of MdWRKY11 in flavonoid and anthocyanin biosynthesis[J]. Journal of Agricultural and Food Chemistry,2018,66(27):7076-7086.
[22] Deavours B E,Dixon R A. Metabolic engineering of isoflavonoid biosynthesis in alfalfa[J]. Plant Physiology,2005,138(4):2245-2259.
[23] 廖欽洪,邹 勇,李洪雷,等. 基于RNA-seq数据的生姜NAC转录因子家族鉴定及分析[J]. 中国中药杂志,2018,43(3):493-501.
[24] 刘 燃,任 云,周 弦,等. 生姜新品种渝姜1号农艺性状及品质和抗病鉴定[J]. 湖南农业科学,2019(7):72-74.
[25] 钟书淳. 姜黄4CL和CURS基因的克隆与功能分析[D]. 泉州:华侨大学,2015.
[26] Qiu Y,Yu D. Over-expression of the stress-induced OsWRKY45 enhances disease resistance and drought tolerance in Arabidopsis[J]. Environmental and Experimental Botany,2009,65(1):35-47.
[27] Pandey S P,Somssich I E. The role of WRKY transcription factors in plant immunity:figure 1 [J]. Plant Physiology,2009,150(4):1648-1655.
(责任编辑:成 平)
