石墨热分解CaSO4反应机理研究
2020-12-21赵亮
赵 亮
(1.中国科学院 工程热物理研究所,北京 100190;2.中国科学院大学,北京 100049)
0 引 言
循环流化床锅炉通常采用炉内直接喷射石灰石的炉内脱硫方法来控制烟气中的SO2排放[1-2]。在炉内脱硫过程中,循环流化床炉膛密相区的焦炭(C)与固硫产物(CaSO4)在高温下会发生反应[3],由于该反应导致CaSO4分解,从而会直接影响循环流化床炉内固硫效率[4]。此外,C与CaSO4的反应也被广泛应用于工业生产过程中磷石膏的分解[5-6]。因此,有学者对循环流化床炉内脱硫、磷石膏和脱硫石膏分解过程中涉及的反应机理开展了大量研究[7-10]。燕春培等[11]通过试验和热力学计算,认为C热分解CaSO4的反应过程主要包括C与CaSO4生成CaS、C与CaSO4生成CaO、以及CaSO4与CaS生成CaO。Lindgren等[12]通过热重试验分析C和CaSO4·2H2O、石膏、磷石膏反应,证实在750~1 080 ℃ 生成了CaS。肖海平等[13]在研究不同气氛下CaSO4的分解特性时发现,纯CaSO4在温度达到1 200 ℃ 或更高时会发生自分解反应,研究还发现氧气的存在使CaSO4更加稳定,而在还原性气下,CaSO4开始分解的温度会有所降低。
上述关于C热分解CaSO4过程中主要反应温度区间仍未明确,且各反应的优先级也没有统一定论[14]。目前,大多数研究仅采用热重分析方法,对于揭示反应机理具有一定的局限性。因此,本文基于热重质谱的试验数据,通过等效特征图谱法(ECSA)对石墨热分解CaSO4的详细反应过程进行解析。同时,采用水平管式炉开展石墨热分解CaSO4的试验研究,通过表征不同试验过程中获得的固体产物组分,明确石墨热分解硫酸钙的具体反应机理。
1 试 验
1.1 试验样品
试验采用的纯硫酸钙来自国药集团化学试剂有限公司,状态呈现为白色微带浅灰色粉末,质量分数≥97%,样品粒径≤150 μm。还采用阿拉丁公司生产的高纯度石墨粉,状态为黑色带光泽粉末,纯度≥99.9%,样品粒径≤150 μm。
1.2 试验装置
1.2.1热重质谱试验
热重质谱试验系统由Netzsch同步TG-DSC热分析仪STA449F3 Jupiter及QMS403C四极质谱仪2部分组成。试验样品在热重分析仪炉内发生热反应,反应过程中逸出气体通过载气进入质谱仪,热重分析仪和对应的质谱仪协同工作。试验过程中,随温度变化,二者分别记录样品质量变化和逸出的离子流强度[15-16],通过离子流的质核比作为特征值表征气体组分,得到的数据通过ECSA解析出来,最终可得到不同组分气体的实时质量流量。
ECSA是基于TG-MS工作原理,通过建立逸出气体和载气之间的联系,变换计算出不同组分逸出气体的质量流量。该方法不受试验过程和试验条件的影响,适用于各种反应类型的逸出气体[17]。作为一种定性定量的质谱数据分析方法,与传统方法相比,ECSA受操作条件制约很小,处理过程稳定可靠,实现了质谱信号的精确定量分析,利用标定参数解析获取的质谱信号,还可以得到标准状态下逸出气体不同组分的实时流量,验证试验过程中测试分析数据的准确性。
1.2.2水平管式炉试验
热重质谱试验通过反应过程中样品的质量变化和逸出气体流量推断反应过程中各温度区间可能发生的反应,但由于其反应物的量极少,无法对其反应后产物进行定性和定量分析。因此,本文在热重质谱试验的基础上,利用水平管式炉试验台获得样品,采用X射线衍射分析(XRD)定性分析反应产物中所含物质,从而推定反应过程,进而研究整个过程的反应机理。
水平管式炉试验系统主要由管式炉加热系统、流量监测系统、抽真空系统、配气及排气管路系统、送样系统、数据采集系统等六大部分组成,如图1所示。

图1 水平管式炉试验系统
样品表征仪器为D8 Advance X-ray diffraction X射线衍射分析仪,具体测试参数:Cu靶,管流40 mA,管压40 kV,角度5°~90°。测试结果通过Jade软件解析,得到反应后产物中的主要物相组成。
1.3 试验过程
1.3.1热重质谱试验
热重质谱试验编号及对应条件见表1。
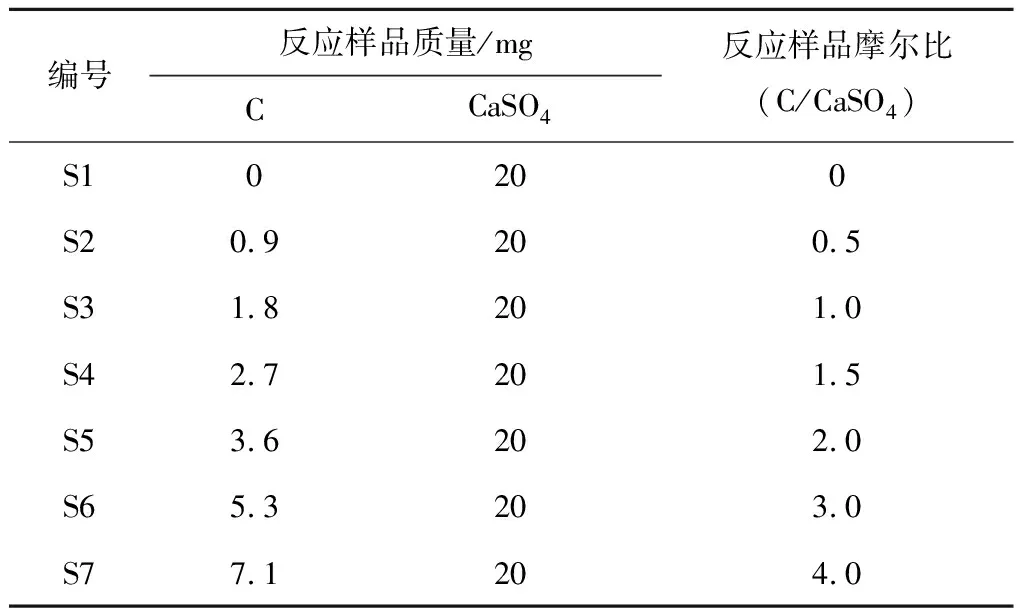
表1 热重质谱试验编号及对应条件
试验过程中,取出2个空白氧化铝坩埚在热重分析仪内进行清零操作,将每组试验样品按摩尔比搅拌混合均匀,在分析天平上称取对应质量的样品,放置在热重分析仪其中一个坩埚内,关闭炉体,通过计算机软件对仪器参数进行设置。为保证炉内气氛不受环境影响,连续对炉内进行2次抽真空操作,同时充入保护气Ar,载气流量设定为100 mL/min,升温速率为10 ℃/min,炉内升温至1 200 ℃后保温,直至TG曲线不再发生变化时结束。
1.3.2水平管式炉试验
水平管式炉试验条件见表2。
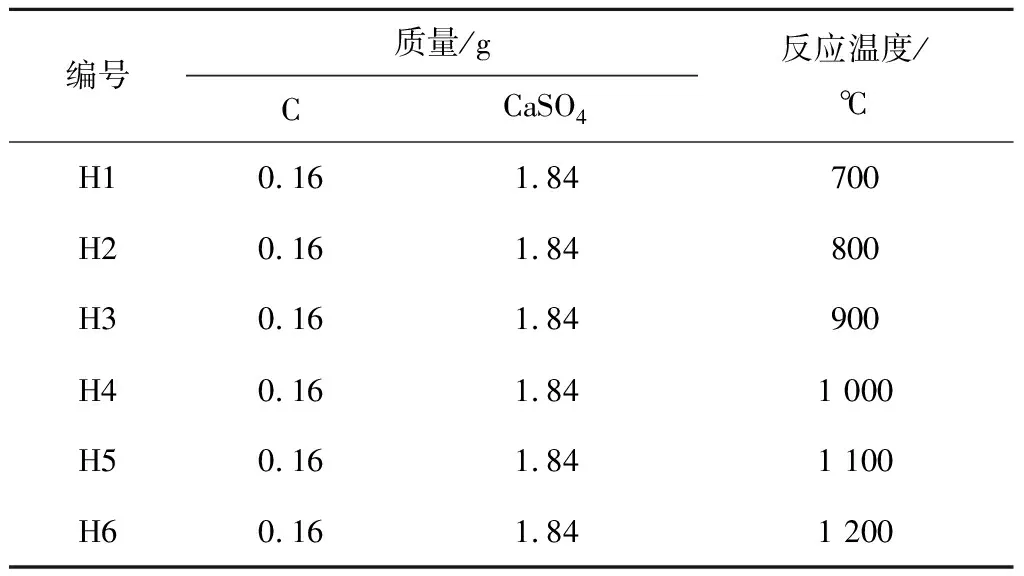
表2 水平管式炉试验编号及对应条件
除反应温度外,各组试验所有条件保持一致。提前将石墨和CaSO4粉末混合均匀,每次取2 g样品置于刚玉舟中,利用送样推杆,将刚玉舟推送至水平管式炉中心保温区。加热前,避免炉内残留气体的影响,先接通N2,流量为6 L/min,通入10 min后加热,加热时间为15 min,且整个过程中均通入N2以保证炉内气氛,加热至反应温度后保温30 min,结束后停止加热,将样品在干燥环境下冷却至室温后进行XRD测试。
2 结果与讨论
2.1 反应方程
根据文献调研以及试验研究发现,高温条件下CaSO4的自分解反应,以及C热分解CaSO4的反应方程式为:

(1)

(2)

(3)

(4)
2.2 热重质谱试验
热重质谱试验的TG和DTG曲线如图2所示。将各试验CaSO4开始分解的温度、完全失重的时间以及最大分解速率的数据进行对比分析,结果如图3所示。
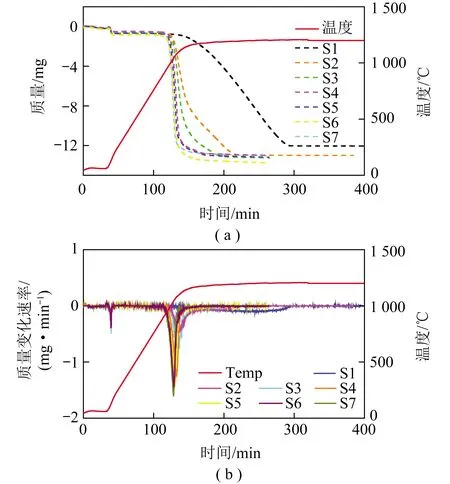
图2 热重质谱试验的TG和DTG曲线
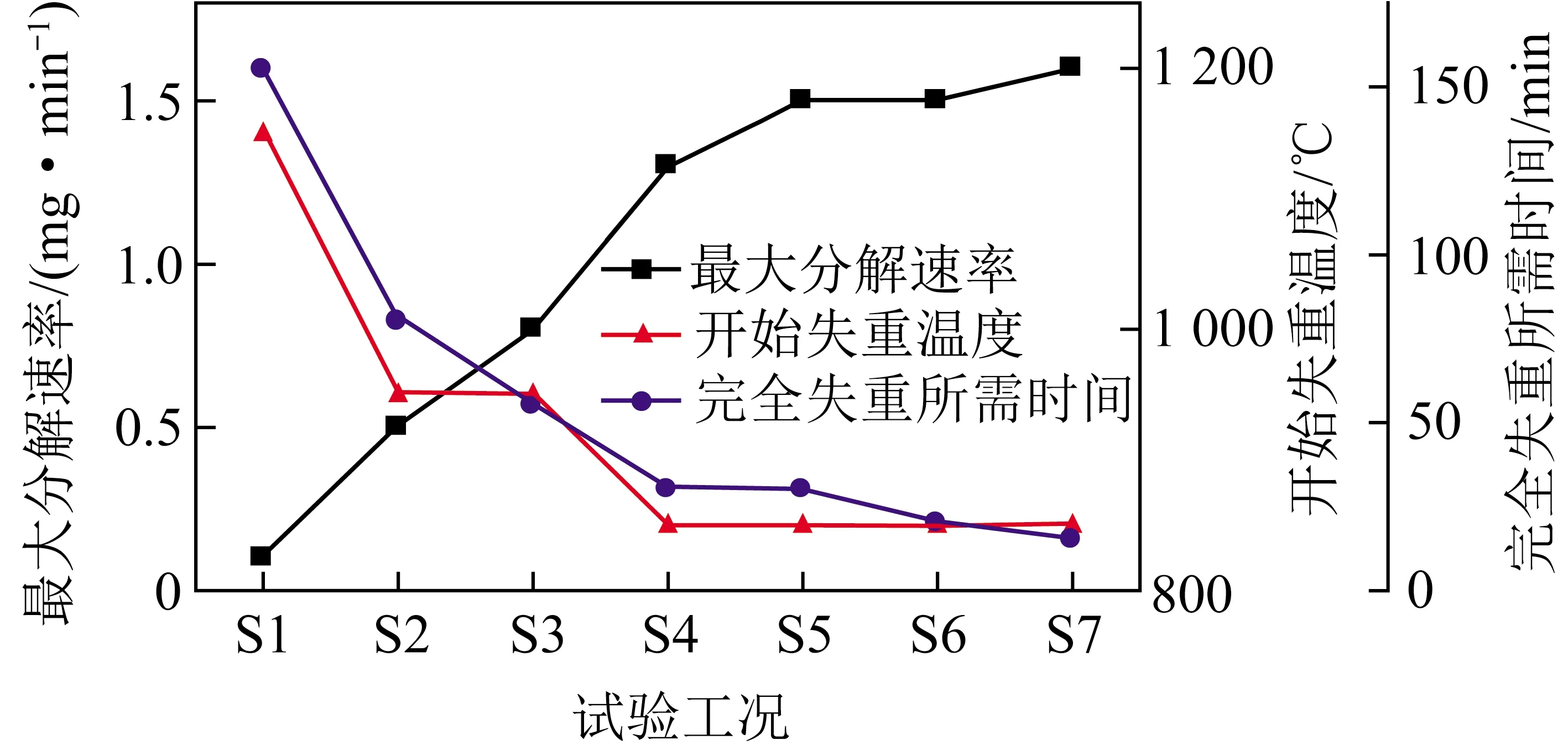
图3 热重质谱试验参数对比
由图2可知,石墨对CaSO4分解过程起关键作用。对比加入极少量石墨的S2试验和未加入石墨的S1试验的TG和DTG曲线可见:S2试验中开始失重的温度从S1的1 100 ℃降至950 ℃,CaSO4最大分解速率从S1的0.1 mg/min增大到0.5 mg/min,完全失重的时间从S1的155 min缩短到80 min。
由图3可知,CaSO4的开始失重温度随石墨含量的增加而降低,当石墨含量达到S4比例后,初始失重温度和完全失重时间趋于平稳;石墨含量增加,CaSO4最大分解速率随之增加,在S7中最大分解速率达到1.56 mg/min。
由图2(b)可知,除S1试验外,其余试验的最大失重速率均发生在1 050 ℃左右。表明只要添加石墨,DTG显示的最大质量变化速率都在1 050 ℃左右,但由于过程中可能存在多个反应,而仅凭TG和DTG曲线并不能判断具体的反应,更无法判断每个反应对失重曲线的贡献比重,无法解释详细的反应机理,因此还需通过ECSA进行进一步研究。
2.3 等效特征图谱法分析
利用ECSA可得到逸出气体质量流量随着时间的变化规律,为更好地解释各组分之间的化学反应关系,将经过ECSA得到的原始质量流量通过式(5)转变成摩尔流量,再经过比对摩尔流量之间的关系分析具体反应机理。
(5)
式中,Qm(i)为气体的质量流量,mg/min;M(i)为气体的摩尔质量,g/mol;n(i)为气体的摩尔流量,mmol/min。
试验数据经上述处理后得到流量曲线,如图4所示。其中在S1结果中加入2倍O2流量辅助曲线,在S2~S7结果中加入2倍CO2的流量辅助曲线。
由图4(a)可知,未加入石墨的情况下,SO2与O2几乎同时逸出,且整个过程仅有这2种气体,流量曲线上呈现SO2与O2为2倍关系,推断在S1试验中发生了CaSO4的自分解反应,即反应(1),且仅发生该反应。
由图4(b)~(g)可知,各工况下,首先逸出少量CO2气体,SO2和O2没有出现,说明这段时间只发生反应(2)。虽然C与CaSO4摩尔比不同,但CO2均从约600 ℃开始逸出,气体逸出量很小,说明此时其反应程度很小,并受温度的影响不大。

图4 热重质谱试验逸出气体的流量曲线
900 ℃后,SO2开始逸出,且SO2流量曲线和2倍CO2流量曲线在集中反应区域几乎重合,两者逸出时间几乎相同。由此推断,该过程主要发生了反应(3)。同时发现,在反应后期,2条曲线逐渐发生偏离,重合度下降,S2试验中,SO2流量曲线高于CO2的2倍流量曲线,且伴有O2逸出。虽然S2试验中加入的石墨与CaSO4反应物摩尔比为反应(3)中两物质的反应系数比,但由于反应未充分进行,残余的CaSO4又进入了反应(1)的自分解的温度区间,自分解生成的O2未能被剩余极少量的C捕捉而被载气带出了反应器,导致O2逸出。但在S3~S7试验中,由于石墨与CaSO4的摩尔比进一步增加,石墨热分解CaSO4反应完全,因此未发生CaSO4自分解反应。
在S3~S7试验中,CO2流量曲线在2条曲线分离后仍持续逸出了一小段时间。推断在该过程中发生了其他反应,且从分离点向后延续的过程中没有O2产生,同时根据文献中反应温度区间[7,9,18],该反应只可能为反应(2),但由于CaSO4在前面反应中已大量消耗,判断该部分反应虽可能发生,但进行程度非常小。
2.4 水平管式炉试验
为更好判断石墨热分解CaSO4的反应进程,在水平管式炉中进行了石墨与CaSO4粉末的反应,并将不同工况下的产物冷却,进行XRD测试,分析图谱结果如图5所示。
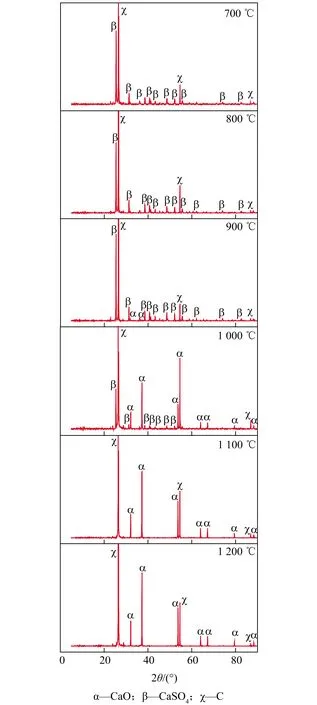
图5 水平管式炉试验的XRD分析图谱
由图5可知,水平管式炉试验反应产物中均未检测到CaS,而同时检测到大量CaO生成,验证了石墨与CaSO4反应时主要发生反应(2)。该反应开始的标志是SO2生成。通过热重质谱试验得到SO2的逸出流量曲线,如图6所示。

图6 热重质谱试验的SO2逸出流量曲线
由图5、6可知,反应(3)的初始反应温度在900 ℃左右,随着反应样品摩尔比的增加,起始反应温度略有降低,从S2的930 ℃降至S7的871 ℃;样品的XRD表征结果显示,在700 ℃和800 ℃的反应产物只有CaSO4和石墨,在900 ℃中则检测到CaO。由之前分析可知,CaSO4自分解在1 100 ℃左右发生,可推定CaO由CaSO4被石墨热分解产生,且随着温度升高,CaO含量逐渐增多。900~1 000 ℃,CaSO4峰值逐渐变得很小,说明CaSO4不断被反应消耗而生成了CaO。在1 100 ℃和1 200 ℃的XRD图谱中没有CaSO4,说明此时CaSO4已经完全分解。
另外,在热重质谱试验中没有检测到CaS的峰,说明在反应产物中没有CaS生成,或生成含量极少被石墨的峰值干扰[19],或冷却过程中经过反应(4)被转化[8,11]。说明反应后期反应(3)的优先级远大于反应(2)。
3 结 论
1)采用热重质谱试验和水平管式炉试验,用等效特征图谱法(ECSA)和XRD表征反应产物中的气体产物和固体产物,对石墨热分解CaSO4的反应机理进行研究。CaSO4在1 100 ℃会发生自分解反应,石墨的加入大幅降低CaSO4的初始分解温度,增大最快分解速率,缩短完全失重时间。
2)添加石墨后,CaSO4发生最大分解速率的温度在1 050 ℃左右,其最大分解速率对应的温度与石墨的添加量无关。
3)随着石墨摩尔比的增加,CaSO4分解的最大反应速率逐渐增大,起始分解的温度逐渐降低并趋于稳定。
4)在石墨与CaSO4反应过程中,CaSO4分解生成CO2、SO2和CaO的反应是最主要的反应,约在900 ℃时开始发生。温度超过1 100 ℃时,石墨与CaSO4之间可能发生生成CaS和CO2的反应,但其进行程度很小。
