茶多酚、柠檬醛、肉桂醛对四种接触表面蜡样芽孢杆菌菌膜的影响研究
2020-12-21夏俊芳王苹马瑶马金花古丽娜孜武运
夏俊芳,王苹,马瑶,马金花,古丽娜孜,武运
(新疆农业大学 食品科学与药学学院,乌鲁木齐 830052)
蜡样芽孢杆菌(Bacilluscereus,简称B.cereus)广泛分布在土壤环境中并污染多种食品,包括大米、香料、干制品、蔬菜、蛋品、肉制品以及乳制品等由此而引发相关食物中毒情况[1]。B.cereus是与引起食物中毒密切相关的食源性致病菌之一,该菌具有产生多种毒素的能力,从而引起腹泻和呕吐等胃肠道疾病,严重时还会造成其他病原的机会性感染从而引发败血症、肺炎和脑膜炎等疾病[2]。另外,由于B.cereus是革兰氏阳性菌且可产生芽孢,可通过形成菌膜而在贫营养条件下存活,与浮游细胞相比,细菌菌膜对清洗过程具有很高的抵抗力,这是食品工业高度关注的问题[3]。
菌膜是由单细胞生物聚集附着在固体表面(如聚苯乙烯、玻璃和不锈钢)而形成的生物活性基质,包括胞外多糖(EPS)、蛋白质、脂质和DNA等[4]。菌膜对盐浓度、干燥、高温、抗生素和其他食品防腐剂具有高度的耐受性[5]。已有研究报道,微生物可通过形成复杂的菌膜结构,使其对机械损伤的抵抗力增加数千倍[6]。最近的研究表明,提取的天然物质可有效抑制食源性致病菌及其菌膜,Lou等[7]从牛蒡叶中分离和富集抗菌膜成分可以显著改善菌膜抑制;Vazquez等[8]研究发现0.8 mmol/L槲皮素可有效阻止不锈钢表面单核细胞增生李斯特氏菌菌膜的形成;Cui等[9]研究发现丁香油脂质体具有持久的抗菌作用,能有效去除蔬菜表面的大肠杆菌O157∶H7菌膜,延长货架期;在亚致死浓度下,芦丁能显著抑制食源性耐药大肠杆菌和金黄色葡萄球菌形成的混合菌膜[10]。
很多研究表明从天然植物中提取的茶多酚、肉桂醛、柠檬醛具有抑菌防腐等作用。茶多酚是一种以茶中提取的天然化合物,具有广泛的生物活性,可用于天然食品防腐剂和抗氧化剂。史梅莓等[11]研究酱卤肉在冻藏过程中的稳定性,发现添加0.3‰红曲红色素与0.3 g/kg茶多酚的产品在贮藏期的色泽效果最好;茶多酚的氧化产物茶色素对蛋白质具有鳌合作用,可成为天然的食用色素,朱建勇等[12]在卤制液中添加多种茶叶卤制鸡蛋,结果表明添加红茶制得的茶卤蛋品质最好。茶多酚也可抑制大多数食源性病原体的生长,例如粘质沙雷氏菌、铜绿假单胞菌、大肠杆菌、鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌和金黄色葡萄球菌等[13]。常云鹏等[14]研究发现茶多酚对红酸汤中产酸微生物有较强的抑制作用,肉桂醛(3-苯基-2-丙烯醛)是肉桂精油的主要成分之一,天然存在于肉桂属肉桂树的树皮和叶子中,已被美国食品和药物管理局(FDA)允许用于食品中,全世界每年在食品工业中使用的肉桂醛总量大约为1.8×105kg,其中95%用于调味品,且使用量有逐年递增的趋势[15],肉桂醛充满浓郁的桂皮香气和辛香气,且香气持久,在涉及香精、香料的行业可直接用作原香料和定香剂,是可乐、薄荷、杏仁等香型饮料中必不可少的香原料之一[16]且可以抑制多种菌膜,包括鼠伤寒沙门氏菌[17]、金黄色葡萄球菌[18]、空肠弯曲杆菌及大肠杆菌[19]。柠檬醛(C10H16O)是柠檬草精油、山苍子油、柑橘类叶油的主要成分,是FDA公认的安全调味物质,柠檬醛是合成维生素A、紫罗兰酮、大马酮等高级香料的主要原料[20],对金黄色葡萄球菌、大肠杆菌、单核细胞增生李斯特氏菌等均有良好的抑菌活性[21]。但此3种物质对B.cereus及其菌膜形成的影响的研究甚少,本研究利用试管法确定茶多酚、柠檬醛、肉桂醛对B.cereus的最小抑菌浓度,采用超声波平板菌落计数法测定在亚抑菌浓度下对不同接触表面B.cereus的菌膜清除能力,为茶多酚、柠檬醛、肉桂醛的进一步研究和开发利用提供了一定的理论指导。
1 材料与方法
1.1 材料与仪器
蜡样芽孢杆菌(B.cereus,CMCC63303):上海理工大学医疗器械与食品学院微生物实验室;营养琼脂培养基、LB肉汤:北京陆桥生物技术有限公司;山梨酸钾、苯甲酸钠、氯化钠、葡萄糖、硫酸、氢氧化钠等分析纯:天津市盛淼精细化工有限公司;二甲基砜(DMSO):天津市恒兴化学试剂制造有限公司;不锈钢(SS,食品级304,规格10 mm×10 mm):深圳市华昌五金模具有限公司;聚氯乙烯(PVC,规格10 mm×10 mm)及聚丙烯(PPR,规格10 mm×10 mm):深圳海诺塑胶有限公司;玻璃片(Glass,规格10 mm×10 mm):盐城市飞舟玻塑有限公司;肉桂醛、柠檬醛、茶多酚:上海弘顺生物科技有限公司。
SK2200H 超声波清洗器 上海科导超声仪器有限公司;FE20 Plus pH计 上海梅特勒-托利多仪器有限公司;LDZX-40SCI 型高压灭菌锅 上海早安医疗器械厂;LHS-150SC恒温培养箱 上海森信试验仪器有限公司;FA2104N 电子天平 上海民桥精密科学仪器有限公司。
1.2 实验方法
1.2.1 菌悬液的制备
将B.cereus菌株用LB肉汤于30 ℃培养18 h后取1 mL纯菌液,用无菌蒸馏水依次稀释10-1~10-7倍共7个浓度梯度(依次标记为1~7号)。取1~7号梯度菌液1 mL加入15 mL融化并冷却到45 ℃左右的无菌营养琼脂培养基,凝固后于30 ℃恒温培养箱内培养24 h后进行平板计数,1~7号梯度菌液计数结果分别为2.3×108~2.3×102CFU/mL,于4 ℃冰箱中贮存备用。
1.2.2 载体的清洗
将载体材料不锈钢片(SS)、聚氯乙烯片(PVC)、聚丙烯片(PPR)、玻璃片(Glass)用洗涤剂清洗,置于丙酮中超声15 min,除去表面油脂,再用蒸馏水冲洗干净后置于75%的乙醇浸泡30 min,用蒸馏水冲净,烘干后灭菌备用。然后放入装有10 mL LB肉汤的15 mm×150 mm试管中,灭菌备用。
1.2.3 菌膜的培养
将10 mL LB肉汤和载体片(均已灭菌)放入灭菌培养皿中,接入0.1%的1.0×108CFU/mLB.cereus菌悬液,混合均匀,于30 ℃培养,前期实验得出B.cereus菌膜培养24 h[22]。
1.2.4B.cereus菌膜活菌计数
前处理及超声:去除培养24 h菌膜的培养液,用无菌磷酸缓冲溶液反复冲洗,洗去浮游菌,再取10 mL无菌磷酸缓冲液加入到试管中,并用超声波清洗仪(振荡频率为45 Hz)处理15 min。稀释及培养:从经过超声波清洗仪处理后的试管中吸取1 mL菌液,沿管壁慢慢注入含有9 mL无菌水的试管内,摇匀,梯度稀释后制成10-3、10-4、10-5稀释度的菌悬液,各取1 mL,分别加入培养皿内(每个稀释度做3个培养皿),再向培养皿中倾注约15 mL融化并冷却到45 ℃左右的无菌营养琼脂培养基,冷凝后,于30 ℃恒温培养箱内培养24 h后取出,进行活菌计数。
总菌落数/cm2=(同一稀释度3个平皿上的菌落平均数×稀释倍数×10)/载体片的面积。
1.2.5 3种天然物质浓度制备
各种浓度天然物质的制备:采用二倍稀释法[23],0.5%二甲基亚砜(DMSO)稀释成茶多酚浓度为0.12,0.24,0.48,0.96,1.92,3.84,7.68 mg/mL,肉桂醛浓度为0.05,0.10,0.20,0.40,0.80,1.60,3.20 mg/mL,柠檬醛浓度为0.00125,0.0025,0.005,0.01,0.02,0.04,0.08 mg/mL,用试管振荡器混匀、备用。
1.2.6 最小抑菌浓度(MIC)的测定
将1.2.1制备的108CFU/mL菌悬液0.1 mL,分别加入到1.2.5不同浓度的天然物质稀释液中摇匀并在分光光度计600 nm波长下测定各1.2.5稀释液初始吸光值,然后在水浴锅中30 ℃培养24 h,在600 nm波长下记录吸光值,吸光值与初始吸光值相同的稀释液试管则为最低抑菌浓度MIC。
1.2.7 不同浓度的茶多酚对B.cereus菌膜活菌数的影响
4种载体材料分别放入含有茶多酚浓度为1/8 MIC、1/4 MIC、1/2 MIC、MIC的10 mL LB肉汤管中,高压灭菌冷却后加入0.1 mL 108CFU/mLB.cereus菌悬液,在30 ℃条件下培养24 h进行菌膜活菌数的测定,以不加茶多酚的试管做对照。
1.2.8 不同浓度的柠檬醛对B.cereus菌膜活菌数的影响
4种载体材料分别放入含有柠檬醛的浓度为1/8 MIC、1/4 MIC、1/2 MIC、MIC的10 mL LB肉汤管中,高压灭菌冷却后加入0.1 mL 108CFU/mLB.cereus菌悬液,在30 ℃条件下培养24 h进行菌膜活菌数的测定,以不加柠檬醛的试管做对照。
1.2.9 不同浓度的肉桂醛对B.cereus菌膜活菌数的影响
4种载体材料分别放入含有肉桂醛浓度为1/8 MIC、1/4 MIC、1/2 MIC、MIC浓度的10 mL LB肉汤管中,高压灭菌冷却后加入0.1 mL 108CFU/mLB.cereus菌悬液,在30 ℃条件下培养24 h进行菌膜活菌数的测定,以不加肉桂醛的试管做对照。
1.3 数据处理
每个实验重复3次,数据统计分析采用 Statistix 8.1(分析软件,St Paul,MN) 软件包中 Linear Models程序,差异显著性(P<0.05)分析使用 Tukey HSD程序,采用Excel 2016整理实验数据,作图。
2 结果与讨论
2.1 茶多酚、柠檬醛、肉桂醛的最小抑菌浓度(MIC)
3种物质对B.cereus的MIC值见表1。

表1 茶多酚、柠檬醛、肉桂醛对B. cereus 的最小抑菌浓度Table 1 The MIC of tea polyphenols, citral and cinnamaldehyde against B. cereus
由表1可知,茶多酚对B.cereus的MIC为0.96 mg/mL,柠檬醛对B.cereus的MIC为0.10 mg/mL,肉桂醛对B.cereus的MIC为0.04 mg/mL。
茶多酚抑菌机理通过抑制酶活性或清除自由基来显示抗菌活性[24],茶多酚作用于菌体细胞后,可以破坏细胞壁的完整性,使碱性磷酸酶渗出,从而使细胞膜的通透性增加,导致代谢发生紊乱,起到抑菌作用。柠檬醛抑菌机理是该物质会吞噬细胞膜,形成可渗透的孔道,导致细胞内容物渗漏,最终导致细胞死亡[25]。Shi等[26]研究发现柠檬醛会改变阪崎肠杆菌的细胞内pH值、膜完整性、电位和细胞内ATP浓度;Wang等[27]研究发现柠檬醛导致假单胞菌细胞膜完整性降低,细胞器和细胞质破坏,以及化合物(尤其是磷脂、蛋白质和脂肪酸)的显著差异。肉桂醛抑菌机理是抑制与胞质分裂相关的关键酶并破坏细菌的细胞膜,通过影响细菌细胞膜上脂肪酸的分布和连接,以及抑制细胞膜上的酶活性,调控细胞膜的流动性,增强其渗透作用[28],使胞内物质外渗导致细菌死亡。
2.2 不同浓度的茶多酚对4种接触面B. cereus菌膜形成的影响
菌膜形成的关键步骤包括细胞附着、聚集、定植、分化和成熟,4种不同材质表面菌膜形成情况为:玻璃(Glass)>不锈钢(SS)>聚氯乙烯(PVC)>聚丙烯(PPR)(P<0.05),亲水性介质更有利于B.cereus菌膜的生成[29]。当茶多酚浓度在0.12~0.96 mg/mL范围内,0.5% DMSO没有明显抑制成熟的B.cereus菌膜生物量(P>0.05),茶多酚处理对24 h菌膜形成的影响见图1。
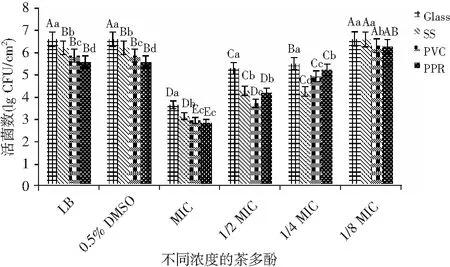
图1 不同浓度的茶多酚对B. cereus 菌膜形成的影响Fig.1 The effect of different concentration of tea polyphenols on the formation of B. cereus biofilm
在茶多酚MIC浓度为0.96 mg/mL时,菌膜形成量最大程度地减少,整体来看,随着茶多酚浓度的增加,4种材质表面菌膜形成量逐渐减少,这表明与未处理的对照相比,茶多酚处理对B.cereus菌膜形成具有显著的负面影响。在玻璃材质表面,1/4 MIC茶多酚浓度时菌膜形成量较对照降低了1.11 lg CFU/cm2、1/2 MIC茶多酚浓度时菌膜形成量较对照降低了1.32 lg CFU/cm2,MIC茶多酚浓度时菌膜形成量较对照降低了2.97 lg CFU/cm2(P<0.05),表明亚抑菌浓度茶多酚对玻璃表面B.cereus菌膜形成量起到抑制作用;在不锈钢表面,茶多酚的亚抑菌浓度(1/4 MIC~MIC)显示菌膜形成量减少了1.97,1.93,3.08 lg CFU/cm2。其中1/2 MIC茶多酚菌膜形成量与1/4 MIC茶多酚菌膜形成量无明显差异(P>0.05);在PVC表面,茶多酚的亚抑菌浓度(1/4 MIC~MIC)抑制浓度显示菌膜生物量减少了0.93,2.16,2.94 lg CFU/cm2;在PPR材质表面,茶多酚的亚抑菌浓度(1/4 MIC~MIC)显示菌膜形成量减少了0.35,1.39,2.74 lg CFU/cm2。当茶多酚浓度为0.12 mg/mL时(即1/8 MIC),与不添加茶多酚对照组相比,在不锈钢、塑料材质表面菌膜形成量无明显差异(P>0.05),在玻璃表面1/8 MIC茶多酚浓度时,B.cereus菌膜形成量高于对照组菌膜形成量(P<0.05)。其中1/8 MIC在4种材料表面菌膜形成量高于对照组菌膜形成量,表明亚抑菌浓度的茶多酚对细菌的代谢具有一定抑制作用,但B.cereus仍然能够生长,表明亚抑菌浓度的茶多酚增加了细菌生长的困难性,但也可能刺激细菌产生更多的菌膜来抵抗和适应这种不利条件,这是细菌借助菌膜增强自身的适应性和抵抗性的结果[30]。
2.3 不同浓度的柠檬醛对4种接触面B. cereus菌膜形成的影响
当柠檬醛浓度在0.00125~0.01 mg/mL范围内,0.5% DMSO没有明显抑制成熟的B.cereus菌膜生物量(P>0.05),柠檬醛处理对24 h菌膜形成的影响见图2。

图2 不同浓度的柠檬醛对B. cereus菌膜形成的影响Fig.2 The effect of different concentration of citral on the formation of B. cereus biofilm
整体来看,随着柠檬醛浓度的增加,4种材质表面菌膜形成量逐渐减少,在玻璃、不锈钢、PVC、PPR材质表面,1/8 MIC柠檬醛浓度时菌膜形成量较对照降低了0.86,0.64,0.25,0.06 lg CFU/cm2,1/4 MIC柠檬醛浓度时菌膜形成量较对照降低了2.34,1.77,1.35,1.13 lg CFU/cm2,1/2 MIC柠檬醛浓度时菌膜形成量较对照降低了3.97,3.28,2.83,2.02 lg CFU/cm2,MIC柠檬醛浓度时菌膜形成量较对照降低了4.07,3.73,3.75,3.37 lg CFU/cm2,表明亚抑菌浓度柠檬醛对不同材质表面B.cereus菌膜形成起抑制作用且不同材料表面菌膜形成量不同,这与Sun等[31]研究的亚抑菌浓度柠檬醛对副溶血性弧菌菌膜抑制的作用类似,随着浓度的增大,抑制菌膜作用增强。
2.4 不同浓度的肉桂醛对4种接触面B. cereus菌膜形成的影响
当肉桂醛浓度在0.005~0.04 mg/mL范围内,0.5% DMSO没有明显抑制成熟的B.cereus菌膜生物量(P>0.05),肉桂醛处理对24 h菌膜形成的影响见图3。
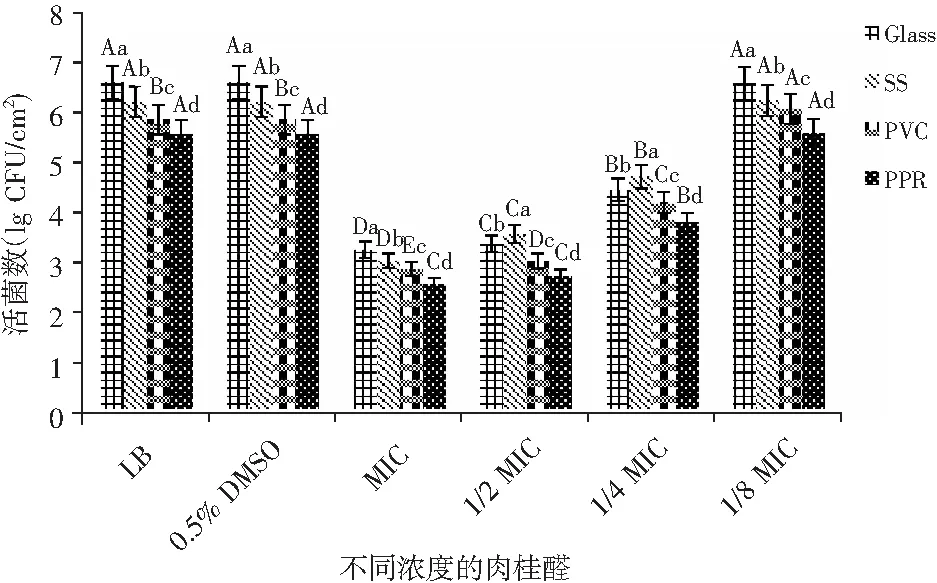
图3 不同浓度的肉桂醛对B. cereus菌膜形成的影响Fig.3 The effect of different concentration of cinnamaldehyde on the formation of B. cereus biofilm
整体来看,随着肉桂醛浓度的增加,4种材质表面(玻璃、不锈钢、PVC、PPR)菌膜形成量逐渐减少,1/4 MIC肉桂醛浓度时菌膜形成量较对照降低了2.14,1.49,1.65,1.76 lg CFU/cm2,1/2 MIC肉桂醛浓度时菌膜形成量较对照降低了3.22,2.64,2.83,2.84 lg CFU/cm2,MIC肉桂醛浓度时菌膜形成量较对照降低了3.34,3.17,2.98,3.00 lg CFU/cm2,表明亚抑菌肉桂醛浓度下对B.cereus菌膜具有较强的抑制和清除能力,而添加1/8 MIC肉桂醛浓度的4种材质表面菌膜形成量与对照无明显差异,这可能是低浓度肉桂醛对菌膜形成不是抑制所用反而是促进作用,这与Liu等[32]研究的肉桂醛对大肠杆菌、金黄色葡萄球菌菌膜的抑制情况类似,另一方面可能的原因是细菌细胞在最初附着于非生物表面时的粘附主要取决于细菌细胞的理化性质[33],自聚性和疏水性对于定殖和菌膜的形成非常重要[34]。添加肉桂醛后减弱菌株的自聚性而抑制了菌膜的形成,从材质表面菌膜减少程度来分析,亲水材质(玻璃)上菌膜减少量最多,这可能是因为添加肉桂醛改变了表面的疏水性质,使得B.cereus菌体不易附着,还需后续通过疏水性实验来证实。
2.5 茶多酚、柠檬醛、肉桂醛MIC浓度下对B.cereus菌膜清除效果
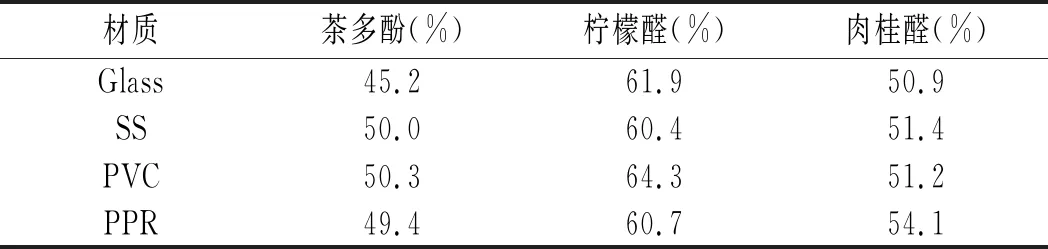
表2 茶多酚、柠檬醛、肉桂醛对B.cereus菌膜的清除效果Table 2 The scavenging effect of tea polyphenols, citral, cinnamaldehyde against B. cereus biofilm
由表2可知,在相应的MIC浓度下,4种材质表面B.cereus菌膜的清除效果为柠檬醛>肉桂醛>茶多酚(P<0.05)。柠檬醛浓度为0.10 mg/mL时,4种材质表面形成B.cereus菌膜清除能力为:聚氯乙烯(PVC)>玻璃(Glass)>聚丙烯(PPR)>不锈钢(SS);肉桂醛浓度在0.04 mg/mL范围内,4种材质表面形成B.cereus菌膜清除能力为:聚丙烯(PPR)>不锈钢(SS)>聚氯乙烯(PVC)>玻璃(Glass);茶多酚浓度在0.96 mg/mL范围内,4种材质表面形成B.cereus菌膜清除能力为:聚氯乙烯(PVC)>不锈钢(SS)>聚丙烯(PPR)>玻璃(Glass)。整体来看,在疏水材料表面菌膜清除能力高于亲水材料,这可能是因为在疏水材料表面菌膜附着能力较差,加入相应浓度的天然物质其清除能力强。
3 结论与讨论
在食品加工过程中,菌膜被认为占所有微生物污染的80%,菌膜是造成设备损坏、能源成本增加、食品腐败和疾病的原因[35]。每个食品企业都进行日常清洁和消毒,以防止细菌在食品接触面定殖或滞留。化学抗菌剂,包括氯、过氧化氢和过氧乙酸,已经广泛使用多年。然而,这些方法并不总是对菌膜控制有效,因为在清洁和消毒之后,仍然可以在设备表面发现残留的微生物,特别是在去除表面形成的顽固细菌菌膜方面[36]。更严重的是,消毒剂的连续和不当使用可能有利于菌膜的形成和耐受性而不是消除菌膜[37]。多项研究表明天然提取物质可用于菌膜抑制,茶多酚、柠檬醛和肉桂醛等多种天然化合物可抑制食源性病原体形成菌膜[38]。因此,具有抗菌膜作用的天然提取物质对保障食品安全具有重要意义,本研究选择具有较强菌膜形成能力的B.cereus来评估茶多酚、肉桂醛、柠檬醛在4种材质表面的抗菌膜作用。结果表明:不同材质表面菌膜形成及清除能力不同,因此通过改变物理化学性质(如表面涂层)来修饰,有望成为食品工业中防止菌膜形成的新方法[39]。茶多酚对B.cereus的MIC为0.96 mg/mL,柠檬醛对B.cereus的MIC为0.10 mg/mL,肉桂醛对B.cereus的MIC为0.04 mg/mL。在亚抑菌浓度下,茶多酚、柠檬醛、肉桂醛在4种材料表面均有抑制B.cereus菌膜形成的作用,当3种物质在低浓度时,对B.cereus菌膜的形成没有完全抑制,表明高浓度的茶多酚、柠檬醛、肉桂醛主要通过抑制细菌生长以减少B.cereus菌膜的产生,尤其肉桂醛和茶多酚在低浓度(1/8 MIC)时对菌膜反而产生促进作用,很可能是细菌在遇到外界环境压力时做出的一种群体性的防御反应,而当浓度不断提高时,菌膜形成也受到影响,这可能与菌膜的相关基因或蛋白功能的破坏密切相关。在本研究中,在相应的MIC浓度下作用24 h,柠檬醛对4种材质表面B.cereus菌膜的清除作用最大(抑制率高达60.4%),3种物质对菌膜清除效果为柠檬醛>肉桂醛>茶多酚(P<0.05),茶多酚、柠檬醛、肉桂醛常被用于调味料和保鲜防腐剂,可作为食用香料和食品添加剂,因此有望将柠檬醛、肉桂醛、茶多酚作为控制食源性病原体菌膜形成的策略。
