长白猪PPARα、PPARγ 基因的克隆、表达及生物信息学分析
2020-12-21郭振清李红强
郭振清,李红强,孙 健
(河北科技师范学院农学与生物科技学院,河北昌黎 066600)
白色脂肪组织主要以储存能量为主,而棕色脂肪主要以消耗能量和产生热量为主[1]。研究发现脂肪组织形成的起始阶段、分化阶段和成熟阶段受到各种转录因子调控,其中PPAR 家族蛋白在各阶段发挥重要作用[2]。PPAR 家族属于配体激活类转录因子,可被细胞内游离脂肪酸和脂肪酸代谢物等多种配体激活[3-4],PPAR 蛋白与靶基因启动子的特异靶向元件序列结合,随后与类维生素A 受体形成异源二聚体驱动生理或病理条件下基因的表达[5-6]。PPAR 家族蛋白调控特异性靶基因的表达[7],参与脂代谢、葡萄糖稳态、肥胖、癌症、炎症和动脉粥样硬化等生物学过程[8-9],该家族有PPARα、PPARβ/δ和PPARγ3 个成员,其在不同的组织中表达。PPARα主要在脂肪酸氧化率较高的组织中表达,如肝脏、心脏、肌肉和棕色脂肪组织等[10],参与游离脂肪酸激活和延伸及去饱和、甘油三酯及脂滴的合成与分解、载脂蛋白代谢、糖异生和胆汁酸代谢等多种生物学过程。PPARβ/δ主要在肌肉中高表达,其次为脂肪组织和皮肤。PPARγ主要在脂肪组织中高表达[11-12],在调节脂肪细胞分化、脂质生成和代谢方面具有十分重要的作用,其在炎症反应中也发挥重要作用[2]。
目前对于该家族的研究主要集中在小鼠[13-14],而以猪为对象的研究较少。猪肉品质(多汁性、风味、柔软程度)与脂肪沉积紧密相关[15],如何改善脂肪沉积一直是育种工作者的重要目标。本研究通过构建长白猪PPARα、PPARγ真核表达载体并对其进行生物信息学和组织表达规律分析,为进一步揭示PPARs在猪中的作用提供理论基础。
1 材料与方法
1.1 实验材料 本实验选择6 月龄去势长白公猪,来自河北省秦皇岛市昌黎县肉联厂,采集长白猪新鲜心脏、肝脏、脾脏、肺脏、肾脏、腿肌、颈阔肌、肱二头肌、皮下脂肪、胃、小肠和空肠12 种组织样品,样品采集后迅速置于液氮中,以备后续实验使用,所有样品均在-80℃低温保存。
1.2 主要试剂 Trizol、PCR 相关试剂、RNA 反转录试剂盒、pMD18-T Vector、感受态细胞DH5α和DL2000 DNA Ladder 购自北京索莱宝生物科技有限公司;普通琼脂糖凝胶回收试剂盒(美国Omega 公司);DEPC、Goldenview 型核酸染色剂购自北京拜尔迪生物科技有限公司;AceQ qPCR SYBR Green Master Mix 试剂盒(南京诺唯赞生物科技有限公司);普通PCR 仪(ABI17500,美国ABI 公司);定量PCR 仪(赛默飞世尔,美国);电泳仪(DYY-4C 型,北京市六一仪器厂)。
1.3 实验方法
1.3.1 引物设计和合成 参考GenBank 数据库中猪PPARα(登录号:NM_001044526),PPARγ(登录号:NM_214379.1)序列,使用Primer 5.0 软件设计引物[16](表1)并由北京天一辉远生物科技有限公司合成。
1.3.2 总RNA 提取和反转录 取适量组织加入到预冷的2 mL EP 管中,随后加入1 mL 的Trizol 试剂,使用组织破碎仪(70.0 HZ,20 s)连续破碎5 次后加入200 mL氯仿,随后12 000 r/min 低温离心15 min;将上层液体移至新EP 管中并加等体积异丙醇,混匀后放置10 min,12 000 r/min 低温离心15 min;将上层液体弃去留下底部沉淀,加入1 mL 75%乙醇,重复该过程,最后加20 μL DEPC 水溶解总RNA,并用反转录试剂盒将提取的总RNA 反转录成cDNA,方法参照试剂盒说明书。
1.3.3 基因扩增 以cDNA 为模板,利用上述引物(表1)通过PCR 技术扩增长白猪PPARα、PPARγ基因。PCR反应总体系为10 µL:5 µL 2×Taq Master Mix、100 ng/μL模板1 µL、上下游引物(10 pmol/L)各0.5 µL、3 µL H2O。PCR 扩增程序:95℃预变性5 min;95℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃,5 min;20℃,5 min。将PCR 回收产物与pMD18-T 载体连接,连接体系为10 µL:目的片段6 µL,载体2 µL,Buffer 1 µL 和pMD18-T 连接酶1 µL,16 ℃连接过夜后转化至DH5α感受态细胞,挑取单克隆菌株并进行PCR 鉴定。以上述重组载体为模板利用PCR 技术克隆基因CDS 序列,与pcDNA3.1 载体相连,随后转化至DH5α感受态细胞,最后挑取单菌落并送至生工生物工程(上海)股份有限公司测序。
1.3.4 生物信息学分析 采用表2 中的各种工具对长白猪PPARα、PPARγ对应序列进行生物信息学分析。PPARα、PPARγ物种类型分别为人(Homo sapien)、猕猴(Macaca mulatta)、小鼠(Mus musculus)、猪(Sus scrofa)、牛(Bos tauru)、山羊(Capra hircu)、绿头鸭(Anas platyrhynchos)、鸡(Gallus gallus)。
1.3.5 基因组织表达分析 以12 种组织的cDNA 为模板,使用定量PCR 引物序列(表1),参照TAKARA SYBR®Premix Ex TaqTMII 试剂盒进行荧光定量PCR 检测基因在各组织中的表达量。PCR 反应体系20 μL:SYBRqPCR Mix 10 μL,cDNA 2 μL,上、下游引物(10 pmol/L)各0.4 μL,ROX Reference Dye2 0.4 μL,去离子水6.8 μL。PCR 反应条件:预变性95℃ 5 min;循环反应,95℃10 s,60℃ 30 s,共40 个循环。采用GAPDH为内参校正个体间差异,利用2-△△Ct方法计算长白猪PPARα和PPARγ在各组织中的相对表达量,并使用GraphPad Prism5 软件[19]将表达量进行单因素方差分析。

表1 PCR 引物序列信息

表2 生物信息学软件[17-18]
2 结果
2.1 长白猪PPARα、PPARγ基因的扩增 由图1-A 可知,与DNA Ladder Marker 相比,1、2 泳道条带均处于1 000~2 000 bp,PPARα序列长度为1 407 bp,PPARγ序列长度为1 515 bp,扩增片段大小与理论产物一致。将扩增产物与载体连接并转化至感受态细胞,挑取单菌落并提取质粒,使用PCR 技术检测质粒并经琼脂糖凝胶电泳检测(图1-B),发现构建好的载体大小于预期相符合,经生工生物工程(上海)股份有限公司测序获得核苷酸序列与NCBI 数据库公布的序列一致。
2.2 生物信息学分析
2.2.1 蛋白质的一级结构 分析长白猪PPARα基本理化性质显示,编码468 个氨基酸,其分子量为52.17 ku,理论等电点为5.77,含有亮氨酸(Leu)个数为49,比例最高,为10.5%,而色氨酸(Trp)个数为1,比例最低,为0.2%,其分子式为C2308H3654N618O695S31,总原子数目为7306。PPARγ编码504 个氨基酸,分子量为57.51 ku,理论等电点为5.60,其中亮氨酸(Leu)比例最高,为10.5%,而色氨酸(Trp)比例最低,为0.2%,含有负电荷氨基酸残基的数目为71,含有正电荷的氨基酸残基数目为58,其分子式为C2575H4046N670O766S27,总原子数量为8 084。
2.2.2 蛋白质二级结构预测 长白猪PPARα二级结果分析显示,α螺旋、无规卷曲、伸展链和β转角分别占48.93%、35.90%、10.68%和4.49%。长白猪PPARγ二级结构分析显示,α螺旋、无规卷曲、伸展链和β转角分别占比为46.63%、34.92%、12.30%和6.15%。该结果显示这2 种蛋白α螺旋和无规卷曲是其主要结构。
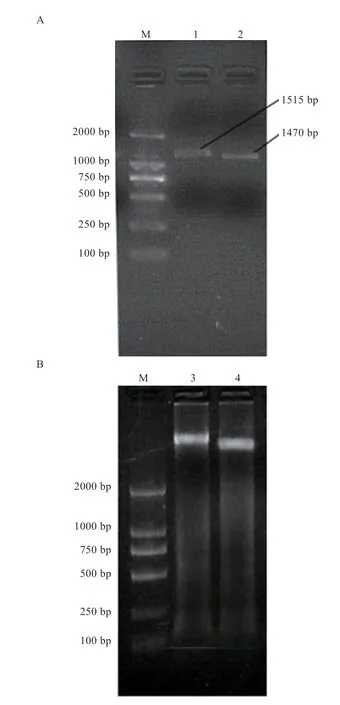
图1 长白猪PPARα 和PPARγ 基因的PCR 扩增结果
2.2.3 蛋白质跨膜结构域和疏水性预测 跨膜结构域分析结果显示,PPARα蛋白不含有TMHs,同样PPARγ预测发现其TMHs 数量为0,推测这2 种蛋白均不含有跨膜结构域。亲疏水性算法认为大于0.5 的区域为疏水区,小于-0.5 的区域为亲水区,在-0.5~0.5 的区域为两亲区域。结果显示长白猪PPARα亲疏水性的最小值为-3.078,最大值为2.933,亲水性区域大于疏水性区域,因此推测该蛋白为亲水性蛋白。长白猪PPARγ亲疏水性分析发现,最小值为-2.789,最大值为3.6,亲水性区域大于疏水性区域,因此推测该蛋白为亲水性蛋白。
2.2.4 蛋白质磷酸化位点预测 磷酸化位点通常在苏氨酸(Thr)、丝氨酸(Ser)和赖氨酸(Tyr)3 个氨基酸残基上。预测结果显示,长白猪PPARα共有45 个磷酸化位点,其中苏氨酸残基上有15 个,分别位于4、52、71、82、129、190、200、253、279、283、285、288、307、438、450 氨基酸残基;丝氨酸残基上有25个,分别位于6、12、21、24、38、40、45、46、48、50、59、63、66、73、76、77、80、93、110、142、163、179、205、293、346 氨基酸残基;赖氨酸残基上有5 个,分别位于54、83、314、464、468 氨基酸残基。同样方法预测到50 个PPARγ磷酸化位点,其中苏氨酸残基上有14 个,分别位于 4、19、29、33、40、65、74、165、256、265、268、269、324、343 氨基酸残基;丝氨酸残基上有27 个,分别位于 8、14、25、45、50、56、58、70、71、103、111、116、185、225、226、235、248、252、272、281、359、369、382、409、421、456、491 氨基酸残基;赖氨酸残基上有9个,分别位于77、101、115、150、249、326、354、500、504 氨基酸残基。糖基化位点修饰分为两种,即O 端和N 端糖基化位点,利用在线软件NetOGlyc3.1和NetNGlyc1.0 分析O 端和N 端糖基化位点发现,长白猪PPARα共有14 个O 端糖基化位点,分别位于4、63、69、71、73、76、80、82、93、95、196、179、234 氨基酸残基,没有检测到N 端糖基化位点,长白猪PPARγ共有18 个O 端糖基化位点分别位于14、19、25、29、71、103、111、116、119、130、203、235、248、265、268、269、272 和295 氨基酸残基,检测到23 位氨基酸残基处有1 个N 端糖基化位点。
2.2.5 蛋白质三级结构预测 对长白猪的PPARα、PPARγ编码蛋白质的三级结构进行建模(图2),可以看出2种蛋白的三级结构总体十分相似,但2 种蛋白的氨基酸总数存在区别,在三级结构也存在不同,文中用红色标记出两者的不同。从三级结构中发现2 种蛋白α螺旋和无规卷曲占比例较高,与二级结构预测的结果一致。PPARα在99~173 位氨基酸残基为DNA 结合结构域,PPARγ的135~209 位氨基酸残基为DNA 结合结构域,两者该结构域相似性82.67%。PPARα在239~466 位氨基酸残基为配体结合结构域,PPARγ的237~502 位氨基酸残基为配体结合结构域,两者该结构域相似性64.04%。
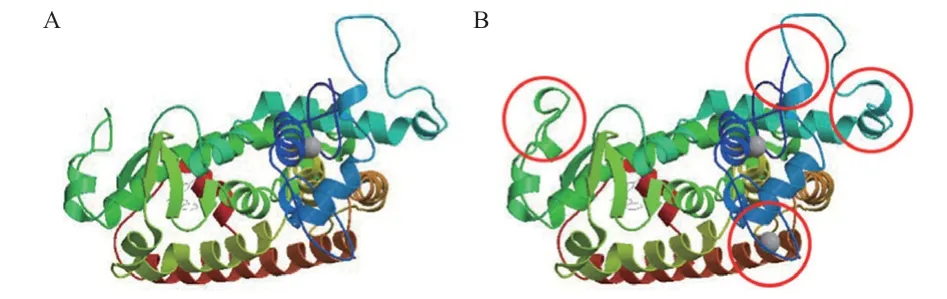
图2 长白猪PPARα 和PPARγ 蛋白质三级结构预测
2.2.6 长白猪与其他物种系统进化树构建 对8 个物种的PPARα、PPARγ蛋白质氨基酸序列进行同源性比较,并建立系统进化树。如图3-A 显示,猪的PPARα蛋白质氨基酸序列与牛和山羊的亲缘关系较近,其次为小鼠和人,与绿头鸭和鸡的亲缘关系最远,山羊、牛和猪同属于偶蹄目,由此说明该蛋白在进化过程中较为保守。PPARγ蛋白质氨基酸序列的亲缘关系与PPARα不同,猪的该蛋白与人、猕猴和小鼠的亲缘关系较近,与山羊和牛的亲缘关系次之,与绿头鸭和鸡的亲缘关系最远(图3-B),由于该蛋白的氨基酸序列在跨越不同的目和科,在保守性方面较PPARα差。
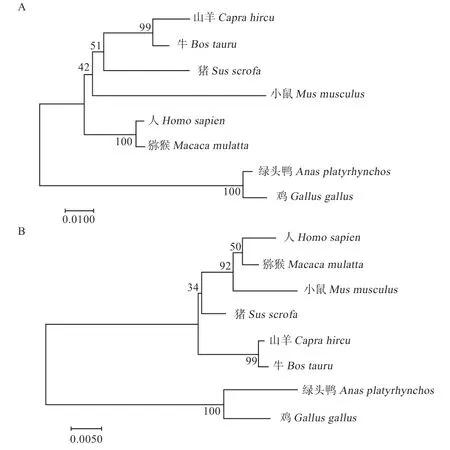
图3 长白猪PPARα 和PPARγ 与其他物种氨基酸系统进化树
将猪PPARα序列与其他各物种序列比较发现(图4),猪与牛的同源性最高,为94.9%,其次为山羊94.7%,与进化树关系所得结果一致。将猪PPARγ序列与其他各物种序列比较发现(图5),猪与人的同源性最高,为98.5%,其次为猕猴和小鼠,分别为98.2%、98.1%,与进化树关系所得结果一致。
2.3 长白猪PPARα、PPARγ基因的组织表达谱 如图6-A所示,PPARα在长白猪的肝脏中表达量最高,其次为肾脏、脂肪组织和胃,脾脏的表达量最低,该基因在这些组织的表达量较其他组织均达到差异极显著水平;其他各组织均有表达。由图6-B 可知,PPARγ在长白猪的脂肪组织中表达量最高,胃中表达量次之,该基因在这2种组织中表达量与其他组织达到极显著差异水平;其他各组织表达量较低且种间未达到差异极显著水平。

图4 不同物种PPARα 序列差别(下三角)和相似性(上三角)

图5 不同物种PPARγ 序列差别 (下三角) 和相似性 (上三角)
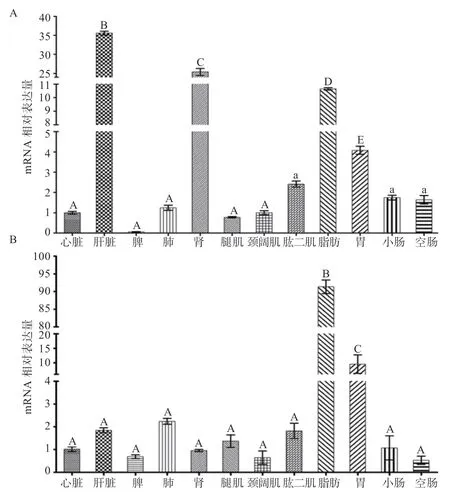
图6 长白猪PPARα 和PPARγ 基因在各组织中的表达量
3 讨 论
本研究成功克隆了长白猪的PPARα、PPARγ基因,测序PPARα基因CDS 区全长为1 407 bp,编码468 个氨基酸;PPARγ基因CDS 区全长1 515 bp,编码504个氨基酸,克隆得到的序列与GenBank 数据库中的猪PPARα、PPARγ序列一致。通过亲缘关系分析,发现PPARα、PPARγ的保守性都很强,该结果与在广西巴马小型猪中研究结论一致[20]。目前对不同品种猪中这2种基因有效遗传变异位点的研究尚未报道,在后续的研究中通过扩大样品量筛选有效的遗传标记,为猪育种工作提供依据。
对两基因序列进行生物信息学分析的结果显示,长白猪PPARα、PPARγ2 种蛋白二级结构以α螺旋和无规卷曲为主,与三级结构预测结果一致。这2 种蛋白均不含有跨膜结构域,为亲水性蛋白,该预测结果与2 种蛋白作为转录因子调控特异性基因的转录表达相符合,因为它们发挥功能时首先转移至细胞核,而非与膜结构相结,同时对其保守结构域分析发现,长白猪PPARα、PPARγ均由DNA 结合结构域和配体结合结构域,且同源性较高。PPAR 属于核受体家族成员,其活性受到多种翻译后修饰,包括磷酸化、糖基化、泛素化和类泛素化等多种形式[21-22]。本研究在蛋白质翻译后修饰预测中也发现2 种蛋白含有多个磷酸化位点和一些糖基化位点。
本研究采集了长白猪12 个不同部位的组织样品,通过qT-PCR 技术检测PPARα、PPARγ的表达量,发现PPARα基因在肝脏中高表达。饶辽源等[23]研究证明PPARα主要在山羊的肾脏和肝脏中表达较高。另有报道PPARα在不同品种猪、不同周龄猪的肝脏组织表达水平存在差异[21],提示该基因存在物种差异和时序性。本研究发现,PPARγ基因在脂肪组织中表达量最高,这与江口萝卜猪、从江香猪和八眉猪各组织中PPARγ基因表达量的结果一致[24-25],且随着喂养月龄的不同呈上升趋势,但广西巴马小型猪发现PPARγ基因在大肠组织中表达量最高[20],该结果表明PPARγ基因在不同的猪品种之间存在表达差异,可能与广西小型猪特殊的形体有关。另外,在不同冷刺激下PPARγ基因表达量也有不同[26],提示该基因能量平衡方面具有重要作用。同时,张青青等[27]在黄牛中的研究结果也显示,在脂肪组织分化的不同时间点PPARγ基因的表达量不同,这些数据说明该基因在脂肪组织中具有重要功能。
4 结 论
本研究成功克隆了长白猪PPARα和PPARγ的CDS序列,其核苷酸序列长度分别为1 407 bp 和1 515 bp,随后构建了真核表达载体;2 种蛋白主要二级结构为α螺旋和无规卷曲,为亲水蛋白且保守性较强;PPARα在长白猪的肝脏中表达量最高,脾脏的表达量最低,PPARγ在长白猪的脂肪组织中表达量最高,胃中表达量次之,提示2 种基因在机体能量代谢方面发挥作用。
