肠道菌群介导动物胆汁酸FXR/TGR5 信号通路的研究进展
2020-12-21黎力之关玮琨张海波刘小高
刘 鑫,黎力之,关玮琨,张海波,刘小高
(宜春学院生命科学与资源环境学院,江西省高等学校硒农业工程技术研究中心,宜春市功能农业与生态环境重点实验室,江西宜春 336000)
肠道是动物机体微生物定植的主要器官,寄居着约100 万亿个细菌[1]。肠道菌群主要由拟杆菌门、厚壁菌门、放线菌门和变形菌门等组成,其平衡稳定对动物生理过程具有重要作用,如协助宿主物质和能量代谢、正向调节机体免疫功能及促进营养物质消化吸收[2-4]。营养物质在肠道通过细菌发酵产生大量代谢产物,包括短链脂肪酸(Short-chain Fatty Acids,SCFAs)、色氨酸代谢物和胆汁酸(Bile Acid,BA)等[5-7]。BA 是胆汁的有效成分之一,为肝脏胆固醇分解代谢的终产物,主要有2 种生物学功能。一方面,BA 是一类具有较强表面活性的两亲性甾醇类化合物,有助于肠道吸收脂溶性营养物质[8]。另一方面,BA 作为信号分子,通过激活法尼酯X 受体(Farnesoid X Receptor,FXR)和G 蛋白胆汁酸偶联受体5(Takeda G-protein-coupled Receptor 5,TGR5)等同源受体调控机体代谢[9]。BA 代谢及其相关通路与肠道菌群之间关系密切。肠道菌群产生的特异酶对跨膜转运至肠道后的BA 进行修饰并影响其代谢[7]。此外,肠道菌群还可激活或抑制FXR 和TGR5 等受体活性来调控BA 和葡萄糖代谢以及机体能量稳态等[9]。近年来,有关肠道菌群与BA 代谢的关系逐渐成为各领域研究的热点。本文综述了肠道菌群对BA 代谢及其相关信号通路的影响,进一步明确它们之间的关系,为解决动物炎症和代谢性疾病提供参考。
1 动物肠道菌群概述
1.1 影响动物肠道菌群的因素 肠道菌群在生命初期高度活跃,经历快速波动,随时间推移保持相对稳定。但抗生素和饮食等因素可引起肠道菌群的变化[10]。抗生素是抑制致病菌生长的常用药,但使用抗生素会干扰正常菌群定植,对动物健康产生不良影响。给小鼠灌服头孢曲松后,肠道内拟杆菌门数量显著降低,变形菌门和厚壁菌门丰富度升高,导致结肠上皮氧合增加,破坏肠道厌氧环境,使其功能发生紊乱[11]。此外,中药、益生菌和多酚化合物等饮食因素也可影响肠道菌群的种类和数量。Chen 等[12]以5-氟尿嘧啶诱导肠黏膜炎大鼠为研究对象,对其灌胃中药小蘖碱后,大鼠肠道梭菌属、普氏菌属和瘤胃球菌属数量上升,大肠杆菌和志贺氏杆菌明显减少,从而减轻了大鼠回肠炎症。作为常见益生菌,植物乳杆菌能增加仔猪结肠双歧杆菌属和普雷沃氏菌属丰度,通过调节微生物多样性促进肠道健康发育[13]。另外,多酚化合物对肠道细菌具有益生作用,如原花青素可增加肠道菌群(如拟杆菌门和放线菌门)数量,促进乳酸菌黏附于肠上皮细胞(Intestinal Epithelial Cells,IEC)[14]。
1.2 动物肠道菌群的功能 肠道菌群不仅在机体免疫和肠道屏障保护方面起重要作用,还可参与宿主代谢过程,对机体健康产生广泛影响[15-17]。有研究显示,拟杆菌属可增强动物免疫功能,在脆弱拟杆菌存在时,机体通过调节性T 细胞上的Toll 样受体2(Toll-like Receptor 2,TLR2)识别表面多糖后,诱导白细胞介素-10(Interleukin-10,IL-10)等细胞因子产生,影响辅助性T 淋巴细胞亚群1(T-helper Cell 1,Th1)/Th2 平衡,从而促进宿主免疫耐受[18]。肠道罗伊氏乳杆菌使仔猪回肠集合淋巴小结面积扩大,分化抗原簇3+T 细胞数量和血浆免疫球蛋白G 浓度均升高,同时该菌能促进IEC发育,维持肠黏膜屏障,有效抵御外来致病菌侵袭[19]。在代谢调节方面,肥胖个体肠道厚壁菌门/拟杆菌门比值增大,表明2 种优势菌群相对丰度与脂肪储存有关,并影响宿主能量代谢[4]。
1.3 动物肠道菌群代谢产物的功能 动物肠道菌群代谢物包括SCFAs、色氨酸代谢物和BA 等。SCFAs 由肠道细菌发酵非消化性碳水化合物而生成,具有降低肠腔pH 以抵御病原、为IEC 及微生物生长提供能量和减少结肠炎症发生等多种功能[5]。作为动物体内必需氨基酸,色氨酸经肠道菌群代谢产生色胺、吲哚及其衍生物,可维持IEC 完整性,并参与调节神经及脑肠轴[6]。BA 是一种对动物生长起着重要作用的肠道菌群代谢物,其分子内含有亲水和疏水性基团,一方面降低油-水界面张力,促进脂质和脂溶性维生素吸收[20]。Lai 等[21]研究发现在肉鸡日粮补充一定浓度的BA 可提高其脂肪酶活性,增加脂肪吸收,改善肉鸡生产性能。另一方面破坏细菌细胞膜完整性,导致其中内容物流出,引起细胞死亡,从而发挥BA 有效抑菌作用[22]。此外,BA 作为信号调节分子,通过激活其肠道及肝细胞中内源性受体介导的通路,实现动物机体脂质、葡萄糖和BA 代谢[9]。
2 BA 代谢及其相关信号通路
2.1 BA 代谢
2.1.1 BA 的合成 在肝细胞内,胆固醇通过滑面内质网上胆固醇7α-羟化酶(Cholesterol 7α-hydroxylase,CYP7A1)启动的中性(或经典)途径,以及线粒体内膜中甾醇27α-羟化酶(Sterol 27α-hydroxylase,CYP27A1)启动的酸性(或替代)途径,合成原发性BA,包括胆酸(Cholic Acid,CA)、鹅脱氧胆酸(Chenodeoxycholic Acid,CDCA)和鼠胆酸(Muricholic Acid,MCA)[23]。在酸性途径中,胆固醇在CYP27A1作用下生成27-羟化胆固醇,后经氧固醇7α-羟化酶催化等步骤生成CDCA[23]。CYP7A1 为BA 合成中性途径中的关键酶,在该途径中甾醇12α-羟化酶(Sterol 12α-hydroxylase,CYP8B1)是产生CA 的必需酶,其催化CDCA 转化为CA[24]。此后甘氨酸或牛磺酸与CA和CDCA 以酰胺键共轭形成结合型初级BA,再由胆盐输出泵(Bile Salt Export Pump,BSEP)转至胆小管,进入胆囊,经浓缩后存储[25]。
2.1.2 BA 的转运与肠肝循环 当机体进食后,营养物质刺激小肠黏膜分泌缩胆囊素,引起Oddi 括约肌舒张及胆囊平滑肌收缩,使胆汁流入十二指肠[25]。初级BA 在肠道菌群化学修饰下转变为次级BA,如石胆酸(Lithocholic Acid,LCA)和脱氧胆酸(Deoxycholic Acid,DCA)。约95%的BA 在回肠远端经肠绒毛刷状缘顶端钠依赖性胆酸转运体(Apical Sodium-dependent Bile Acid Transporter,ASBT)进入IEC,并与胞质内回肠胆汁酸结合蛋白(Ileum Bile Acid Binding Protein,IBABP)作用后运至基底外侧膜,在有机溶质转运蛋白参与下经门静脉流回肝窦,由Na+-牛磺胆酸盐转运多肽和有机阴离子转运肽介导进入肝细胞。重吸收的BA 经肝细胞改造后再随胆汁排入肠腔,完成BA 的肠肝循环[26]。
2.2 FXR 介导的BA 代谢信号通路 FXR 是配体激活转录因子家族成员之一,其介导的BA 信号通路通过肝脏和肠道2 条途径来调节体内BA 的代谢[27]。在肝脏途径中,经肠肝循环到达肝细胞的BA 刺激FXR 后,小异源二聚体伴侣受体(Small Heterodimer Partner,SHP)表达上调,进而与肝受体同系物1(Liver Receptor Homolog-1,LRH-1)和肝细胞核因子4α(Hepatocyte Nuclear Factor 4α,HNF4α)相互作用生成抑制性复合物,下调BA 合成酶CYP7A1和CYP8B1转录表达,实现BA 的反馈抑制调节[28]。在肠道途径中,初级BA 经BSEP 作用进入小肠,可激活回肠FXR,促进成纤维细胞生长因子15/19(Fibroblast Growth Factor 15/19,FGF15/19)生成和释放。肝实质细胞中FGF 受体4(Fibroblast Growth Factor Receptor 4,FGFR4)与其辅助受体βKlotho 蛋白结合形成βKlotho-FGFR4 复合物后,在硫酸乙酰肝素蛋白多糖参与下被FGF15/19 特异性激活。由此启动一系列跨膜受体酪氨酸激酶级联反应,进而触发细胞外调节蛋白激酶1/2(Extracellular Regulated Protein Kinase 1/2,ERK1/2)和c-Jun 氨基末端蛋白激酶(C-Jun N-terminal Protein Kainse,JNK)信号转导途径,两者通过磷酸化作用减弱中性途径限速酶CYP7A1转录表达,最终负反馈调节BA 自身合成(图1)[29-30]。
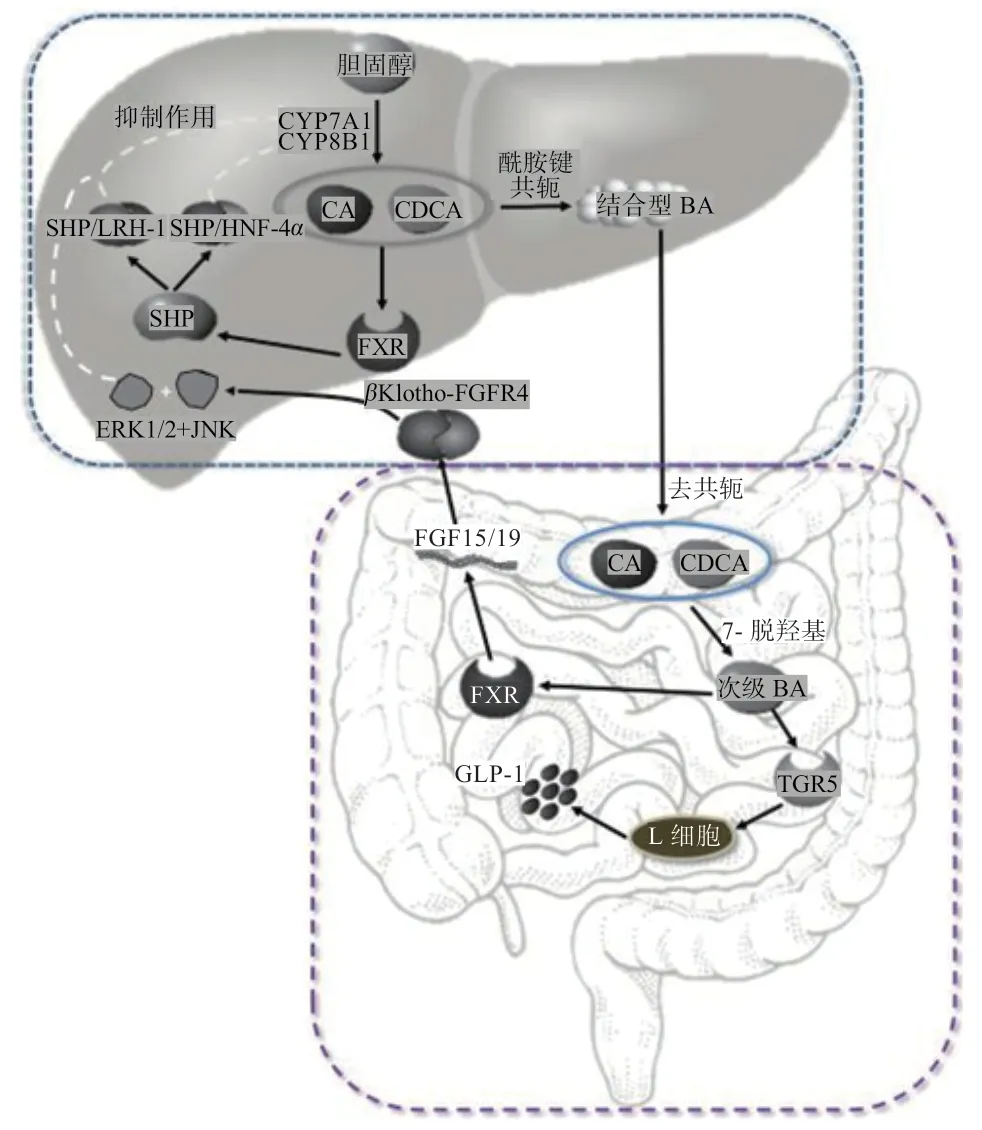
图1 FXR/TGR5 介导的信号通路
2.3 TGR5 介导的BA 代谢信号通路 膜受体TGR5 是G 蛋白偶联受体家族成员,在肝脏、肠道和棕色脂肪等组织器官中均有不同程度表达[31]。BA 经门脉循环重吸收后激活TGR5,促进肠黏膜L 细胞分泌胰高血糖素样肽-1(Glucagon-like Peptide 1,GLP-1),后者与肝脏内GLP-1 受体结合,诱导胰腺β细胞分泌胰岛素,降低血液葡萄糖浓度,从而影响糖代谢[32](图1)。此外,BA 与TGR5 结合能上调腺苷酸活化酶活性,提高细胞内第二信使环磷酸腺苷(Cyclic Adenosine Monophosphate,cAMP)水平。一方面,可活化碘甲腺原氨酸脱碘酶Ⅱ(Iodothyronine Deiodinase Type II,DIO2),将甲状腺激素T4 转为T3,后者刺激线粒体内膜发生氧化磷酸化,增加机体能量消耗[33];另一方面,显著抑制由革兰氏阴性菌细胞壁中脂多糖(Lipopolysaccharides,LPS)诱导的巨噬细胞产生促炎因子,如IL-1α、IL-6 和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)[30]。
3 肠道菌群对BA 代谢及其相关信号通路的影响
肠道菌群可生成特定微生物酶,通过对BA 进行解离和脱羟基等生物转化反应,影响其合成及代谢。同时,当肠道菌群种类和数量发生改变,FXR 或TGR5 表达受到激活或抑制,影响两者介导的信号通路,调节动物机体代谢功能。
3.1 肠道菌群对BA 代谢的影响 肝脏内至少存在17 种酶介导BA 的合成,包括CYP7A1、CYP8B1 和CYP27A1。与无菌小鼠相比,这些酶在普通小鼠肝细胞中的表达水平有所下降,使得原发性BA 生成减少,表明肠道菌群能通过相关酶促反应来调节BA 的合成[34]。BA 随胆汁进入肠腔后,肠腔内的细菌经去共轭和7-脱羟基2 个环节将初级BA 转化为次级BA。肠道微生物修饰BA的第一步是利用肠球菌、双歧杆菌属和乳酸杆菌属等产生胆盐水解酶(Bile Salt Hydrolase,BSH),解离共轭BA 中甘氨酸或牛磺酸基团[27]。BSH 作用于C-N 键,促进氨基酸残基与BA 分子间N-乙酰胺键水解,再次形成游离BA,阻止ASBT 的主动重吸收。去共轭是7-脱羟基反应的前提条件,结合型初级BA 发生水解作用后才使其羟基暴露。随后,梭菌属、拟杆菌属和乳酸杆菌属等产生7α-脱羟基酶,该酶经多步反应脱去游离BA 中的7α/β-羟基,使CA 和CDCA 分别转变为DCA和LCA[35-36],小鼠α/β-MCA 转化为鼠脱氧胆酸[24]。此外,肠道菌群还能通过酯化、脱硫化和差向异构化等反应对BA 进行修饰,增加宿主内BA 池的多样性。如真杆菌属、拟杆菌属和乳酸杆菌属细菌可将BA 酯化;消化球菌属和假单胞杆菌属等细菌对硫酸化BA 进行脱硫反应,促进其吸收;梭菌属和埃希氏杆菌属等细菌产生羟基类固醇脱氢酶,氧化BA 分子C3、C7 和C12 上的羟基,使其进一步发生差向异构化[29]。小鼠肠腔内的拟杆菌、真杆菌属和消化链球菌属等细菌可生成特定酶,使β-MCA 经6β/7β-差向异构化形成ω-MCA 或γ-MCA,ω-MCA 再由7β-脱羟基作用转化为猪脱氧胆酸[24,29]。
3.2 肠道菌群对FXR 信号通路的影响 研究显示,耗竭小鼠体内微生物群后,FXR 激动剂牛磺胆酸(Taurocholic Acid,TCA)和拮抗剂牛磺-β-MCA(Tauro-β-muricholic Acid,T-β-MCA)水平均升高,肠道FXR被激活,但肝脏FXR活性减弱,使SHP表达受到抑制,后者通过促进CYP7A1基因转录来改变BA 的合成和池稳定[37]。这表明肠道细菌可调节FXR-SHP 肝脏信号通路,影响动物生理反应。Sun 等[38]在用小檗碱喂养肠道特异性FXR基因敲除小鼠研究中发现,其肠道微生物种类减少,特定菌群产生BSH 活性减弱,TCA 含量显著升高,而TCA 和小蘖碱均能激活FXR,诱导FXR下游靶点SHP表达,负向调节BA 合成。Huang 等[39]研究发现,普洱茶中紫草素可使BSH 产生菌数量和BA 水解量减少,小鼠肝脏和回肠内牛磺熊去氧胆酸(Tauroursodeoxycholic Acid,TUDCA)和牛磺鹅去氧胆酸(Taurochenodeoxycholic Acid,TCDCA)含量升高。而TUDCA 和TCDCA 均能抑制FXR 和FGF15 蛋白的表达,并诱导替代途径合成酶的表达,导致CDCA生成增多,激活FXR-SHP 信号通路,调节下游靶基因进一步抑制经典途径合成酶CYP8B1 表达,实现BA 反馈抑制[39]。
肠道菌群与BA 相互作用可直接影响FXR 肠道信号通路,经抗生素处理后或无菌小鼠回肠FGF15基因表达明显减少[40]。用抗生素治疗小鼠后,其肠道菌群丰富度和多样性减少,BA 组成发生变化,对激活FXR影响较大,特异性BA 激活能力为CDCA>DCA>LCA>CA,而T-β-MCA 是FXR 天然拮抗剂[36]。无菌小鼠与普通小鼠之间代谢差异主要取决于T-β-MCA 水平。拮抗剂T-β-MCA 在无菌条件下无法进行代谢,故无菌小鼠体内表现出T-β-MCA 积累,FXR信号通路受到抑制,其下游产物FGF15 分泌减少[41]。由此可得,肠道细菌通过FXR-FGF15/19 反馈通路调控BA 的合成。有研究表明,C57BL1/6 小鼠经万古霉素、庆大霉素处理后,结肠内革兰氏阳性菌(如乳酸杆菌和双歧杆菌)和阴性菌(如拟杆菌和真杆菌)数量显著减少,导致体内拮抗剂T-β-MCA 含量增加,而激动剂CDCA和DCA 比例下降,回肠FXR 激活受阻,进一步抑制FGF15 与肝细胞FGFR4 的结合,从而促进CYP7A1、CYP8B1和CYP27A1基因的表达,增加肝脏BA 的合成[36]。研究发现,使用抗生素会破坏菌群平衡,干扰BA 代谢通路,增加动物肠道疾病发生率,而应用多酚类等植物化合物、益生菌和中药等能增加动物肠道微生物的多样性,恢复菌群正常结构[1,12,37]。Liu 等[42]对抗生素诱导小鼠给予乳酸菌和柑桔多酚提取物,发现其肠内参与BA 代谢细菌(如梭菌和双歧杆菌)数量得到恢复,初级和次级BA 水平显著提高,与肝-肠轴相关的FXR-FGF15 信号通路被激活,CYP7A1 蛋白表达受到抑制,从而负反馈调节BA 的合成。对小鼠灌服中药黄连素后,可通过影响肠道菌群种类和数量激活FXR肠道途径,增加远端回肠FGF15 和IBABP 水平,抑制CYP7A1的mRNA 水平,致使BA 合成受阻,最终维持动物体内BA 的稳态[38]。
3.3 肠道菌群对TGR5 信号通路的影响 肠道菌群通过产生激动剂来调节TGR5 信号转导,促进GLP-1 的分泌,调控动物脂肪沉积,预防或治疗糖代谢紊乱等疾病。Zarrinpar 等[37]给小鼠服用新霉素和氨苄西林等抗生素,发现肠道菌群多样性改变,膜受体TGR5 内源性配体TCA 含量升高。TCA 可诱导L 细胞生成和释放GLP-1,促进其作用于β细胞表面的GLP-1 受体,抑制瘦素分泌,改善胰岛素敏感性并增加肝脏糖异生,最终影响动物体葡萄糖平衡[37]。表没食子儿茶素没食子酸酯(Epigallocatechingallate,EGCG)是茶多酚的重要成分,小鼠经EGCG 处理后,肠道菌群结构发生变化,疣微菌科和肠球菌科丰度升高,两者均会影响BA 的生成,如增加肝脏LCA 浓度等[43]。而后LCA 诱导TGR5信号通路产生正向调控作用,促进GLP-1 的释放,引起进食后胰岛素分泌水平的升高,血糖浓度降低,改善动物体内葡萄糖紊乱症状。Pathak 等[32]给TGR5 基因敲除小鼠灌胃抗组胺药非索非那定,发现产醋菌属和拟杆菌属等细菌多样性增加,进而上调BSH 和7α/β-脱羟酶的活性,加速CDCA 转化为LCA,激活TGR5,促使L 细胞分泌GLP-1,提高肥胖小鼠的糖耐量,诱导脂肪组织褐变,减轻代谢紊乱症状。此外,LCA 还能激活TGR5-cAMP 信号通路,降低白色脂肪组织中DIO2 水平,以降低肥胖小鼠的体重,减少脂肪沉积。因此,BA-TGR5-DIO2 通路在调节机体能量代谢方面发挥着重要作用[32]。
TCA 水平在机体肠道微生物耗竭条件下显著升高,其作为TGR5 激动剂在巨噬细胞和库普弗细胞中活化TGR5,使细胞内cAMP 含量上升,降低LPS 诱导的促炎性细胞因子IL-1 和IL-8 水平,改变炎症通路,达到抗炎效果,最终提高动物机体免疫力[37]。研究表明,肥胖引起菌群紊乱后,肠道通透性发生改变,血清LPS水平升高,刺激TLR4 增加促炎细胞因子分泌,导致慢性轻度炎症的发生,从而损害动物肠道健康[44]。而金雀异黄酮能调节小鼠肠道微生物区系特定菌群丰度,不仅能改善机体葡萄糖代谢,还可降低血浆促炎细胞因子水平和肿瘤生长率。López 等[45]在高脂饮食诱导肥胖小鼠饲料中添加金雀异黄酮,发现拟杆菌属数量减少,普氏菌属和艾克曼菌属数量升高,而这2 种菌群丰度的增加与血循环中LPS 浓度的降低有关。这是由于肠道微生物群的变化影响了BA 池的组成,导致TGR5 表达增加,并诱导膜内侧腺苷酸环化酶在Mg2+存在条件下催化ATP 转化为信号分子cAMP,通过激活TGR5-cAMP 抗炎通路抑制NLRP3 炎症小体,减少TLR4、TNF-α和IL-6 的生成[45-46]。因此,肠道菌群与BA-TGR5通路之间的代谢平衡对预防动物相关疾病至关重要。
4 总结与展望
肠道菌群通过解离、脱羟基、脱硫化和差向异构化等反应改变BA 的结构和性质,在宿主BA 代谢中发挥核心作用。在BA 代谢过程中,FXR 和TGR5 信号通路受肠道细菌的影响。饮食和抗生素等因素改变微生物丰富度后,会影响BA 的种类,继而调节FXR 和TGR5介导的代谢通路。FXR 由肝脏和肠道2 条途径分别诱导SHP 和FGF15/19 信号通路,反馈抑制BA 的合成,维持其代谢稳态。TGR5 活化后则增加GLP-1 和cAMP含量,调控葡萄糖和脂质代谢,平衡动物脂肪沉积,缓解糖代谢紊乱和炎症等疾病的症状。目前肠道菌群对BA 代谢及其相关通路在人类和小鼠模型中应用较广,但对于畜禽动物中的研究尚浅,随着对肠道菌群与BA调控信号通路研究的深入,有望通过肠道菌群-BA-FXR/TGR5 途径来防治动物相关疾病,指导动物生产工作。
