基于生态位理论的瘤胃微生物发酵调控研究进展
2020-12-21李嘉秋王佳堃
李嘉秋,王佳堃
(浙江大学奶业科学研究所,浙江杭州 310058)
在现代生态学中,生态位研究已经渗透到动植物和社会领域,为解决环境问题做出了有益贡献,成为了生态学中重要的基础理论之一[1]。生态位(Niche)概念最早源于对鸟类的生态学研究[2],是指一个物种与其他物种相关联的特定时间、空间位置及功能地位[3-4]。不仅强调物种本身的生存空间,更加强调其在群落中的作用和地位,尤其是与其他物种的竞争、互作等相关关系[5]。反刍动物瘤胃是一个相对封闭的生物发酵系统,多种微生物(细菌、古菌、真菌、原虫等)协同参与机体的营养利用过程,了解瘤胃微生物功能和种间关系是调控瘤胃的基础。但是纵观整个反刍动物生命周期的瘤胃微生物区系变化,出生后24 h 内,瘤胃微生物开始定植;随着个体采食固体饲料,瘤胃中菌群密度和多样性也迅速增长[6-7],在此过程中优先定植的微生物如何影响后续微生物的定植以及瘤胃中微生物的整体功能和互作机制尚不清晰,针对瘤胃功能微生物实现高效调控的手段尚有欠缺。相比于森林、鸟类、土壤的生态位研究,瘤胃生态位研究远远滞后。为此,本文在阐述生态位理论的基础上,综述了不同微生物群落中群落构建的主要规则;同时,应用生态位理论分析近年来与瘤胃微生物区系相关的生态位研究,包括瘤胃微生物类群的群落构建机制、功能划分,以及不同表观性状的反刍动物个体之间瘤胃微生物生态位特异性比较;并在此基础上探究了高效利用反刍动物瘤胃微生物的调控方向。
1 微生物群落构建的生态位理论及分化规则
群落多样性的形成和维持机理即群落构建(Community Assembly)机制一直是生态学研究的核心论题。基于生态位分化为前提的群落构建理论的产生与发展已历经百年。随着对微生物生态位理论研究的深入,逐渐形成生态位抢占及生态位修饰2 种微生物生态位分化的模式理论。
1.1 生态位理论的发展 Johnson 等[2]在1910 年第1 次将“生态位”作为术语引用,Grinnell[3]随后对“生态位”给出完整定义,即生态位是恰好被一个种或亚种在群落和生态系统中所占据的最后分布单元。Hutchinson 等[8]从多因子影响角度提出物种生态位还会受到多种资源环境因子的影响,即生态位指有机体与它所处的环境(生物和非生物)所有关系的总和。Odum 等[9]研究认为,生态位是指生态系统和群落中一个物种和其他物种相关联的特定时间位置、空间位置和功能地位,强调生物有机体在群落中的机能作用和地位。Vandermeer[4]在此基础上提出了竞争排斥法则,即生态位指的是物种在生物群落中的位置,包括物种生境、食性;两物种竞争同一资源时,总有一方具有竞争优势,另一种是被排斥的现象,每个物种生存发展的前提是占据具有竞争优势的生态位。2003 年以后,生态位的定义也在不断拓宽,Chase 等[5]和Silvertown 等[10]立足经典生态位理论,加入了除环境中可利用的资源,环境因子和其他因子(包括时间、空间环境波动的变化)也能影响生态位分化的观点,完善和拓展了现代生态位理论。国内学者对生态位研究始于1980 年左右,王刚等[11]认为,生态位一方面体现了物种与所处生境的关系,另一方面体现了群落中各物种之间的关系。朱春全[12]的态势理论认为,生态位同时包括了“态”和“势”两方面,“态”是自我成长和环境影响过程中所累积的状态,“势”则是对现有资源利用能力以及对环境的生存适应能力。目前,生态位概念仍未有一个统一的定义,Whittaker 等[13]提出,生态位指群落中物种在时间、空间的位置和功能关系,以及与其他物种的相关关系的综合。群落构建理论发展至今,一种观点认为存在“资源竞争”的物种之间的生态位分化等确定性因素起主导作用[10],后来又有观点认为“随机”和“扩散”等不确定因素起主导作用。后者发展出的中性理论认为,在一个复杂的自然群落中,一些随机的因素,譬如种群丰度随机的上下起伏、新物种的形成或者物种的迁移才是物种多样性的决定因素[14-15]。经过20 多年的争论[16],生态学家们摒弃了2 种理论互相对立的观点,认为生态位理论与中性理论二者整合为一体可以更好地理解群落构建机理。即环境变化是最主要的驱动力,在一个相对简单的生态系统中,生态位分化的贡献度可能更大;而在物种丰富的大集群生态环境中,随机作用的效果可能更强[17-19]。值得注意的是,不管偏向何种理论,群落中微生物之间的相互关系是相同功能的微生物集合(官能团,Functional Group)对其他执行相同或不同功能的微生物集合的优先效应(Priority Effects),即先定植的微生物会影响后续微生物的定植、增长和演替[20]。生态位理论能够帮助研究者更好地理解瘤胃微生态系统中的物种结构和分工。
1.2 微生物生态位抢占 发生在生态位重叠,即需求和环境影响相似的物种之间的优先效应称为“生态位抢占”(Niche Preemption),通常情况下是两种物种对同一可利用底物的竞争[21]。Vieira 等[22]选用不同物种模拟自然微生物在海洋中的先后定植过程,发现留存能力较强的微生物可以有效降低定植后整个自然群落的物种丰富度,这说明先定植的微生物优先抢占了后定植微生物生长所需的空间。在缺乏底物的条件下,复杂土壤微生物组成的生态系统相比于简单的系统能有效抵制外来微生物物种的入侵,而与此同时增加可利用的底物能够显著提高入侵物种的丰度[23]。Maldonado-Gomez 等[24]报道,当宿主肠道微生物区系缺失长双歧杆菌(Bifidobac terium longum)时,肠道内的底物会发生富集,口服长双歧杆菌后在人类肠道中的定植效果优于其他宿主,当肠道微生物的生态位出现缺失时,根据生态位抢占的机制原理,处于同一生态位的外源微生物能够在肠道中很快定植。不仅如此,在简化的模型中,假设一共S个物种在各自定植的阶段消耗相同比例k的可用资源并产生相应的增长c,理论上一个动态平衡的群落中,相同功能的物种丰度满足指数分布:
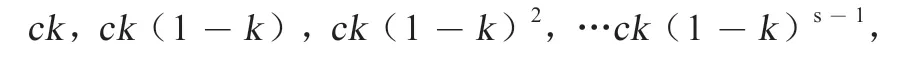
使用真实的群落丰度数据验证后,分布的拟合度大于0.99,因此可以通过群落的观测数据推得各个物种的丰度以及它们定植所需要消耗的资源比例[25]。因此,底物竞争可能是微生物生态位抢占机制的重要组成,而微生物与微生物之间的竞争关系可能也会导致优先效应的发生,这将是后续生态研究关注的重点之一。
1.3 微生物生态位修饰 不同于“生态位抢占”,先定植物种的生态活动改变其周围环境从而为后续物种创造新的环境条件的优先效应称为“生态位修饰”(Niche Modification)[21]。首先,外来菌群定植的先后顺序会产生优势生态位。饮用含有动物双歧杆菌(Bifidobacterium animalis)的酸奶,可以有效促进肠道中乳酸利用菌和丁酸生成菌的相对丰度,降低肠道pH 并产生大量短链脂肪酸,从而抑制大肠杆菌(Escherichia coli)等病原菌的定植[26]。并且在体外培养条件下,荧光假单胞菌(Pseudomonas fluorescens)的繁殖导致试管中先形成了2 种不同的微环境,即靠近液面的富氧区和接近试管底部的无氧区,当环境中出现了能够形成生物膜的新个体时,这些细菌会在靠近液面的富氧区形成生物膜,从而造成仅在生物膜范围内存在氧气浓度梯度差异,位于生物膜下方的微环境则完全转变为无氧区,也就是说微生物的定植造成了小型模拟系统中出现了不同的环境条件,从而促进不同的微生物繁殖[27]。其次,当微生物群落面临非常强烈的环境选择压力时,微生物种群的响应也会产生优势生态位。此前,微生物耐药性机制一直得不到合理解释,随着研究的深入,学者们发现可能是水平基因转移(Horizontal Gene Transfer)导致的微生物生态位修饰在菌群整体抵御抗生素时发挥重要作用[28-31]。水平基因转移指原核生物间通过摄取有耐受能力的DNA 扩充自身基因组信息并由此抵御环境选择压力的过程,可推动微生物进化和新物种的产生[32]。研究表明,为了适应环境变化,在同一生境中,不同物种有共享耐受基因的趋势,这一过程发生在系统发育距离相近的物种之间的概率更高[33]。综上,优先定植或优势微生物通过不同机制对其生存环境形成生态位修饰,进而对后来定植的微生物产生优先效应,可以丰富微生物多样性和形成群落构建。
2 瘤胃微生物生态位分化规则和官能团类群
类比生态位所涉及的两大理论,瘤胃微生物也呈现出类似的生态位抢占和生态位修饰的表观现象。在此基础上了解不同功能瘤胃微生物是了解其占据何种生态位以及如何影响其他微生物的关键。
2.1 瘤胃微生物的生态位抢占 属于革兰氏阴性菌的普雷沃氏菌属(Prevotella)遗传多样性丰富[34],能够利用淀粉、非纤维性多糖和纤维素,即使在缺乏营养物质的条件下也能生存,是反刍动物瘤胃系统中早期定植的微生物物种之一[35-36]。普雷沃氏菌属在瘤胃微生物定植的早期就占据优势生态位,从而影响了其他利用纤维素及糖类的细菌的早期定植[37]。这些微生物可直接利用饲料底物,产生挥发性脂肪酸等物质,同时产生大量还原氢。还原氢的利用充分体现了瘤胃微生物对底物竞争的能力和生态位抢占能力。大量研究已经证实,瘤胃中的还原氢主要由以下几种官能团利用:①氢营养型甲烷生成途径中利用H2和CO2还原成甲烷的官能团;②琥珀酸途径中利用还原氢生成丙酸的官能团;③乙酸生成途径中利用H2和CO2生成乙酸的官能团[38]。在新生动物消化道内,饲料底物丰富所以瘤胃内氢分压较高,乙酸生成官能团占据主导生态位,形成生态位抢占的优先效应,它们能够优先消耗氢气生成乙酸,抢夺了其他官能团可利用的氢资源,抑制其他氢利用官能团[39-40]。而随着反刍动物年龄增长,瘤胃内氢分压受到多种微生物的共同作用而逐渐降低,对氢分压要求不高的氢营养型甲烷生成官能团取代乙酸官能团形成生态位抢占,因此成年动物的氢更多流向甲烷生成途径[41]。相较于瘤胃大环境,Huws 等[42]发现饲料表面瘤胃微生物定植的过程中,无论饲料颗粒黏附的微生物如何动态变化,丁酸弧菌属(Butyrivibrio)、瘤胃球菌属(Ruminococcus)、欧陆森氏菌属(Olsenella)和普雷沃氏菌属一直占有数量优势,这说明它们占据饲料表面微环境的优势生态位,抑制后续其他微生物在饲料表面定植。生态位抢占主导了瘤胃微生态的“演变”和“成熟”,因此针对幼龄反刍动物的靶向微生物调控可能形成生态位抢占的优先效应,重新定向瘤胃微生物的演替过程。
2.2 瘤胃微生物的生态位修饰 生态位抢占会影响微生物的群落结构,而生态位修饰既能影响群落结构,又能影响微生物菌群功能[43]。普雷沃氏菌属和梭菌属(Clostridium)是瘤胃中多样性最多的两大类群,而且普雷沃氏菌属被认为先于梭菌属在瘤胃定植[44]。这可能是由于当饲料颗粒进入瘤胃后,普雷沃氏菌属会降解半纤维素优先定植,木聚糖暴露后,梭菌属才得以定植,从微生物功能来说,普雷沃氏菌属的亚种中包含大量半纤维素降解基因,而梭菌属的亚型中包含大量纤维素降解基因,正是由于功能上的差异导致了它们在瘤胃中的定植顺序,进而影响了瘤胃菌群结构和其他微生物对底物的利用情况[44]。而随着饲料的降解,局部的氢分压逐渐升高,抑制了饲料的进一步降解,甲烷菌在饲料表面聚集,有效降低氢分压,饲料再次开始降解[45],形成饲料消化的整个动态过程。Jami 等[7]发现 1 日龄初生犊牛的瘤胃内包含大量好氧细菌和厌氧细菌,24 h 后瘤胃中可检测到大量厌氧细菌,这说明好氧细菌在2 d 内消耗了多余的氧气并修饰了生态环境,改变了后续微生物的定植[46]。Shaani 等[21]发现饲喂不同类型饲料时,与早晨(晨饲后)相比,傍晚采集的样品中瘤胃pH、甲烷菌数量和甲烷产量都会更高,为了探究这种日间变化模式与微生物有关还是代谢环境相关,他们将动物采食后不同时间点(早晨和傍晚)的瘤胃微生物分别接种到晨间或傍晚的瘤胃液环境中,结果发现,不管接种早晨或傍晚的微生物,晚间瘤胃液环境甲烷菌数量更多,甲烷产量更高,表观验证了经微生物修饰的生态位会直接影响后续接种的微生物定植的能力和功能,进而影响群落结构。除此之外,近年来,许多学者发现了瘤胃生态位修饰的一个重要机制,即来自不同谱系的瘤胃微生物通过基因交换(水平基因转移)获取相似功能[21]。McCuddin 等[47]发现瘤胃原虫能够增强克雷伯菌属(Klebsiella)向无抗生素抗性的沙门氏菌属(Salmonella)传递抗生素抗性基因的能力,由此推测原虫可能在瘤胃细菌之间介导水平基因转移的发生。还有研究发现细菌与真菌之间发生碳水化合物水解基因的转移[48-49]、细菌与原虫之间发生植物细胞壁多糖降解酶基因的转移[50],说明瘤胃微生物的生态位修饰过程可能是通过水平基因转移实现的。
2.3 瘤胃微生物的官能团类群 瘤胃微生物是不同功能微生物的集合。瘤胃微生物组计划(RMP)[51]同时利用纯培养技术与三代测序技术,对来自瘤胃的微生物进行了深度的基因组测序。因为不同谱系的微生物功能可能相似,相同谱系的微生物功能可能不同,所以大致上可以按照代谢产物将瘤胃微生物分为6 个功能类群,即产乙酸、产丙酸、产丁酸、产甲烷、产乳酸和琥珀酸或延胡索酸、产氨官能团(表1)。瘤胃微生物的多样性和整体功能与这6 类微生物之间的相互关系密切相关。首先,产乙酸(C2)、产丁酸(C4)、产乳酸(L)、琥珀酸(S)或延胡索酸(F)的官能团都利用丙酮酸(P)生成相应的产物,而丙酮酸主要来源于瘤胃内的糖类降解,因此这3 类官能团共同利用了有限的瘤胃资源,构成生态位抢占关系,处于优势地位的官能团主导了瘤胃的整体发酵模式。同时,丙酮酸产乙酸过程会产生大量的还原氢,还原氢和二氧化碳被甲烷菌利用,降低氢分压促进丙酮酸继续发酵,二者构成生态位修饰关系。其他消耗氢的官能团(如产丙酸、产乳酸、产琥珀酸的官能团)则与甲烷构成生态位抢占。生态位理论为这些官能团的相互关系提供了有力解释,而如何合理的利用官能团的生态位关系,是将来调控瘤胃微生物促进饲料利用的关键。
3 瘤胃微生物的生态位和高效调控方式
生态位抢占和生态位修饰的存在使得已定植的微生物由于优先效应影响后续微生物的变化。从生态位角度探讨瘤胃微生物的适应性机制,以及饲料利用效率与反刍动物瘤胃微生物区系关系,是精准调控瘤胃微生物的基础。
3.1 瘤胃核心菌群与适应性 反刍动物摄入的饲粮组成不同时,瘤胃细菌的组成依然相似。Petri 等[59]对8 头饲喂不同精粗比饲料肉牛的瘤胃内容物分别进行核糖体RNA 扩增子测序发现,平均相对丰度最高的普雷沃氏菌属、毛螺菌科和梭菌目3 个微生物类群占瘤胃全部遗传信息的82%。Henderson 等[60]检测了来自35 个国家和地区的不同反刍动物的瘤胃液,结果显示瘤胃中高丰度的瘤胃细菌组成(如普雷沃氏菌属、毛螺旋菌科、瘤胃球菌科和梭菌目)的相对丰度占比是相似的,同时它们与其他微生物之间存在稳定的相互关系,这类菌群可视作“瘤胃核心菌群”。而Rubino 等[44]报道在普雷沃氏菌属和梭菌属中,碳水化合物降解相关的功能基因亚型最多,这些核心菌群能在不同的瘤胃条件下保持自己的功能。此外,越来越多的报道证实,莫能霉素(一种在反刍动物中常用的瘤胃调控添加剂)的调控作用会随着瘤胃微生物的适应而逐渐减弱[61]。同时也有报道证实莫能霉素不能引起普雷沃氏菌属和梭菌目等核心菌群的显著丰度变化。因此,瘤胃微生物在应对外界环境的剧烈变化时表现出的强烈适应性,可能与核心菌群稳定占据着各自的生态位有关。研究者调控瘤胃微生物的目的往往是让瘤胃从一个动态平衡状态转向另一个动态平衡状态,而部分调控手段只能让瘤胃微生物区系在小范围内发生组成变化[62]。理论上欲使群落整体动态平衡状态发生变化需要满足:①现有的微生物组成包含能够共同引发优先效应的物种;②发生的局部动态变化要足够快并能让先行物种在其他物种定植之前抢占或者修饰生态位[20]。由于瘤胃核心菌群的存在,后续研究在调控瘤胃的过程中可能需要先打破瘤胃中原有的生态位关系,然后再做出相应的调控,可能提高瘤胃调控的效率。

表1 瘤胃微生物的生态位分化和部分官能团成员
3.2 饲料效率/甲烷耦联调控 比较不同饲料利用效率个体的瘤胃微生物组成可以帮助研究者了解高饲料利用效率个体瘤胃微生物生态位和功能的特异性。Shabat 等[54]通过比较不同饲料剩余采食量的肉牛个体,发现乳酸-丙烯酸-丙酸途径在高饲料效率个体中富集,并且主要由埃氏巨型球菌(Megasphaera elsdenii)和灵巧粪球菌(Corprococcus catus)2 种微生物介导。相似的是,Kittelmann 等[63]在高低甲烷产量绵羊个体中发现,低甲烷产量绵羊的瘤胃微生物主要有2 种组成,一种表现为低乙丙比和低氢瘤胃发酵环境,而另一种为乳酸生成菌(如沙棘菌属和欧陆森氏菌属)的富集,这说明倾向于产生乳酸-丙酸途径的瘤胃微生物组成往往不会产生更多甲烷。Kamke 等[53]通过宏基因组测序进一步证明沙棘菌属等异型乳酸发酵产生菌快速降解饲料中的淀粉底物产生大量乳酸,这些乳酸促进巨型球菌属等编码Ldh(乳酸脱氢酶)和LcdA(乳酰辅酶A 脱氢酶)基因的微生物在瘤胃中富集,将乳酸转化为丙酸和丁酸,降低瘤胃中可利用的氢含量。从生态位理论的角度,可以推测高饲料利用效率个体的瘤胃中,功能微生物占据产乳酸的主要生态位一方面通过生态位抢占减少甲烷菌可利用的氢,另一方面产生大量的乳酸底物,通过生态位修饰促进乳酸利用菌的定植,因此这类动物个体在提高了饲料效率的同时表现出低甲烷产量的表型(图1)。
相比于乳酸途径,瘤胃中竞争氢的生态位官能团还有延胡索酸-琥珀酸途径,而琥珀酸和乳酸作为丙酸产生的2 个主要前体物质,其高效转化为丙酸能够提高动物的生产性能并减少琥珀酸在瘤胃中的累积。很多研究也证明,仅添加延胡索酸会导致琥珀酸的累积,从而在热力学上抑制延胡索酸的还原,减少延胡索酸对氢的竞争力[64]。通过提高下游琥珀酸的利用率,可能提高延胡索酸进入丙酸生成途径的比例,从而降低动物的甲烷产量并同时提高饲料效率。

图1 低饲料效率和低甲烷产量的共同富集通路[50-52]
4 小 结
瘤胃微生物适应性、瘤胃饲料效率调控与甲烷减排调控的耦联效应以及其他未知的瘤胃中代谢通路之间存在的相互关系,亟待研究者对瘤胃微生物的功能群体进行研究。生态位理论能够帮助研究者更好地理解瘤胃内环境中微生物的整体功能,以及优先定植的微生物如何影响后续微生物的定植及功能。随着瘤胃微生物生态位研究的逐渐深入,可以预见,破坏原有的生态位抢占状态或针对性添加修饰瘤胃环境的微生物制剂等方法能够帮助研究者实现瘤胃的高效调控。
