基于网络药理学和分子对接探讨漏芦防治缺血性脑卒中的作用机制
2020-12-21李媛媛刘珂依刘浩琦王丽琴张涵莱孙逸坤朱陵群邢雁伟高永红
李媛媛,刘珂依,宋 珂,刘浩琦,安 娜,王丽琴,张涵莱,孙逸坤,朱陵群,邢雁伟,高 颖,高永红
脑卒中又称“中风”,是全球范围内最主要的威胁人类生命健康的疾病之一,具有高发病率、高致残率和高死亡率的临床特点[1]。缺血性脑卒中是中风最常见的一种疾病类型,约占中风病人总数的87%,主要是由于局部供血障碍导致大脑缺氧性病变和缺血性坏死,进而引发局灶或完全性神经功能缺损[2-3]。目前缺血性脑卒中最有效的治疗策略是溶栓疗法,但由于受时间窗限制且存在出血性转化等影响,临床使用率相对较低[4-5]。因此,如何预防缺血性脑卒中的发生发展,改善脑卒中病人的预后及生活质量,已成为目前临床关注的热点之一。漏芦为菊科植物祁州漏芦的干燥根,主要分布于我国华北、东北和西北诸省,具有清热解毒、消痈下乳、祛瘀通脉之功效[6]。早在《神农本草经》中就有关于漏芦的记载,“漏芦,味苦咸寒,久服轻身益气,耳目聪明,不老延年,列为上品”[7]。现代研究发现,漏芦具有抗氧化、抗缺氧、抗炎、抗动脉粥样硬化以及改善记忆障碍等作用[8],可通过抑制炎症反应,清除氧自由基以及兴奋性氨基酸等毒性物质,发挥防治缺血性脑卒中的作用[9]。但漏芦防治缺血性脑卒中具体作用机制尚不清楚,本研究基于网络药理学构建“药物-有效成分-潜在靶点-通路-疾病”的一种复杂网络调控图,进一步阐释漏芦防治缺血性脑卒中的生物学机制,并利用分子对接技术验证漏芦有效活性成分与其靶点蛋白的亲和性,为深入探讨漏芦防治缺血性脑卒中的分子作用机制提供了一定的研究基础和理论依据。
1 材料与方法
1.1 数据库和软件 本研究涉及的数据库有TCMSP(https://tcmspw.com/tcmsp.php),ETCM(http://www.tcmip.cn/ETCM/),Swiss Target Prediction(http://swisstargetprediction.ch/),SymMap(https://www.symmap.org/),CTD(http://ctdbase.org/),Uniprot(https://www.uniprot.org/),DisGeNET(https://www.disgenet.org/),TTD(http://db.idrblab.net/ttd/),Drugbank(https://www.drugbank.ca/),String(https://string-db.org/cgi/input.pl),Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/),DAVID(https://david.ncifcrf.gov/),PubChem(https://pubchem.ncbi.nlm.nih.gov),RCSB PDB(https://www.rcsb.org);软件有Cytoscape 3.8.0、Auto DockTools 1.5.6、PyMOL 2.4.0、Discovery Studio 4.0、OpenBabel 2.4.1。
1.2 漏芦活性成分的筛查 应用TCMSP数据库,以“漏芦”为检索词,并根据药动力学原理,依据“口服生物利用度(OB)≥30%,类药性(DL)≥0.18”获取漏芦有效活性成分。
1.3 有效活性成分作用靶点和疾病潜在靶点的获取及收集 通过TCMSP、ETCM、Swiss Target Prediction、SymMap、CTD等数据库获取漏芦有效活性成分的作用靶点,经过整理、校对、去重后,收集漏芦有效成分相关的靶蛋白信息。然后利用Uniprot数据库将收集到的蛋白靶点标准化,筛选出物种条件为人的靶点,即为漏芦有效成分的潜在靶点。 以“ischemic stroke”为检索词,在DisGeNET、TTD、Drugbank数据库中检索缺血性脑卒中相关的靶点蛋白,获得疾病潜在作用靶点。将漏芦有效成分的潜在靶点与缺血性脑卒中相关靶点进行交集,筛选出二者共同靶点,这些共同的靶标蛋白很可能作为漏芦防治缺血性脑卒中的相关候选靶点。
1.4 药物-主要成分-疾病-靶点网络的构建 将上述获得的漏芦有效成分治疗缺血性脑卒中的潜在靶点导入Cytoscape 3.8.0软件中,构建“药物-成分-疾病-靶点”的调控网络图,其中外侧节点显示的是漏芦活性成分治疗缺血性脑卒中的潜在作用靶点,网络中心节点代表的是漏芦及其主要活性成分。整个网络图直观地显示了漏芦-有效成分-缺血性脑卒中-潜在靶点之间的关系。
1.5 蛋白相互作用(PPI)网络的构建与分析 将上述共同靶点导入String数据库中,设置物种为人,获得蛋白-蛋白之间的相互作用关系,保存其为TSV格式,然后将得到的数据导入Cytoscape 3.8.0软件中,构建PPI网络;同时利用“Network Analyzer”插件进行网络拓扑参数分析,并选取自由度值(degree)、介数(betweenness)和中心度(closeness)均大于中位数的节点,确定为漏芦防治缺血性脑卒中的关键靶点。
1.6 关键靶点的富集分析和可视化 运用DAVID数据库将上述得到的关键靶点进行基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)信号通路富集分析,以P<0.05为标准,富集结果分别采用柱状图和气泡图的形式进行展示。
1.7 漏芦活性成分与作用靶点的分子对接验证 利用AutoDock软件构建漏芦活性成分与PPI网络图中degree排名前5位的蛋白靶点的分子对接模型,从而验证网络分析结果的可靠性。从PubChem数据库中下载漏芦活性成分3D结构的“SDF”格式文件,导入OpenBabel 2.4.1进行优化;再通过RCSB PDB数据库筛选对应蛋白靶点的最佳蛋白晶体结构的“PDB”格式文件。对漏芦活性成分和重要靶点蛋白的3D结构进行去水、加氢等处理后,将其转换成pdbqt格式,最后利用AutoDock软件进行分子对接,结合能越大表明配体与靶点之间的结合越好。
2 结 果
2.1 漏芦活性成分的筛选 在TCMSP数据库中以“漏芦”为检索词,获得漏芦活性成分25个,进一步以“OB≥30%,DL≥0.18”为筛选阈值,共获得5种漏芦的有效活性成分。详见表1。

表1 漏芦的有效活性成分及其参数
2.2 漏芦防治缺血性脑卒中的潜在作用靶点 通过TCMSP、ETCM、SWISS、SymMap和CTD数据库预测漏芦有效成分相关靶点,去重整理后共获得相关靶标375个。利用DisGeNET、TTD和Drugbank数据库平台合并去重后挖掘得到缺血性脑卒中相关基因1 206个。分别将漏芦潜在靶点与缺血性脑卒中相关基因输入Venny 2.1.0中,绘制韦恩图,获得漏芦防治缺血性
脑卒中相关候选靶点118个。详见图1。

图1 漏芦-缺血性脑卒中靶点韦恩图
2.3 药物-活性成分-疾病-靶点调控网络构建结果 应用Cytoscape软件绘制药物-活性成分-疾病-靶点复杂网络调控图,其中青色代表缺血性脑卒中(CIS),黄色代表漏芦,紫色代表漏芦的有效活性成分,红色代表漏芦-缺血性脑卒中的共同靶点。结果表明,漏芦主要通过5种有效活性成分作用于118个靶点,其可能作为漏芦防治缺血性脑卒中的重要潜在靶标。详见图2。
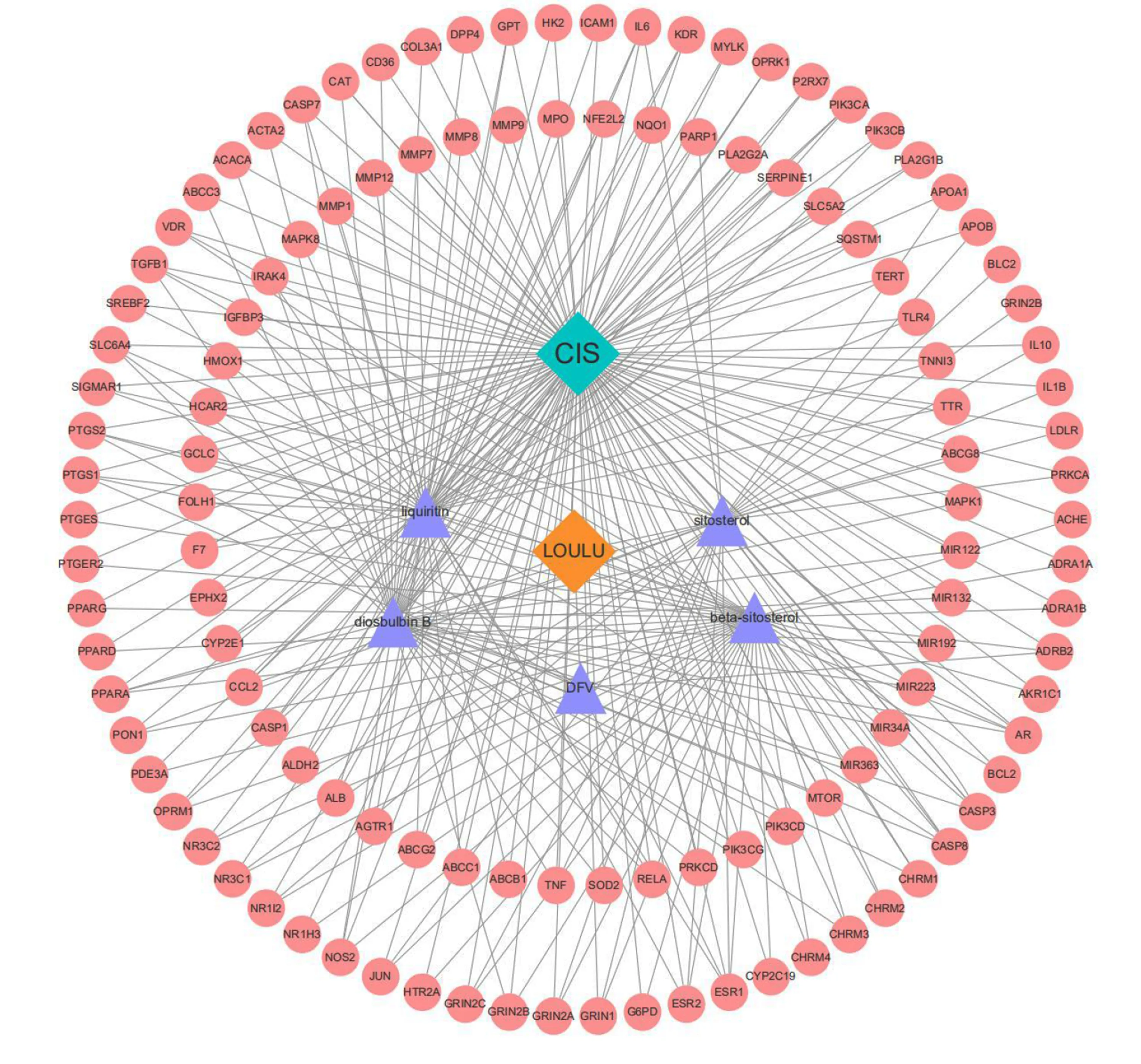
图2 中药-成分-疾病-靶点调控网络
2.4 PPI网络构建及关键靶点筛选 将上述漏芦防治缺血性脑卒中的118个候选靶点导入String数据库中,限定物种为人,得到蛋白之间相互作用关系,保存为TSV格式文件,并将其导入Cytoscape软件中构建PPI网络图。详见图3。图中的节点表示蛋白,边表示蛋白与蛋白之间的相互关系,共涉及111个节点、1 165条边(其中MIR122、MIR132、MIR192、MIR223、MIR34A、MIR363未在数据库中找到,PDE3A与其他蛋白不存在相互作用关系,故均未在网络中体现)。其中节点的大小和颜色与degree值成正比,节点越大对应degree值越大,颜色由蓝变红对应的degree值亦逐渐增大。利用Cytoscape中“Network Analyzer”功能从网络节点重要性的角度进行网络拓扑参数分析,获得度值、介数和中心度等网络拓扑特征值。以中位数为卡值,筛选3项均满足卡值的靶点为漏芦防治缺血性脑卒中的关键靶点,共获得关键靶点44个。详见表2。
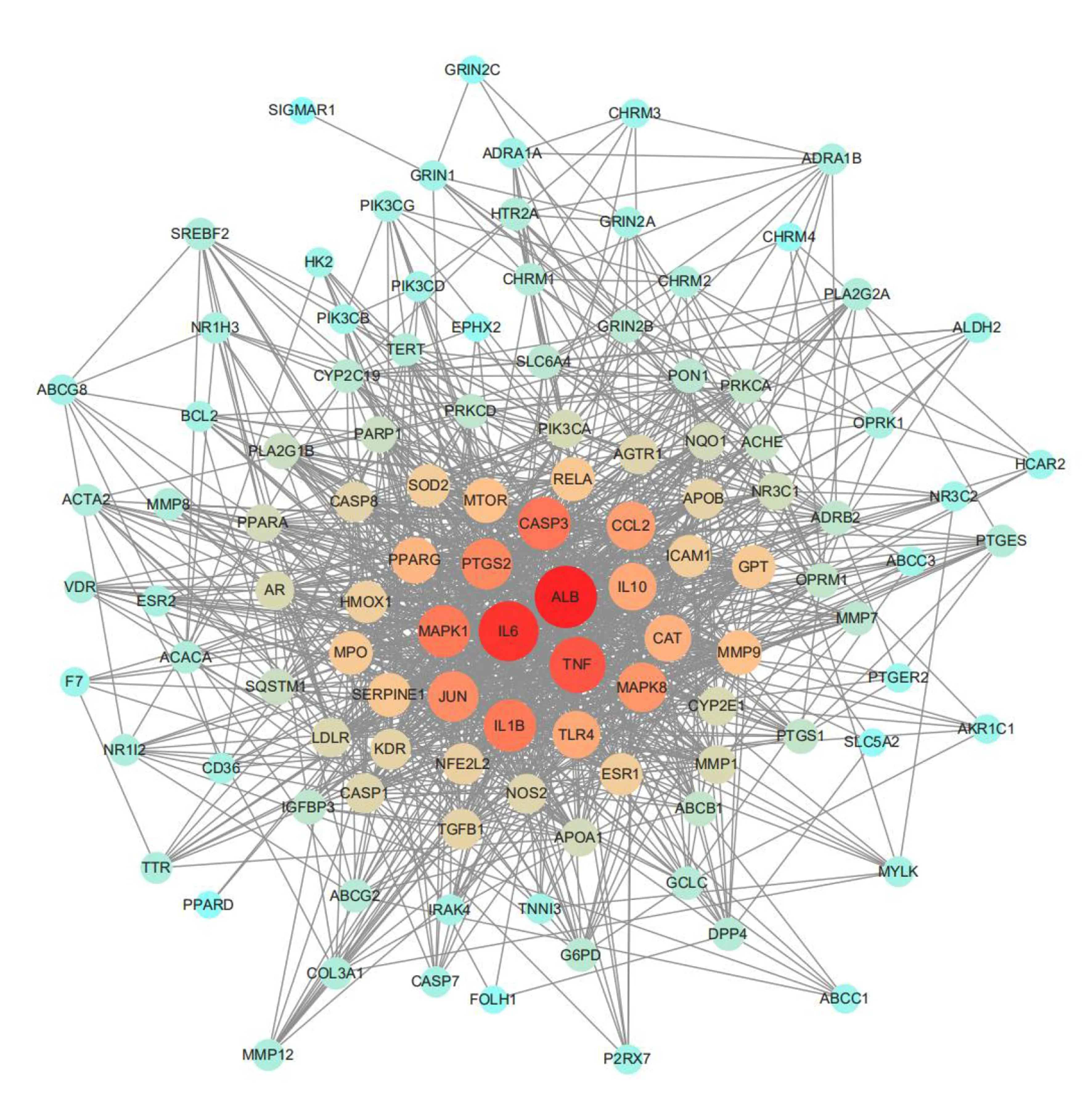
图3 中药-疾病蛋白相互作用网络
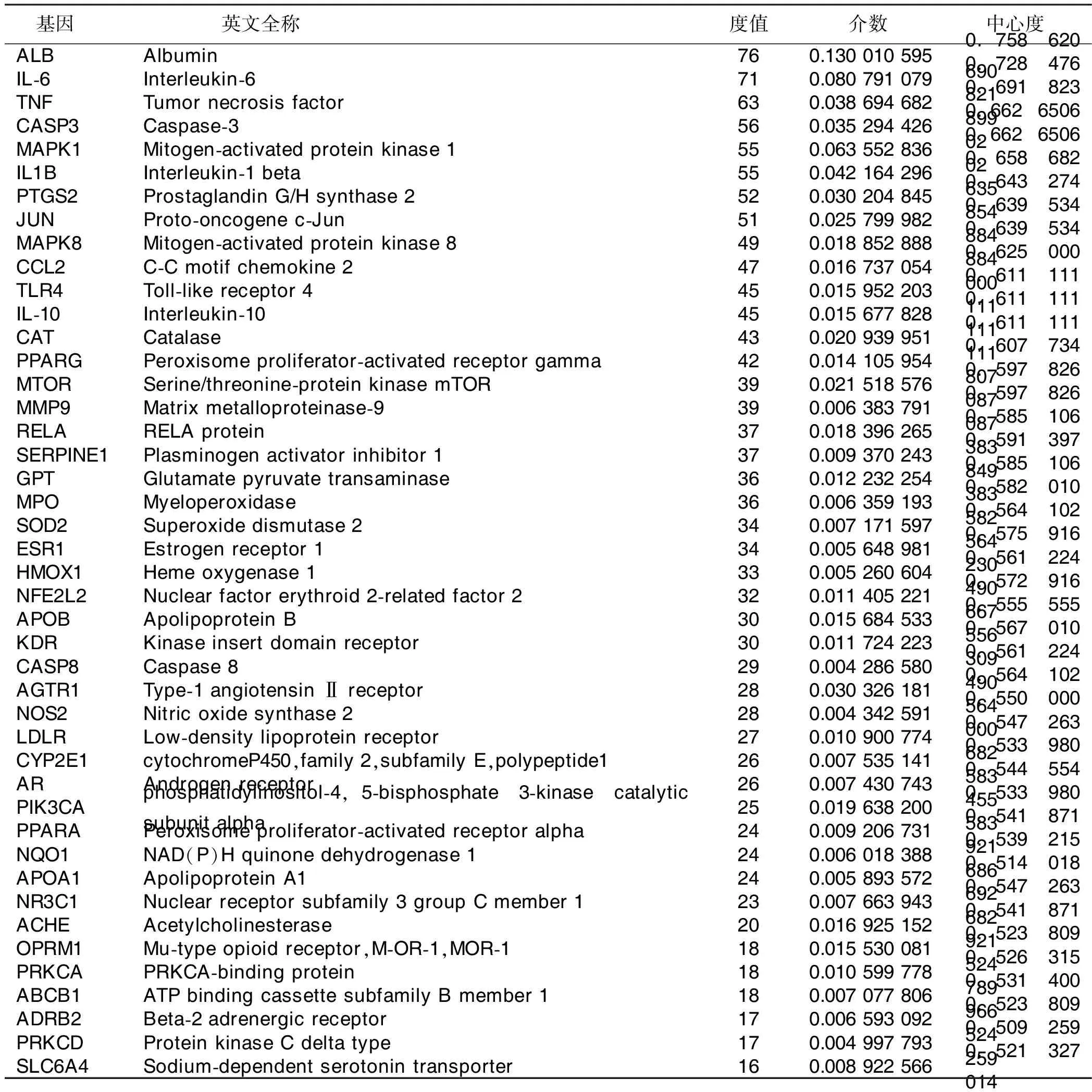
表2 漏芦防治缺血性脑卒中关键候选靶点
2.5 关键靶点的富集分析及可视化 运用DAVID数据库对上述关键靶点进行GO富集分析,按照显著度P<0.05共确定了272个条目。其中细胞生物过程富集的基因数相对较多,共207个条目,排名比较靠前的有一氧化氮生物合成过程的正向调控、药物的反应、细胞对脂多糖的反应、基因表达的正调控、凋亡的负向调节、转录调控及衰老过程等,表明漏芦可能主要通过调节以上多条生物过程发挥治疗缺血性脑卒中的作用。与细胞组成相关的条目共30个,富集结果主要集中在细胞外间隙、细胞质、细胞质膜、高尔基体、溶酶体等。涉及分子功能的靶点条目共35个,主要包括酶结合、蛋白结合、类固醇激素受体活性、血红素结合、转录因子结合等。根据Count值排序,分别取前10名进行分析。详见图4。通过DAVID数据库对漏芦防治缺血性脑卒中相关的44个关键靶点进行KEGG通路富集分析,根据P<0.05筛选获得76条相关信号通路,经查文献发现与缺血性脑卒中密切相关的信号通路有3条,分别是肿瘤坏死因子(TNF)信号通路、低氧诱导因子-1(HIF-1)信号通路、Toll样受体(Toll-like receptor,TLR)信号通路。根据P值从小到大排序选取前20条信号通路进行可视化处理(富集程度可根据P值和基因个数进行衡量)。详见图5。
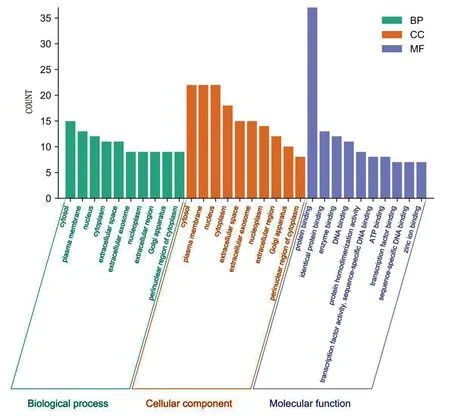
图4 漏芦防治缺血性脑卒中关键靶点的GO富集分析
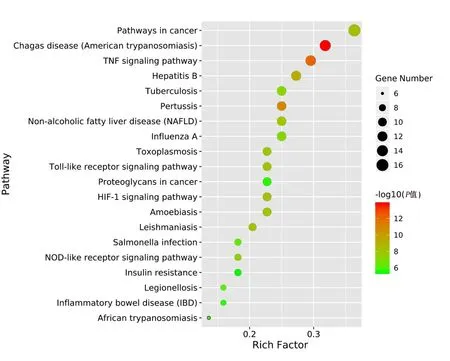
图5 漏芦关键靶点KEGG富集通路气泡图
2.6 药物-成分-靶点-通路-疾病网络的构建 将上述所得到的漏芦及其有效活性成分、关键靶点、信号通路和缺血性脑卒中同时导入Cytoscape软件中进行可视化处理,构建药物-成分-靶点-通路-疾病网络结构图(见图6)。其中红色节点代表漏芦,紫色节点代表漏芦有效活性成分,青色节点代表漏芦防治缺血性脑卒中潜在的关键靶点,粉色节点代表靶点相关KEGG通路,黄色节点代表缺血性脑卒中。由图6可知,漏芦可通过5种不同的活性成分作用于不同的靶点,包括白蛋白(ALB)、白细胞介素-6(IL-6)、TNF、半胱氨酸蛋白酶-3(CASP3)及丝裂原活化蛋白激酶1(MAPK1)等;此外不同的靶点亦可通过多条通路发挥抗缺血性脑卒中的作用机制,涉及TNF信号通路、HIF-1信号通路、TLR信号通路等。该网络图充分体现了中药漏芦具有多成分、多靶点、多途径发挥防治缺血性脑卒中的临床特征,作用机制复杂多样。
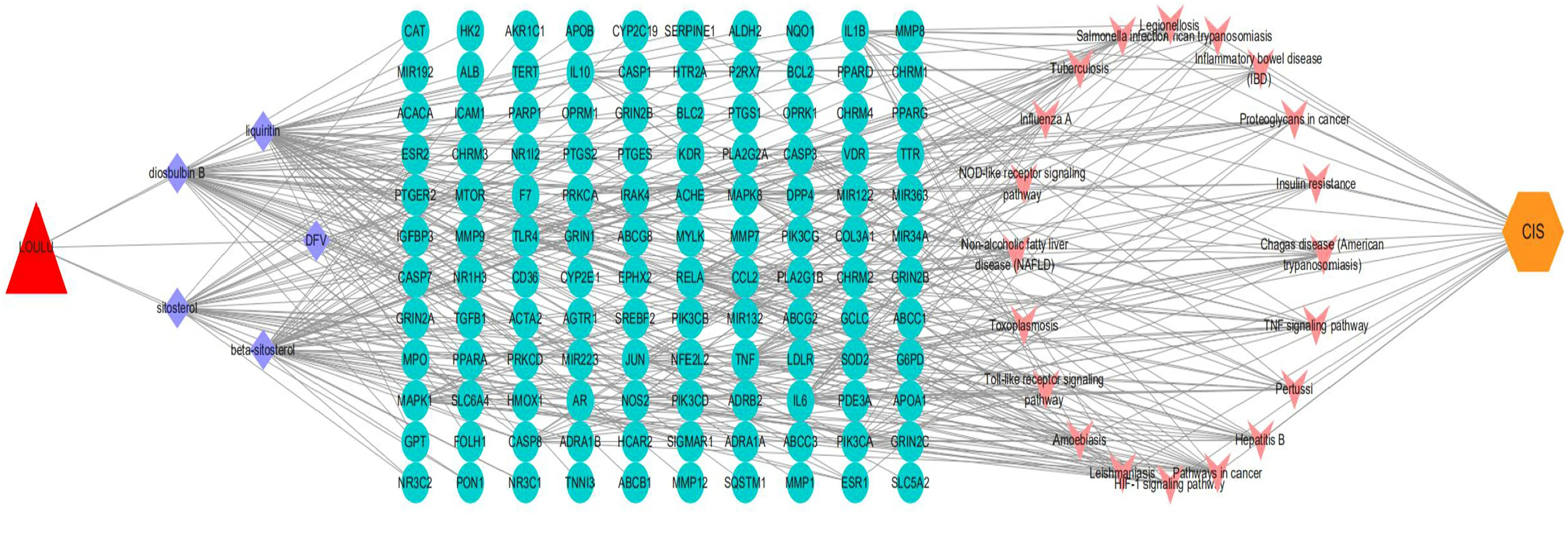
图6 漏芦-成分-靶点-通路-疾病多维网络图
2.7 漏芦主要活性成分与对应核心靶点蛋白的分子对接验证 利用AutoDock软件将甘草素、β-谷甾醇、谷甾醇、甘草苷等5种化合物与ALB、IL-6、TNF、CASP3及MAPK1等相对应的核心靶点分别建立分子对接模型(见图7)。对接结果只保留每对分子对接Affinity(kcal/mol)绝对值最高的。一般认为,结合能大于5 kcal/mol表明化合物与靶点蛋白之间结合活性较好;结合能大于7.0 kcal/mol表明小分子与受体蛋白具有很强的结合活性。热图结果显示,除了甘草素与MAPK1的对接打分小于7.0 kcal/mol之外,其他化合物与对应靶点的结合能均大于7.0 kcal/mol,说明漏芦有效活性成分与ALB、IL-6、TNF、CASP3及MAPK1共5种核心靶点之间具有较好的结合活性。综合上述结果,表明甘草素、β-谷甾醇、谷甾醇、甘草苷和黄独素B与潜在核心靶点具有较好的结合活性,表明漏芦可能通过作用于潜在核心靶点发挥防治缺血性脑卒中的作用。同时借助Pymol 2.4.0软件分别对β-谷甾醇与ALB、β-谷甾醇与IL-6、黄独素B与ALB以及黄独素B与IL-6进行分子对接可视化。详见图8。

图7 分子对接分数的热图分析

图8 分子对接模式图
3 讨 论
缺血性脑卒中是以偏瘫、失语等局灶性神经功能缺损为特征的一种疾病,发病迅速、病情复杂、变化多端且预后相对较差。其中瘀血作为缺血性脑卒中的主要病理产物和致病因素,贯穿疾病的始终,成为疾病发生发展的关键因素之一[10]。漏芦,性寒,味苦微咸,入胃及大肠经,为解毒通络之良药。临床研究发现,漏芦可配伍不同药味共奏活血通络,清除脑中瘀毒之功,如脑栓通胶囊、复方苁蓉益智胶囊等中成药[11-12]。虽然漏芦可以改善缺血后脑损伤反应,但是其作用机制尚不明确。本研究借助网络药理学方法为漏芦防治缺血性脑卒中的分子机制研究提供了参考。
本研究以TCMSP数据库中OB、DL为参数,共获得5种漏芦的有效活性成分,分别是甘草素、β-谷甾醇、谷甾醇、甘草苷和黄独素B。药理研究表明,甘草素具有抗氧化、抗炎和抗病毒等多种生物活性,可显著上调雌激素受体β基因(ERβ)的表达而发挥抗炎效应,抑制NOD样受体家族3(NLRP3)、半胱氨酸蛋白酶 -1(Caspase-1)、白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α)等炎性因子的释放,减轻神经炎症反应[13-14]。β-谷甾醇具有血管生成的作用,可以有效恢复缺血/再灌注损伤沙鼠的运动功能[15]。甘草苷作为小鼠局灶性脑缺血/再灌注损伤的潜在治疗药物,其可能是通过抗氧化以及抗凋亡的药理特性发挥缺血后的神经保护作用。上述已有文献报道为本实验结果提供了一定的理论基础,即甘草素、β-谷甾醇和甘草苷可作为漏芦防治缺血性脑卒中的关键有效活性成分。此外,文献中关于谷甾醇和黄独素B在脑缺血方面的研究相对较少,可作为以后实验研究的新视角。
通过中药-成分-靶点-疾病网络图和PPI网络分析表明,ALB、IL-6、TNF、CASP3及MAPK1等可能是漏芦防治缺血性脑卒中的核心靶点。其中ALB是血液系统中的重要组成成分,在抑制血小板聚集、调节血管渗透性及抗凝血功能等方面发挥着重要的生理功能[16]。此外,ALB具有抗炎和神经保护功能,在人体的免疫系统中亦发挥着十分重要的作用[17-18],其可能与脑卒中的预后关系较为密切。炎症是缺血性脑卒中的病理标志,TNF、IL-6作为强有力的炎性细胞因子,是未来中风治疗的潜在靶点。最近有研究表明,卒中后IL-6的释放可通过激活N-甲基-D-天冬氨酸(NMDA)受体以及内皮素-1(ET-1)和c-Jun氨基末端激酶(JNK)的上调导致脑卒中后脑脊液和脑组织释放,进而损害脑血管的自动调节并促进海马神经坏死[19]。TNF是通过激活单核细胞或巨噬细胞产生的炎性因子[20],可以通过激活胶质细胞并介导血管内皮细胞上黏附分子的表达,从而促进中性粒细胞的浸润,在缺血性脑卒中的发病机制中起着至关重要的作用[21]。CASP3作为Caspase家族中备受关注的蛋白之一,可催化多种细胞关键蛋白的特异性断裂,是细胞凋亡过程中最关键的凋亡执行蛋白酶[22],在启动缺血脑区受损神经元凋亡的关键环节中发挥着十分重要的作用[23-25]。目前,丝裂原活化蛋白激酶(MAPK)信号传导已被广泛研究,在缺血性脑中后调节细胞凋亡和炎性细胞因子的表达中起着关键作用[26]。MAPK1作为生化信号的整合点,在多种细胞生物过程,包括细胞增殖、分化、转录、调控和发育等方面均发挥着至关重要的调控作用[27]。
KEGG富集通路结果表明,漏芦的关键靶点主要富集于以下几条相关通路,包括TNF信号通路、HIF-1信号通路、Toll样受体信号通路等途径。其中TNF信号通路是参与中风后炎症反应及血脑屏障破坏的重要信号通路之一[28-30]。脑缺血发生后,缺血神经元会释放大量炎性细胞因子(IL-6、TNF-α等),从而诱发更多的炎性细胞因子及细胞毒素物质的产生,进一步破坏血脑屏障和细胞外基质,加速继发性脑损伤的发生[31]。HIF-1信号通路是缺血后促进血管再生以及维持血脑屏障完整性的关键通路之一,其中低氧诱导因子-1α(HIF-1α)作为血管内皮生长因子的上游调节剂,是脑损伤应答的重要转录因子,参与调节血管的生成、细胞的凋亡与自噬等多条信号通路[32-33]。此外,TLR信号通路在脑缺血引起的神经损伤过程中也起着重要的作用。轻度缺血性脑损伤可通过抑制Toll样受体4(TLR4)/核因子-κB(NF-κB)和Toll样受体2(TLR2)信号通路以及激活干扰素调节因子3(IRF3)信号通路从而导致TLR缺血耐受并减少脑损伤;反之,急性缺血性脑卒中亦可激活TLR信号通路,进一步诱导炎性介质的释放,并引发继发性炎症反应的发生。因此,推测漏芦有效成分可能是通过TNF信号通路、HIF-1信号通路、TLR信号通路等途径调控ALB、IL-6、TNF、CASP3、MAPK1等核心靶点防治缺血性脑卒中。分子对接结果亦表明,甘草素、β-谷甾醇、谷甾醇、甘草苷和黄独素B与ALB、IL-6、TNF、CASP3、MAPK1等相对应靶点结合能均大于7 kcal/mol,提示两者之间均具有较强的结合活性,提示其很有可能是防治缺血性脑卒中的关键活性成分及核心靶点。
综上所述,本研究通过网络药理学的方法预测漏芦防治缺血性脑卒中的分子机制,结果表明,漏芦有效活性成分可能通过TNF信号通路,HIF-1信号通路,TLR信号通路等途径调控ALB、IL-6、TNF、CASP3、MAPK1等核心靶点防治缺血性脑卒中;同时采用分子对接技术证实了漏芦有效活性成分与其相关靶点均能够最佳结合,提示漏芦通过“多成分-多靶点-多途径”的方式防治缺血性脑卒中,发挥抑制炎症反应、抗氧化、调节免疫、促进血管新生和神经功能恢复等效应。然而本研究仅在理论水平上初步预测了漏芦防治缺血性脑卒中的分子机制,旨在为深入挖掘漏芦-靶点-通路之间的相互关系提供新思路,为进一步开展相关实验研究提供一定的理论基础。
