补肾化瘀方对肝纤维化大鼠肝脏Hippo信号通路的影响*
2020-12-20杨晴柔陈芝芸何蓓晖严峻彬严茂祥
杨晴柔 陈芝芸 何蓓晖 叶 蕾 严峻彬 严茂祥#
1 绍兴市第七人民医院 浙江 绍兴 312000
2 浙江中医药大学附属第一医院 浙江 杭州 310006
肝纤维化(HF)是多种慢性肝病的最常见病理特征,可进展为肝硬化,最终导致肝癌。肝纤维化尚有逆转的可能,因此,寻找有效地抗肝纤维药物,具有重要的临床意义。中医药在抗肝纤维化方面具有独特的优势和巨大潜力;其抗肝纤维化的机制包括调控多条细胞信号传导通路,抑制肝脏炎症,抗脂质过氧化损伤,抑制肝星状细胞(HSCs)的活化和增殖,调节纤维化因子的合成和分泌,以及调节合成和细胞外基质(ECM)的降解等[1]。近年来的研究发现,Hippo信号通路参与肝纤维化的发生发展[2]。补肾化瘀方是课题组多年用于治疗肝纤维化的中药复方,前期机制研究发现,该方能通过调控Hh信号通路、TGF-β1/smad3信号通路等的异常激活,抑制肝脏炎症和HSC的活化,抗肝纤维化进展[3-4]。为了进一步探讨补肾化瘀方抗纤维化的“多途径”多环节”“多靶点”作用机制,本研究观察该方对四氯化碳(CCl4)诱导的大鼠肝纤维化大鼠肝组织Hippo信号通路的影响。
1 材料与方法
1.1 动物:SD雄性大鼠40只,SPF级,体重140±10g,SPF级,购自上海斯莱克实验动物有限公司[SCXK(沪)2013-0016];饲养于浙江中医药大学动物实验研究中心,适应性喂养1周后开始实验造模。
1.2 药物与试剂:补肾化瘀方由仙灵脾、女贞子、黄精、党参、虎杖、丹参、郁金、积雪草(比例1.25∶1.25∶1.67∶1.25∶2∶2.5∶1∶1.25)等组成,由本院制剂室制成流浸膏。CCl4(批号:20140319)由上海凌峰化学试剂有限公司提供;总RNA提取试剂(批号:AK1703)、逆转录试剂盒(A140832A)、TB Green荧光定量 PCR试剂(批号:AH80345A)为宝生物工程(大连)有限公司产品;总蛋白提取试剂盒(批号:20190425)为江苏凯基生物技术股份有限公司产品;10%TGX Stain-FreeTMFastCastTMAcrylamide Kit(批号:64096791)为美国BIO-RAD公司产品,BCA定量试剂盒(批号:A90723)、GAPDH鼠单克隆抗体(批号:A85370844)、Potent ECL试剂盒(批号:A82610615)为杭州联科生物技术有限公司;Mst1兔单克隆抗体(产品号:14946S、Yap鼠单克隆抗体(产品号:12395S)、Phospho-Yap兔单克隆抗体(产品号:13008S)为美国CST公司产品;CTGF鼠单克隆抗体(批号:C096)为美国Santa Cruz公司产品。
1.3 主要仪器:生物样品均质器(法国Bertin Technologies),核酸蛋白分析仪(英国柏精BioDrop);全波长酶标仪(美国Bio-TeK);荧光定量PCR仪(美国BIORAD)、垂直电泳及半干转系统(美国BIO-RAD);双近红外分子成像系统(美国LI-COR)。
1.4 实验方法:40只大鼠按每组8只随机分对照组、模型组、BYHYF低剂量组、BYHYF剂量组、BYHYF高剂量组5组。对照组每周2次用橄榄油按3mL/Kg体重皮下注射,其他4组以40%CCl4(V/V,以橄榄油配制成)按3mL/Kg体重皮下注射,每周2次,首次加倍,均连续6周;在造模的同时,BYHYF低、中、高剂量组分别按11、22、44mg/(Kg体重·d)进行灌胃,连续6周;正常对照组和肝纤维化模型组则灌服等容量的0.9%NaCl,连续6周;所有大鼠予以普通大鼠饲料喂养,自由饮水。末次给药次日大鼠空腹3%戊巴比妥钠尾部静脉注射麻醉下处死大鼠并分离肝脏,部分肝组织10%中性甲醛固定后常规HE和Masson染色,观察肝组织炎症和纤维化;部分投入液氮中冻存,2~3h后移入-80℃冰箱用于基因和蛋白检测。Mst1、Yap、CTGF的mRNA的表达采用qRT-PCR技术,以β-actin为内参,相对表达量(2-ΔΔCt)表示目标基因相对表达量,引物由生工生物工程(上海)有限公司设计并合成,Mst上游引物:5’-TGAAGAGCTGGACTGTGGAGGAC-3,下游引物5’-GGATTGGCTGCCGCTTGGAG-3’,扩增片段:114bp;Yap上游引物:5’-GCCATGAACCAGAGGATCACTCAG-3’,下激引物:5’-AGCCTCTCCTTCTCCATCTGTAGC-3’;扩增片段152bp;CTGF上游引物:5’-CACCGCACAGAACCACCACAC-3’,下游引物:5’-GGCAGGCACAGGTCTTGATGAAC-3’,扩增片段96bp;β-actin上游引物:5’-TGTTGCCCTAGACTTCGAGCA-3’,下 游 引 物 5’-CCATACCCAGGAAGGAAGGCT-3’,扩增片段155bp。采用全蛋白抽提试剂盒提取肝组织总蛋白,BCA法进行蛋白定量,Western blot技术检测Mst1、Yap和CTGF蛋白表达及Yap的磷酸化表达,以GAPDH为内参。
2 结果
2.1 补肾化瘀方对肝纤维化大鼠肝组织病理影响:HE和Masson染色发现对照组肝组织结构正常,肝细胞从中央静脉呈索状排列,胶原着色仅见于血管壁;模型组大鼠肝组织大量炎细胞浸润、肝细胞脂肪变,小叶内肝细胞广泛坏死灶,胶原纤维增生进入小叶达中央静脉周围,小叶结构紊乱;与模型组比,BSHYF低、中、高剂量组大鼠肝组织炎细胞浸润和肝细胞坏死有不同程度改善,纤维结缔组织沉积显著减少,见图1。
2.2 补肾化瘀方对肝纤维化大鼠肝组织Mst1、Yap、CTGF基因mRNA表达的影响:模型组大鼠肝组织Mst1mRNA和Yap mRNA较对照组分别有下降和上调趋势,但均差异无显著性(P>0.05);BSHYF低、中、高剂量组Mst1 mRNA和Yap mRNA较模型组分别有上调和下降趋势,但差异无显著性(P>0.05)。模型组CTGF mRNA表达较对照组显著升高(P<0.01),BSHYF中、高剂量组大鼠CTGF mRNA表达较模型组显著下调(P<0.01)。见图2。
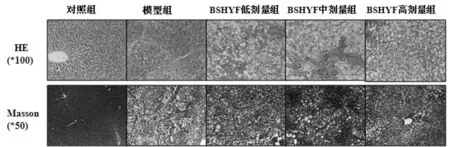
图1 补肾化瘀方对肝纤维化大鼠肝组织病理影响

图2 补肾化瘀方对肝纤维化大鼠肝组织Mst1、Yap、CTGF基因mRNA表达的影响
2.3 补肾化瘀方对肝纤维化大鼠肝组织Mst1、Yap、CTGF蛋白表达的影响:模型组大鼠肝组织Mst1蛋白表达较对照组显著下降(P<0.01),BSHYF高剂量组Mst1蛋白表达较模型组显著上调(P<0.01);模型组大鼠肝组织Yap、CTGF、蛋白表达较对照组显著上升(P<0.01),BSHYF低、中、高剂量组Yap、CTGF蛋白表达较模型组显著下降(P<0.01);模型组大鼠肝组织Yap磷酸化水平与对照组差异无统计学意义(P>0.05),BSHYF低、中、高剂量组较模型组p-Yap磷酸化表达有上调趋势,但差异并无显著性(P>0.05)。见图3。

图3 补肾化瘀方对肝纤维化大鼠肝组织Mst1、Yap、CTGF蛋白表达的影响
3 讨论
补肾化瘀方是课题组根据肝纤维化“本虚标实”的病机特点提出的治疗慢性肝纤维化的中药复方,具有补肾健脾以扶正,理气化瘀解毒以驱邪的功效,前期的研究已表明,该方改善CCl4诱导的肝纤维化大鼠肝组织炎症和纤维化程度,保护肝细胞,防止肝纤维化进展[3-4]。本研究进一步从Hippo信号通路探讨其疗效的作用机制。
近年来研究发现Hippo信号通路可通过影响HSCs的转分化、增殖和凋亡,进而影响肝纤维化的发生及进展[5]。Mst1是该途径上游信号的核心组成部分,也是维持正常肝细胞状态的必要条件[6]。正常肝组织中Hippo通路的激活源于对Mst1磷酸化。磷酸化Mst1能直接磷酸化Lats1/2外,还能分别与支架蛋白Sav1、衔接蛋白Mob1结合间接促发Lats1/2磷酸化。活化的Lats1/2磷酸化Yap中的丝氨酸残基,导致p-Yap(Ser127)与14-3-3结合,使Yap泛素化、降解,阻碍Yap由细胞质转移到细胞核的途径,使Yap保留在细胞质中;位于细胞质中的Yap不能与核内TEAD结合,从而抑制了Yap转录活性[7]。当Hippo信号通路被抑制时,未磷酸化Yap可由细胞质向细胞核内积聚;移位至核内的Yap本身不与DNA结合,它可与多个转录因子(如TEAD)相互作用以驱动靶基因(如CTGF)表达[8]。Tadanors[9]等人发现Yap介导的肿瘤发生与Yap-TEAD介导的CTGF转录激活有关。多项研究发现Yap在HSCs早期活化期间出现大量细胞核内积累,抑制Yap可阻止HSCs纤维化生成[10]。CTGF是Yap下游效应因子,降低CTGF的表达可抑制HSCs的增殖与迁移[11]。因此,Hippo信号通路中Yap核质穿梭是调节TEAD活性,控制CTGF表达的关键;而CTGF也被认为是Yap在肝纤维化中的直接靶点。
本研究发现,肝纤维化模型组大鼠肝组织中Mst1蛋白表达较正常对照组明显下降(P<0.01),Yap蛋白、CTGF mRNA及蛋白表达较对照组有明显上升(P<0.05,P<0.01),推测在早期肝损状态下,Hippo信号通路中上游信号Mst1对p-Yap的作用可能被抑制,促使Hippo信号通路激活,促进肝纤维化发生。应用补肾化瘀方干预后,高剂量组Mst1蛋白表达较模型组增强(P<0.01),低、中、高剂量组Yap、CTGF蛋白表达以及中、高剂量组CTGF mRNA表达较模型组显著下降(P<0.01),结合我们前期研究,发现不同剂量的补肾化瘀方能抑制肝纤维化大鼠肝组织α-SMA表达和HSCs的活化[3]。研究表明,补肾化瘀方对Hippo的上游信号Mst1、Yap的促进作用使得对核内靶基因的激活作用增强,这一系列反应最终导致Hippo信号通路的活化被抑制和纤维化程度被减弱。综上所述,补肾化瘀方可能对Hippo/Yap信号通路的激活起到抑制作用,进而抑制HSCs的活化,这可能是该方抗肝纤维化的作用机制之一。
