高丹草组织培养再生体系的建立
2020-12-19房永雨杨东升柴文娟刘拴成
石 悦,房永雨,于 卓,杨东升,柴文娟,刘拴成
(1.集宁师范学院 生命科学学院,内蒙古 集宁 012000;2.内蒙古农业大学 农学院,内蒙古 呼和浩特 010019;3.内蒙古自治区农牧业科学院草原研究所,内蒙古呼和浩特 010031)
饲用作物蒙农3号高丹草品种(Sorghum biocolor×Sorghum sudanense cv.Mengnong No.3),是由黑壳苏丹草和高粱雄性不育系A3种间杂交育成的一年生饲用作物,兼具苏丹草营养价值高、分蘖能力强、氰化物含量低、抗病性强、适口性好及高粱茎秆粗、叶宽、抗寒耐旱、抗倒伏和产量高等特性[1]。其在我国南方地区每年可收割5~6次[2],北方的内蒙古农牧区每年可刈割2~3次,应用前景广阔[3-4]。
植物组织培养技术具有繁殖快、无菌培养、不受季节限制等优点,为远缘杂交育种、品种改良和转基因育种提供技术支持。牧草中大部分属禾本科牧草,而建立禾本科牧草组织快繁培养体系相对困难,原因是幼胚、幼穗、花药、悬浮细胞、原生质体及成熟种子等适用的外植体较为单一,这些外植体有的取材困难,有的受季节限制且不能全年供应[5]。CHEN 等[6]最早对禾本科牧草进行组织培养工作,仅诱导出愈伤组织。刘明等[7]介绍高粱组织培养研究进展,利用花药或花粉、胚培养(幼胚、胚乳和幼胚小盾片)和外植体(种子、幼穗和幼叶)建立高粱组织培养再生体系。CAI 等[8]以高粱成熟胚的芽端为外植体进行组织培养,研究表明在MS 培养基中添加150 mg/L L-Asn、5 mg/L 2,4-D、0.05 mg/L KT和5种无机盐,可增加愈伤组织诱导率。李杰勤等[9]以两种苏丹草品种的成熟种子为外植体,分别建立组织快繁体系,结果显示MS 培养基中添加不同浓度的2,4-D和NAA 生长调节剂,可提高诱导愈伤组织和继代培养以及分化的能力。
本试验以高丹草蒙农3号成熟种子为外植体,MS 培养基为基础培养基,在不同浓度的2,4-D和NAA 两种生长素组合配比下,对高丹草成熟种子进行愈伤组织诱导、继代培养及芽风化、生根等器官形成,旨在建立高丹草快速高效的再生体系,以期探明不同植物生长激素组合对成熟种子愈伤组织的诱导、分化及植株再生能力的影响,对高丹草新品种选育研究和科学生产提供理论基础。
1 材料和方法
1.1 供试材料
材料选用于卓教授团队育成的蒙农3号高丹草(高粱雄性不育系A3×黑壳苏丹草杂种F2代)成熟种子[10],该品种具有分蘖数多、抗旱性强、适口性好、富含多种氨基酸、产草量高、CN-含量低等优点[11-13]。
1.2 试验方法
1.2.1 种子的预处理 挑选300 粒大小一致、籽粒饱满的高丹草种子,先用自来水冲洗5~10 min。在超净工作台上,首先用75%的乙醇表面消毒30 s(边浸泡边摇动),然后把乙醇液倒掉;再用0.1%的升汞处理12 min,最后用无菌水冲洗3~5次(图1a)。
1.2.2 培养基配制 配制1 L 的MS 培养基,分别称量蔗糖30 g,琼脂7 g,MS 干粉4.74 g,先加无菌水,待水沸腾煮琼脂10 min,随后加入MS 干粉,最后加入蔗糖,将其彻底溶解并定容至1 L,按照试验既定方案,加入不同浓度的植物激素,每组3次重复。利用NaOH 溶液(1 mol/L)调节pH值至5.8~6.4,灭菌后备用(图1b)。
1.2.3 愈伤组织诱导 MS 培养基为基本培养基,添加2,4-D(0.5、1.0、1.5、2.0、2.5、3.0 mg/L)用于诱导形成高丹草愈伤组织。在超净工作台上,将处理好的高丹草种子横切为两块,接种于已配制好的培养基上,每瓶接种8 粒,每个组合接12 瓶,重复3次。接种完的第15 天观察污染情况并统计出愈率和褐化率,培养温度为(25±1)℃。
1.2.4 芽分化培养 接种后的第15 天,对形成的愈伤组织进行一次继代培养。挑选出诱导形成的结构致密、色泽暗黄、颗粒较小的胚性愈伤组织,将其从外植体上剥离,把大块的愈伤组织放于无菌纸上,用刀片切成黄豆粒大小,在无菌环境下接种到最适2,4-D 浓度的继代培养基上,MS 培养基为基本培养基,在适宜条件下培养15 d 后用于幼苗分化培养。
将继代培养的愈伤组织转入幼苗分化培养基,MS为基础培养基,附加NAA(0、0.5、1.0、1.5 mg/L)和6-BA(0.5、1.0、1.5、2.0 mg/L)共16个处理,每一个处理组合接种4 瓶,每瓶接种8个,适宜培养条件为:温度(25±1)℃,光照时间14 h/d,黑暗10 h/d,光强1 500~2 000 lx,相对湿度75%。
1.2.5 生根培养 挑选幼苗分化培养基中长势相近的幼苗转入生根培养基,MS 培养基中附加IBA(0.5、1.0、1.5、2.0、2.5 mg/L)用于生根培养的植物生长物质组合处理,每一个处理接种8 瓶,每瓶接种6株,适宜条件下培养一段时间,14 d 后观察幼苗根系生长情况及统计生根率。
1.3 数据处理
使用SPSS 20.0 软件的ANOVA 过程对各处理进行差异性的检验和Duncan′s 法对结果进行多重比较分析。
2 结果与分析
2.1 愈伤组织诱导培养基筛选
将高丹草种子接种到愈伤诱导培养基上,15 d后形成白色半透明、质软疏松、形状不规则的愈伤组织(图1c)。由表1可以看出,6种不同浓度的2,4-D对高丹草愈伤组织的诱导呈现出先升后降的趋势,其褐化率随着2,4-D 浓度的增加而增加。试验表明,当2,4-D 浓度为1.5 mg/L时,诱导愈伤组织分化数最多,诱导率最高,为65.63%,且褐化数最少,褐化率为19.44%。因此,诱导高丹草成熟种子形成愈伤组织最适的2,4-D 浓度为1.5 mg/L,高浓度的2,4-D 对愈伤组织的形成有一定抑制作用,随着2,4-D 浓度的升高,其褐化率表现不同程度的升高。

表1 不同浓度的2,4-D 对愈伤组织的影响
2.2 芽分化培养基筛选
植物生长调节剂NAA、6-BA 的16个不同组合对高丹草愈伤组织幼苗分化的影响不同(图1d),如表2 所示,NAA 浓度有4个不同处理水平,分别为0、0.5、1.0、1.5 mg/L,每个处理水平中高丹草幼苗芽分化率随着6-BA 浓度的增加总体呈先升后降的趋势。NAA 浓度为0.5 mg/L时,6-BA 浓度达到1.5 mg/L时,高丹草幼苗分化率最高;在生长激素6-BA 的4个处理水平中,NAA 浓度变化对高丹草幼苗分化率也呈先升后降的趋势,6-BA 浓度为1.5 mg/L、NAA 浓度为0.5 mg/L 时高丹草芽分化率最高。因此,高丹草芽分化率最优组合为0.5 mg/L NAA+1.5 mg/L 6-BA,分化率达到80.21%;6-BA 浓度为2.0 mg/L,不添加NAA,分化率最低,为17.71%(表2)。
2.3 幼苗生根培养基筛选
高丹草幼苗生根率随IBA 浓度的增加呈现先升后降的趋势(表3),IBA 浓度为1.0 mg/L时,生根率最高,为74.30%,根系较长,呈辐射状,须根系多且发达(图1e);IBA 浓度为2.5 mg/L时,生根率仅为31.95%,均低于前4个处理组合,从形态结构来看,根系短且少。这表明高浓度的IBA 对高丹草幼苗的生根有很明显的抑制作用。
2.4 移栽炼苗
生根的高丹草组培苗在湿度为80%~90%的环境中炼苗5 d,将其移栽至营养土(花土∶珍珠岩∶蛭石=3∶1∶1)中,在温室中培养,喷湿营养液确保其茁壮成长(图1f)。
3 讨论
3.1 外植体的选择
植物利用花药或花粉、胚培养(幼胚、胚乳和幼胚小盾片)和外植体(种子、幼穗和幼叶)建立组织培养快繁体系。目前来看,有关高丹草组织培养的研究报道并不多,其亲本高粱和苏丹草组培的研究较多,所选外植体中有成熟胚、幼穗和种子。谭化等[14]将不同基因型的高粱幼穗接种于4个诱导培养基上,发现最适的基本培养基是MS1(MS+2,4-D 2 mg/L+3% 蔗糖,pH值5.8),选取幼穗为外植体,诱导产生易于分化的愈伤组织类型,其诱导率高、生长快,6个基因型都获得了再生植株,建立了再生体系。艾克拜尔·毛拉等[15]以新疆地区重要伴生种鞑靼忍冬和疏花蔷薇带芽茎段为外植体,研究不同培养基及植物激素配比对芽分化、增殖及植株再生的影响。刘志华等[16]以种子为外植体,在培养基MS 的基础上,添加不同浓度的生长调节剂(NAA、6-BA和IBA)对罗布麻愈伤组织进行诱导的研究获得了再生植株。
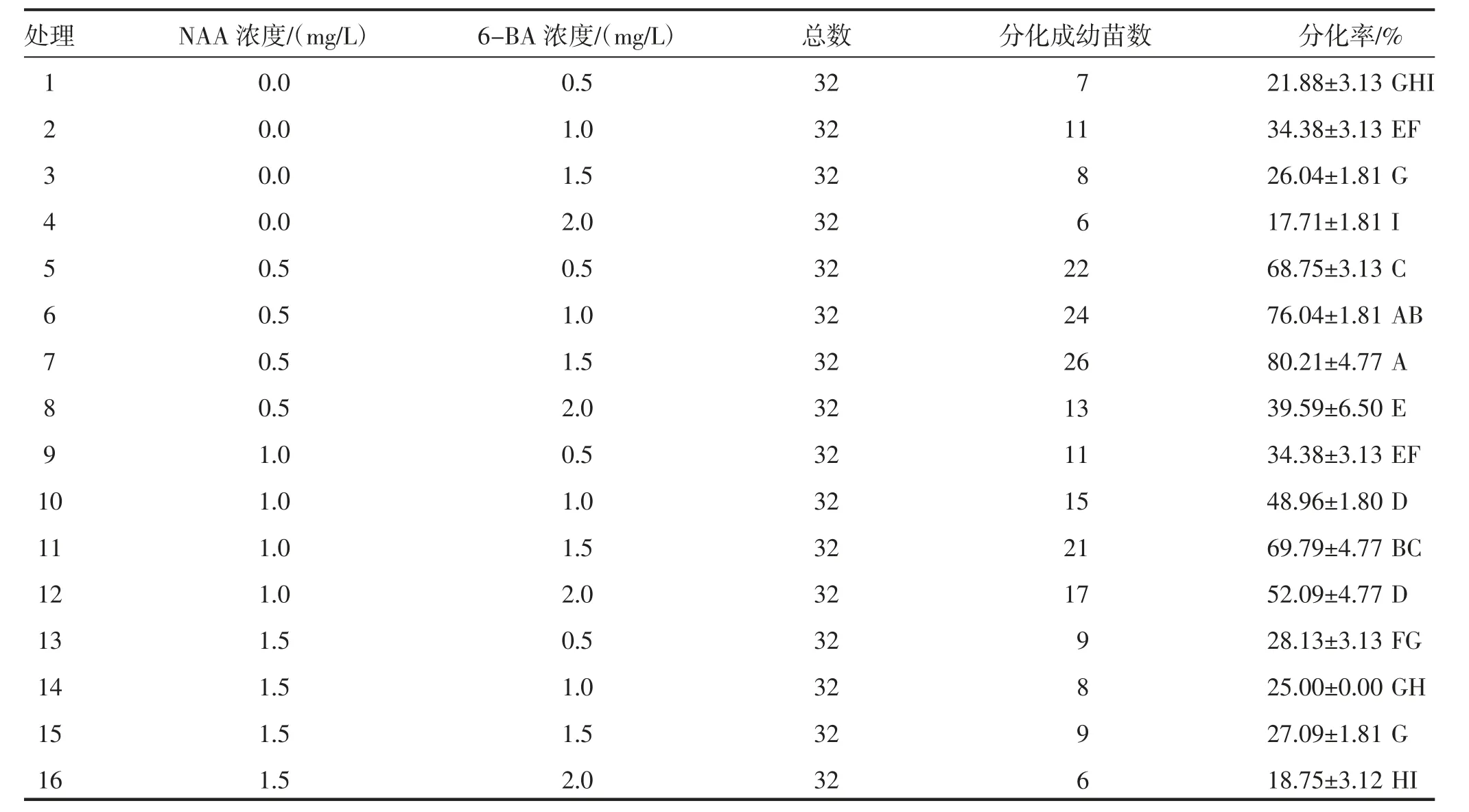
表2 不同植物生长调节剂处理组合对高丹草芽分化的影响

表3 不同浓度的IBA 对高丹草幼苗生根率的影响
高丹草成熟种子有较强的再生能力,种子易获得,来源丰富且遗传稳定,容易灭菌,可减少操作中的污染,因此选取高丹草成熟种子作为外植体进行组织培养。
3.2 不同植物生长调节剂对幼苗分化的影响
高丹草愈伤组织的培养是在植物细胞全能性基础上建立的,在培养过程中植物生长调节剂起促进植物生长和根系分化的作用[17]。程泉等[18]利用不同植物生长调节剂对新疆油用向日葵主栽品种早矮大头诱导愈伤组织、不定芽及不定根,确定最适培养基。罗芃睿等[19]以带柄叶片为外植体,6-BA、NAA、IBA等外源激素对迷你岩桐愈伤组织和不定芽的诱导、增殖和生根的影响。本研究采用不同浓度的2,4-D(0.5、1.0、1.5、2.0、2.5、3.0 mg/L)对高丹草愈伤组织进行诱导,结果表明,2,4-D 浓度为1.5 mg/L 时出愈率最高、褐化率最低。在幼苗分化培养试验中,不添加NAA时,幼苗分化率随6-BA 浓度增加而降低;当NAA 浓度为0.5 mg/L和1.0 mg/L时,幼苗分化率均随着6-BA 浓度的增加而呈现先升高后降低的趋势;当NAA 浓度为1.5 mg/L时,6-BA对芽分化的影响不是很大,且分化率整体下降。在生根培养试验中,添加低浓度生长素IBA 有利于根系的产生,且根系和幼苗生长速度较快,能生长出健壮的根系;根系数量不断增加;高浓度的IBA(2.5 mg/L)抑制高丹草幼苗的生根。因此,适宜的生长调节剂对植物组培和再生体系建立起到促进作用。
4 结论
试验最终确定高丹草适宜的愈伤组织诱导培养基为MS+2,4-D(1.5 mg/L),诱导率达到65.63%;适宜的分化培养基为MS+NAA(0.5 mg/L)+6-BA(1.5 mg/L),分化率80.21%;适宜生根培养基为MS+IBA(1.0 mg/L),生根率达75%。成功建立组培体系是组织培养技术中较为关键的一步,这为高丹草远缘杂交育种和转基因育种开辟了新途径。
