近30年来东海长江口泥质区浮游植物生产力与群落结构变化的生物标志物记录❋
2020-12-18郭新宇张海龙
郭新宇, 张海龙, 李 莉, 毕 蓉
(中国海洋大学海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100)
东海是我国重要的边缘海,具有广阔的大陆架,处于东亚季风的影响区域。东海环流体系复杂,主要包括台湾暖流、长江冲淡水、东海沿岸流、黑潮等。其中,在海底斜坡地貌与东亚季风协同作用下,东海沿岸流、台湾暖流等在东海近岸相互作用,形成沿岸上升流[1]。同时,长江三角洲等河口地区受人类活动影响明显,长江冲淡水携带大量陆源物质进入东海。因此,东海的生态环境受到人类活动与环境因素的双重影响。
近年来,关于东海近岸泥质区的研究逐渐增多,主要集中于浮游植物生产力与群落结构变化,以及不同来源有机质比例变化两个方面。东海近岸存在着长江口泥质区、闽浙泥质区以及济州岛西南泥质区[2],其中,长江口泥质区位于陆-海作用交界区,受长江输入的影响明显。Zhao等[3]通过沉积物中多种色素浓度的变化重建了百年尺度长江口海域浮游植物生产力的变化,表明1980年代以来长江口附近海域浮游植物生产力明显升高,这与人类活动导致长江输入的营养盐浓度増加有关。王江涛等[4]研究了近50年营养盐变化对长江口海域浮游植物群落结构的影响,结果表明,1980年代以来,长江口硅藻比例降低,甲藻比例升高;引发这一变化的原因是人类活动导致氮营养盐过量输入以及N/P比升髙。Duan等[5]通过研究沉积物中多种生物标志物重建了闽浙泥质区百年尺度浮游植物群落结构的变化,结果表明,1950年代以来,该区域硅藻比例显著升高,主要是因为沿岸上升流提供了丰富的硅酸盐。Cao等[6]运用总有机质与生物标志物分析的方法,重建了百年尺度东海陆架区不同来源有机质比值变化,结果表明,1980年代以来,输入到东海的陆源物质逐年降低,主要是因为各种大坝,特别是三峡大坝的拦截作用。综上可得,目前已有的研究多是聚焦于单一人类活动或自然因素对生态环境的影响,对多种人类活动和自然因素对浮游植物生产力、群落结构和陆源输入相对贡献综合影响的研究还较少。
本文运用总有机质与多种生物标志物分析的手段,选择位于东海长江口泥质区的柱状样DH3-1进行研究。通过探讨浮游植物生物标志物(菜子甾醇、甲藻甾醇、C37长链烯酮)的含量及相对比例、陆源贡献指标(δ13CTOC、TMBR(Terrestrial and Marine Biomarker Ratio)、BIT(Branched and Isoprenoid Tetraether))的年代记录,探究DH3-1站位浮游植物生产力、群落结构和陆源输入相对贡献的时间变化格局;并结合前人的研究成果,分析人类活动与自然因素产生的综合影响。
1 实验样品与方法
1.1 实验样品的采集
本研究于2010年6月搭载国家自然科学基金东海春季共享航次,由科学三号调查船通过箱式采样器采集,插管获得柱状样DH3-1。此柱状样长50 cm,每隔2 cm取样,共得25个样品,样品置于-20℃保存。采样站位如图1所示。
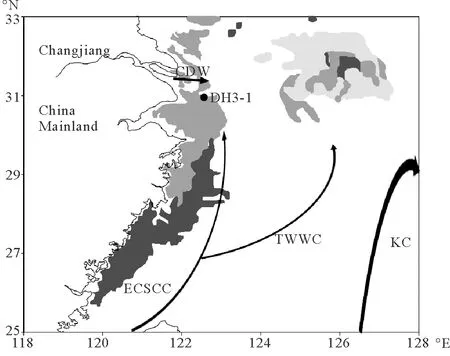
(阴影部分为泥质区,站位DH3-1;CDW:长江冲淡水;KC:黑潮;TWWC:台湾暖流;ECSCC:东海沿岸流。The shaded areas represent mud depositions. CDW: Changjiang Diluted Water; KC: Kuroshio Current; TWWC: Taiwan Warm Current; ECSCC: the East China Sea Coastal Current.)
图1 采样站位(DH3-1)及东海主要流系(夏季表层)示意图[7]
Fig.1 Schematic illustration of the core site (DH3-1) and the average position of currents in the East China Sea (surface layer in summer)[7]
1.2 实验方法
1.2.1210Pb 定年 柱状样DH3-1通过210Pb定年,在台湾中央研究院地球科学研究所完成,用γ分析方法直接测定210Pb及其214Pb(226Ra)。分析仪器为美国ORTEC生产的高纯锗探测器(Ortec HPGe GEM/Lo-Ax/GMX)。利用作图法,即CIC(Constant Initial210Pb Concentration)模式计算该站位的沉积速率,约为1.8 cm·a-1,选取2010年为测年零点,时间跨度约为27年(1983—2010年)。
1.2.2 TOC及δ13CTOC分析 沉积物样品经冷冻干燥、研磨后,称取1 g左右加入玻璃瓶中,滴加4 mol/L 的HCl溶液,去除无机碳;震荡、超声、离心后去除上清液,加入5~7 mL Milli-Q水。重复数次直至检测上清液为近中性。将洗为近中性的样品置于55 ℃的烘箱中烘干,烘干后放入干燥器中平衡24 h,之后研磨使其均质化。
用锡杯准确称取适量去除无机碳的样品,通过CHN元素分析仪(Thermo Flash 2000)测定总有机碳(TOC)含量(TOC测定的标准偏差为±0.02 wt%(n=6));用锡杯准确称取适量已去除无机碳的样品,通过同位素质谱仪(Thermo Delta V mass spectrometer),在连续流模式下测定δ13CTOC(δ13CTOC测定的标准偏差为±0.2‰(n=6))。
1.2.3 生物标志物分析 生物标志物的分析主要分为样品预处理及仪器分析两个步骤。
(1)样品预处理:沉积物样品经冷冻干燥、研磨后,称取5 g左右加入Teflon瓶中,加入CH2Cl2/CH3OH(v/v=3∶1)萃取液和三种内标(19醇24氘烷,n-C46GDGT与19酸)。震荡,超声,离心,重复萃取4次后N2吹干富集。加入6% KOH的CH3OH溶液进行过夜碱水解。加入正己烷萃取4次后N2吹干富集。然后进行硅胶柱分离,用正己烷淋洗得到非极性组分(烷烃),再用CH2Cl2/CH3OH(v/v =95∶5)混合试剂淋洗得到中性组分(醇类、烯酮和GDGTs)。烷烃组分吹干、加异辛烷定容后上机分析。中性组分平均分成两份,一份吹干后,加CH2Cl2和BSTFA试剂进行衍生化反应(70 ℃,1 h)后上机分析,用于测定甾醇与烯酮组分。另一份过0.45 μm PTFE滤膜,吹干、定容后上机分析测定GDGTs组分。碱水解后的正己烷萃取剩余液中加入过量6 mol/L HCl溶液,再加入正己烷萃取4次后N2吹干富集;加入HCl/CH3OH(v/v =5∶95)溶液进行酯交换反应(70 ℃,12 h)。加入约2 mL Milli-Q水,用正己烷萃取4次后N2吹干富集。吹干后加异辛烷定容后上机分析,用于测定脂肪酸组分。
(2)仪器分析:烷烃、甾醇、烯酮、脂肪酸组分使用气相色谱仪(GC,Agilent 7890A)进行定量分析。使用HP-1型毛细管柱(50 m×0.32 mm×0.17 μm),不分流进样;载气为H2,流速为1.3 mL/min。FID检测器温度、进样口温度和柱箱初始炉温分别设定为300、300和80 ℃。
GDGTs组分使用高效液相色谱-质谱联用仪(HPLC-MS, Agilent 1200/Waters-Quattro Ultima)进行定量分析。液相部分,使用正相键合色谱柱(150 mm×2.1 mm),柱温为30 ℃,流动相为正己烷与异丙醇的混合溶液。采用梯度洗脱,设置流速为0.2 mL/min。质谱部分,使用正相色谱柱与大气压化学电离源(APCI,atmospheric pressure chemical ionization),采用单离子扫描法。参数设定条件如下:喷雾器电压为60 psi,温度为400 ℃;雾化氮气流速为600 L/h;锥孔器80 L/h;APCI源温度为95 ℃,探针温度为550 ℃。
2 结果与讨论
2.1 海源生物标志物含量与浮游植物生产力的变化
图2(a)展示了过去近30年间(约1983—2010年),DH3-1站位TOC含量与各海源生物标志物含量及其总量的变化。TOC含量的变化范围是0.24%~0.75%,平均值为0.47%;约1992年以前,TOC含量无明显变化;约1992年以后开始增加,出现明显波动。海源生物标志物中,菜子甾醇含量的变化范围是99~655 ng·g-1,平均值为282 ng·g-1;甲藻甾醇含量的变化范围是167~929 ng·g-1,平均值为549 ng·g-1;约1983—2003年,长链烯酮含量的变化范围是11~84 ng·g-1,平均值为35 ng·g-1;约2004—2010年,长链烯酮含量低于仪器检出限。三种浮游植物生物标志物含量之和的变化范围是279~1 533 ng·g-1,平均值为857 ng·g-1。泉古菌醇含量的变化范围是294~1 076 ng ·g-1,平均值为552 ng·g-1。
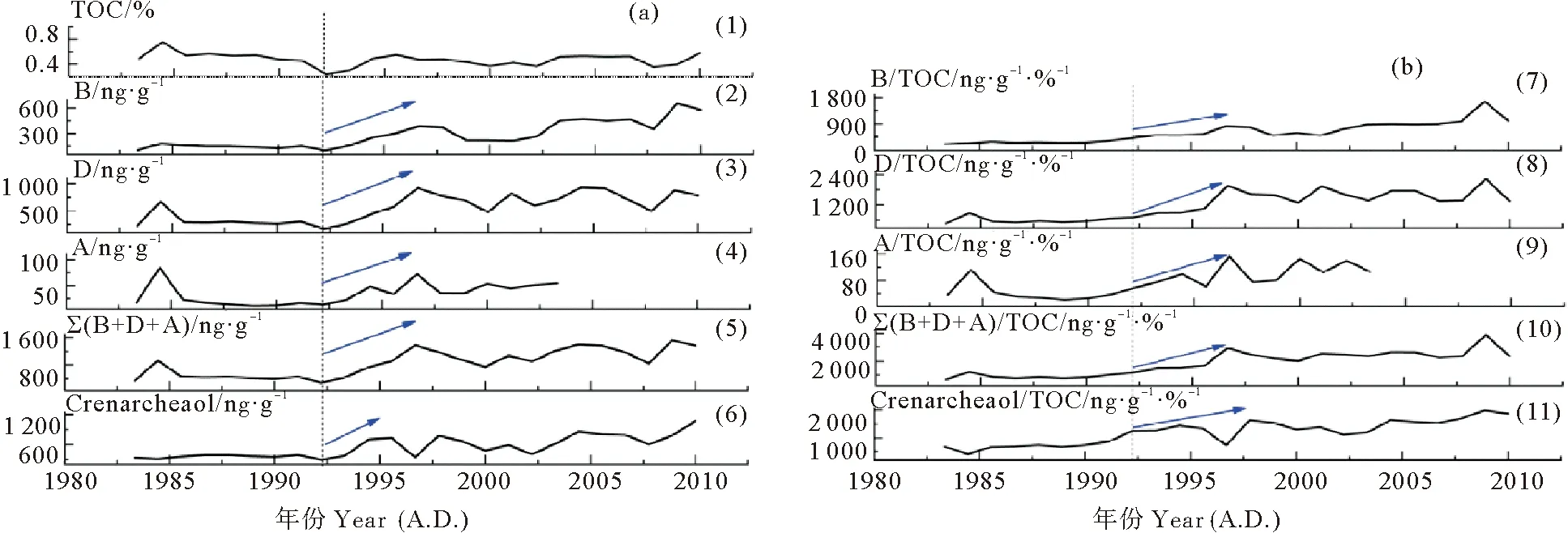
((1)TOC:总有机碳;(2)B:菜子甾醇含量;(3)D:甲藻甾醇含量;(4)A:C37长链烯酮含量;(5)∑(B+D+A):菜子甾醇+甲藻甾醇+C37长链烯酮总量;(6)Crenarcheaol:泉古菌醇含量;(7)B/TOC:菜子甾醇含量与TOC比值;(8)D/TOC:甲藻甾醇含量与TOC比值;(9)A/TOC:C37长链烯酮含量与TOC比值;(10)∑(B+D+A)/TOC:菜子甾醇+甲藻甾醇+C37长链烯酮总量与TOC比值;(11)Crenarcheaol /TOC:泉古菌醇含量与TOC比值。虚线往右代表发生明显变化的时间。蓝色箭头代表变化的趋势。(1) TOC: total organic carbon; (2) B: brassicasterol content; (3) D: dinosterol content; (4) A: C37alkenones content; (5) ∑(B+D+A): brassicasterol + dinosterol + C37alkenones contents; (6) Crenarcheaol: crenarcheaol content; (7) B/TOC: TOC-normalized brassicasterol content; (8) D/TOC: TOC-normalized dinosterol content; (9) A/TOC: TOC-normalized C37alkenones content; (10) ∑(B+D+A)/TOC: TOC-normalized brassicasterol + dinosterol + C37alkenones contents; (11) Crenarcheaol/TOC: TOC-normalized crenarcheaol content. Dashed lines represent the time at which major changes of biomarkers started. Blue arrows represent the trend of changes.)
图2 柱状样DH3-1海源生物标志物含量(ng·g-1)(a)及与其TOC比值(ng·g-1·%-1)(b)的变化
Fig.2 Marine biomarker contents (ng·g-1) (a) and TOC-normalized biomarker contents (ng·g-1·%-1) (b) in the core DH3-1
生物标志物含量的变化会受到生产力变化、降解作用、沉积速率等因素的影响[8]。将各种生物标志物的含量与TOC做比值,可以消除成岩作用、沉积速率与粒度的影响(见图2(b))。从图中可以看出,三种浮游植物生物标志物含量、生物标志物含量/TOC比值的变化趋势基本一致。由此可以看出,在过去近30年间,浮游植物生物标志物含量的变化主要受生产力变化影响。
虽然生物标志物含量并不能严格代表其来源藻类的绝对数量,但是其变化可以代表对应藻类数量的相对变化[9],这是用生物标志物含量的变化重建生产力变化的基础。菜子甾醇、甲藻甾醇、C37长链烯酮分别主要由硅藻、甲藻、颗石藻产生,因此,其含量的变化可以分别用来指示硅藻、甲藻、颗石藻生产力的变化[10];总量的变化可以用来指示浮游植物总生产力的变化。从图2中可以看出,菜子甾醇、甲藻甾醇、C37长链烯酮含量及其含量总和均呈现增加趋势,这表明在过去近30年间,DH3-1站位的硅藻生产力、甲藻生产力、颗石藻生产力与浮游植物总生产力均呈现上升趋势。DH3-1站位生产力的重建结果与前人在该海域的研究结果具有较好的一致性。Xing等[11]运用生物标志物法重建了位于东海近岸泥质区的五个站位(CJ43,DH5-1,DH6-3,32#,34#)浮游植物生产力在百年尺度上的变化;结果表明:近百年尤其是1980年代以来,五个站位浮游植物生产力的变化均呈现上升趋势。
2.2 浮游植物生物标志物比例与浮游植物群落结构的变化
图3表示了DH3-1站位过去近30年间浮游植物生物标志物相对比例(每种生物标志物与总生物标志物含量之比)的变化。菜子甾醇相对比例的变化范围是0.19~0.43,平均值为0.32;甲藻甾醇相对比例的变化范围是0.57~0.76,平均值为0.64;C37长链烯酮相对比例的变化范围是0.03~0.09,平均值为0.05。
由于生物标志物母源细胞的产生数量及其在环境中的留存效率不确定[17],所以生物标志物的比例不能严格代表其来源藻类的群落占比,但是其比例的变化可以指示其来源藻类群落占比的变化。如图3所示,约1992年以前,硅藻、甲藻的相对比例没有明显变化。约1992—2001年,硅藻相对比例降低,甲藻相对比例升高;约2001年以后,两者呈现出相反的变化趋势,即硅藻相对比例升高,甲藻相对比例降低。颗石藻相对比例一直在相对低值波动较低且无明显变化规律。
DH3-1站位的群落结构重建结果与前人在该海域的研究结果具有较好的一致性。Xing等[11]通过生物标志物法重建了东海近岸泥质区的五个站位(CJ43,DH5-1,DH6-3,32#,34#)百年尺度上浮游植物群落结构的变化,结果表明:东海不同位置硅藻与甲藻相对比例的变化趋势大致可以分为三种类型:①硅藻比例降低,甲藻比例升高;②硅藻比例升高,甲藻比例降低;③硅藻甲藻比例交替增减。DH3-1站位群落结构的重建结果符合“硅藻甲藻比例交替增减”的特征,即,硅藻比例先降低后升高,甲藻比例先升高后降低。对比DH3-1站位与CJ43等五个站位的位置与群落结构的变化,可以初步得出:在东海不同区域,硅藻与甲藻相对比例的变化明显不同(见图4)。在泥质区北部及外侧,呈现硅藻比例降低,甲藻比例升高(站位CJ43,DH5-1)和硅藻甲藻比例交替增减(站位DH3-1,DH6-3)的变化;在泥质区内侧,呈现硅藻比例升高,甲藻比例降低(站位32#,34#)的变化。又如,王云龙等[18]直接统计了长江口及附近海域2000—2003年20个监测点春季浮游植物的数量与种类的水平分布与变化情况。结果显示:从2000—2003年,硅藻比例依次为:78.78%,75%,75.61%,76.09%;甲藻比例依次为:12.12%,22.73%,12.20%,10.87%,即,以2001年为分界,呈现硅藻比例先下降后上升、甲藻比例先上升后下降的变化特征。这一结果表明,长江口邻近海域群落组成的镜检结果与本文的重建结果具有较为一致的变化特征。
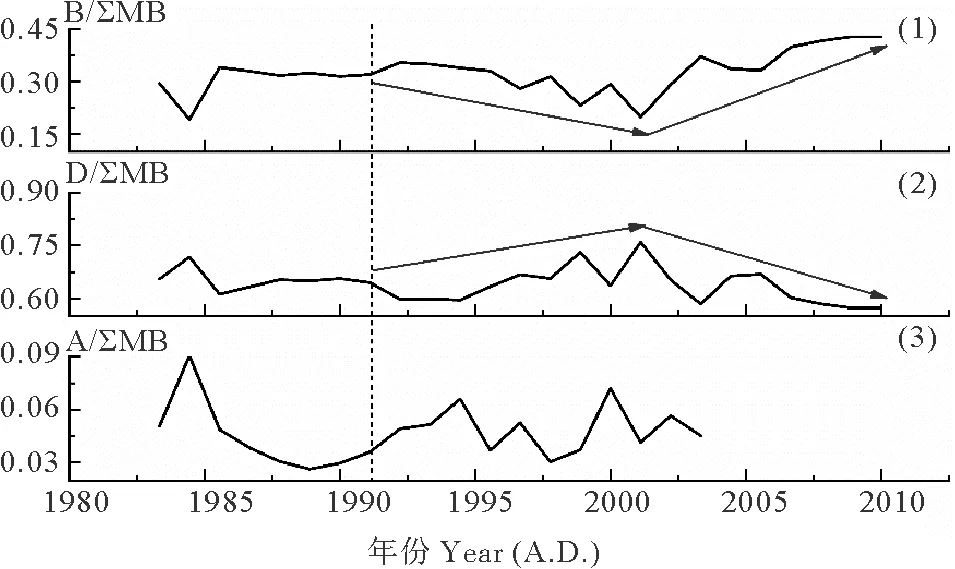
((1)B/∑MB:菜子甾醇比例;(2)D/∑MB:甲藻甾醇比例;(3)A/∑MB:C37长链烯酮比例;B:菜子甾醇含量;D:甲藻甾醇含量;A:C37长链烯酮含量;∑MB:浮游植物生物标志物总量(菜子甾醇+甲藻甾醇+C37长链烯酮)。虚线往右代表发生明显变化的时间。蓝色箭头代表变化的趋势。(1) B/∑MB: the ratio between brassicasterol and the sum of three biomarkers; (2) D/∑MB: the ratio between dinosterol and the sum of three biomarkers; (3) A/∑MB: the ratio between C37alkenones and the sum of three biomarkers; B: brassicasterol content; D: dinosterol content; A: C37alkenones content; ∑MB: the sum of three phytoplankton biomarkers (brassicasterol + dinosterol + C37alkenones). Dashed lines represent the time at which major changes of biomarkers started. Blue arrows represent the trend of changes.)
图3 柱状样DH3-1浮游植物生物标志物与总生物标志物含量之比的变化
Fig.3 Marine phytoplankton biomarker ratios in the core DH3-1
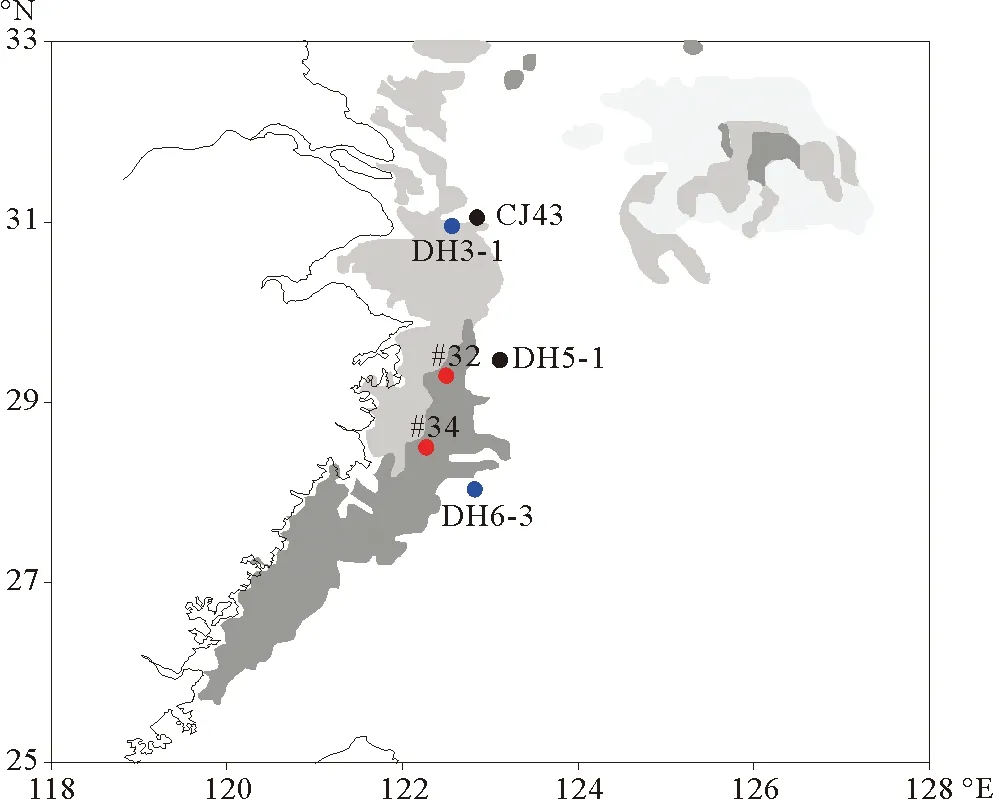
(站位CJ43,DH5-1,DH6-3,32#,34#信息引用自文献[11]。Site information for CJ43,DH5-1,DH6-3,32#,34# is cited from reference[11].)
图4 东海硅藻与甲藻相对比例呈现不同变化特征的站位分布
Fig.4 The distribution of sites with different ratios of diatoms and dinoflagellates
前人研究表明,营养盐结构的改变会对浮游植物群落结构产生显著影响[19]。Si、P含量高的情况下,Si∶N增大而N∶P减小,硅藻更具竞争优势[20];N含量尤其是DIN含量高的情况下,Si∶N减小而N∶P增大,甲藻更具竞争优势[21]。根据杨颖[15]等统计的1984—2014年30年期间长江口邻近海域中营养盐含量的数据,可以发现:过去近30年期间,长江口海域水质中N∶P 比值在不同年份存在明显的转折变化。其中,约1992年以前,N∶P基本无明显的变化趋势,而2000年以后N∶P总体低于1987—2000年间的值。N∶P的这一变化较好地解释了本研究浮游植物群落结构的演替规律,即约1992年以前,硅藻、甲藻的相对比例没有明显变化,而约2001年以后,硅藻相对比例升高,甲藻相对比例降低。
营养盐结构的上述变化则可能是由于不同年份,驱动其变化的机制不同。长江每年都向东海输送大量的营养盐,是东海营养盐的主要来源。长江流域地区复杂多变的人类活动使长江输入东海的营养盐含量明显改变,致使东海营养盐结构发生变化,从而导致东海浮游植物群落结构改变。特别是1980年以来,长江流域大规模修建水坝、开展水土保持工程等人类活动则导致东海Si输入量明显减少[22]。由于水坝的拦截作用会导致长江入海的沉积物通量明显减少[23],从而导致Si的入海通量减少[24],而N的入海通量却并没有显著减少。这是因为长江流域水库大多属于“拦沙不拦水”型水库[25],对P、Si(多以颗粒态存在)的拦截较为明显,对N(多以溶解态存在)的拦截作用较弱。除了人类活动,东海沿岸上升流也会对营养盐结构产生显著影响。上升流可以促进深层水向上涌动,为上层水体带来更多有机物[26],尤其是输入了高含量的Si、P营养盐,从而导致营养盐结构呈现Si∶N增大,N∶P减小的变化,导致群落结构向硅藻比例增大的趋势演变。Chen等[27]研究了渤、黄、东海不同季节表层海水温度、盐度、氮磷硅营养盐浓度分布,结果表明:东海沿岸存在的高硅酸盐浓度区,与沿岸上升流的分布区域基本一致。硅营养盐浓度高值区的存在同时也证明了上升流的存在。由于上升流带来的深层水温度较低,因此,可以将海水次表层温度作为判定上升流是否存在的指标。重建DH3-1站位次表层海水温度(TEX86-T)的变化,以此判定DH3-1站位在过去约30年间是否存在上升流(见图5)。重建结果显示,约1999年以后,DH3-1站位的海水次表层温度呈现降低趋势,表明约1999年以后研究区域有明显的上升流存在。
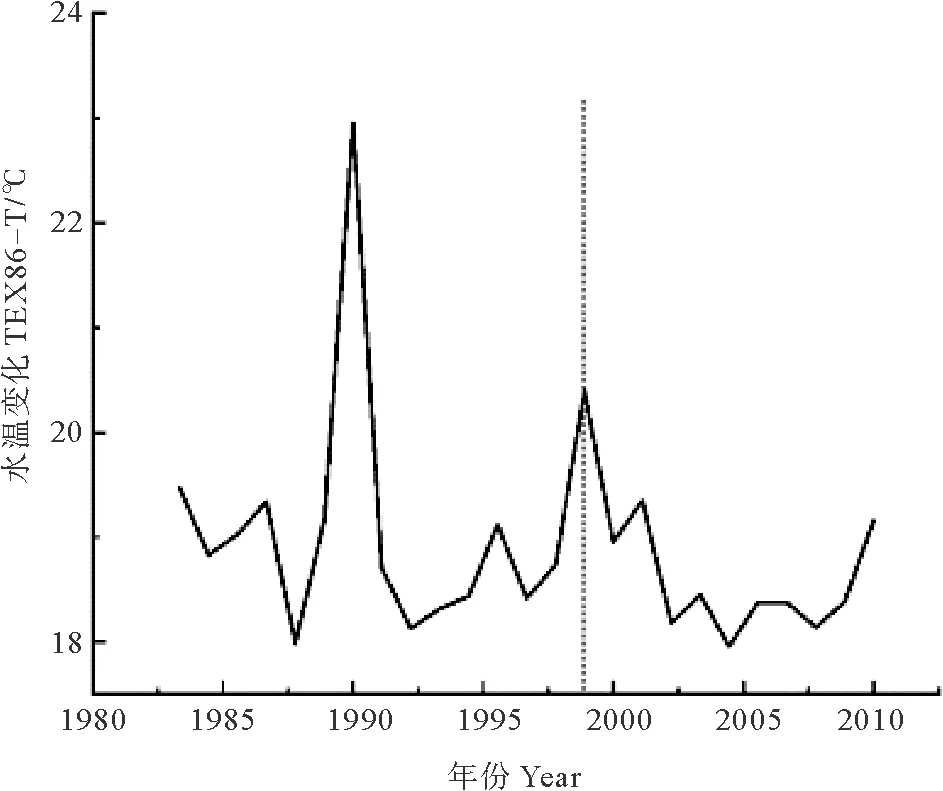
(虚线代表发生明显变化的时间。The dashed line represents the time at which major changes started.)
图5 DH3-1站位次表层海水温度变化
Fig.5 TEX86-T of core DH3-1
综上可得,人类活动和上升流(自然因素)会对营养盐结构产生截然不同的影响。人类活动加剧会导致营养盐结构呈现Si∶N减小,N∶P增大的变化;上升流则会导致营养盐结构呈现Si∶N增大,N∶P减小的变化。因此,DH3-1站位硅藻与甲藻比例交替变化,可能是因为不同年份人类活动与自然因素的作用强度不同。1992—2001年,DH3-1站位硅藻比例下降、甲藻比例上升,可能是因为人类活动的影响大于自然因素;2001年以后,DH3-1站位硅藻比例上升、甲藻比例下降,可能是因为自然因素的影响大于人类活动。通过对比Xing[11]等提出的东海近岸不同区域硅藻与甲藻比例变化的驱动机制与DH3-1站位硅藻与甲藻比例变化的影响因素,可以发现:在长江口附近,硅藻与甲藻比例变化主要受人类活动驱动;但是在该海域的小范围内,某些年份自然因素仍可以产生显著影响。
从图2中可以看出,DH3-1站位的颗石藻比例一直处于低值。前人研究表明,长江口及其邻近海域的浮游植物群落主要由沿岸广温型的硅藻和甲藻组成[28],这与本文的研究结果一致。造成这种群落结构分布主要是由于颗石藻生长的环境与硅藻、甲藻明显不同,高盐、高温、低营养盐环境更利于颗石藻生长[29]。而且,现代调查显示,东海近岸的颗石藻比例随着离岸距离和水深的增加而增大[30]。近30年来,人类活动加剧导致东海营养盐水平显著提升,且DH3-1站位位于东海近岸,这些因素都导致DH3-1站位颗石藻相对比例一直较低。
2.3 陆源生物标志物含量与陆源输入相对贡献的变化
图6(a)表示了DH3-1站位过去近30年间TOC含量与各陆源生物标志物含量及其总量的变化。其中,C27+C29+C31长链正构烷烃含量的变化范围是327~1 164 ng·g-1,平均值为531 ng·g-1。C24+C26+C28+C30一元正构饱和直链脂肪酸含量的变化范围是0.95~3.03 μg·g-1,平均值为1.81 μg·g-1。支链GDGTs含量的变化范围是27~92 ng·g-1,平均值为56 ng·g-1。将各种陆源生物标志物的含量与TOC做比值,可以消除成岩作用、沉积速率与粒度的影响,如图6(b)所示。三种陆源生物标志物含量、生物标志物含量/TOC比值的变化趋势基本一致。由此可以看出,在过去近30年间,三种陆源生物标志物含量的改变主要是由于受物质输入的影响,而不受降解等其他因素的影响。
长链正构烷烃以及一元正构饱和直链脂肪酸主要产生于陆源高等植物表层叶蜡[31],可以通过风尘及河流颗粒物输入海洋。沉积物中长链正构烷烃(以C27、C29、C31为主)记录可以反演陆源高等植被有机质的输入[32];C24~C36一元正构偶数碳饱和直链脂肪酸同样可以指示陆源有机质输入[33]。支链GDGTs主要由土壤厌氧细菌产生,通过河流输入海洋,其含量可以用来指示陆源土壤有机质输入[34]。
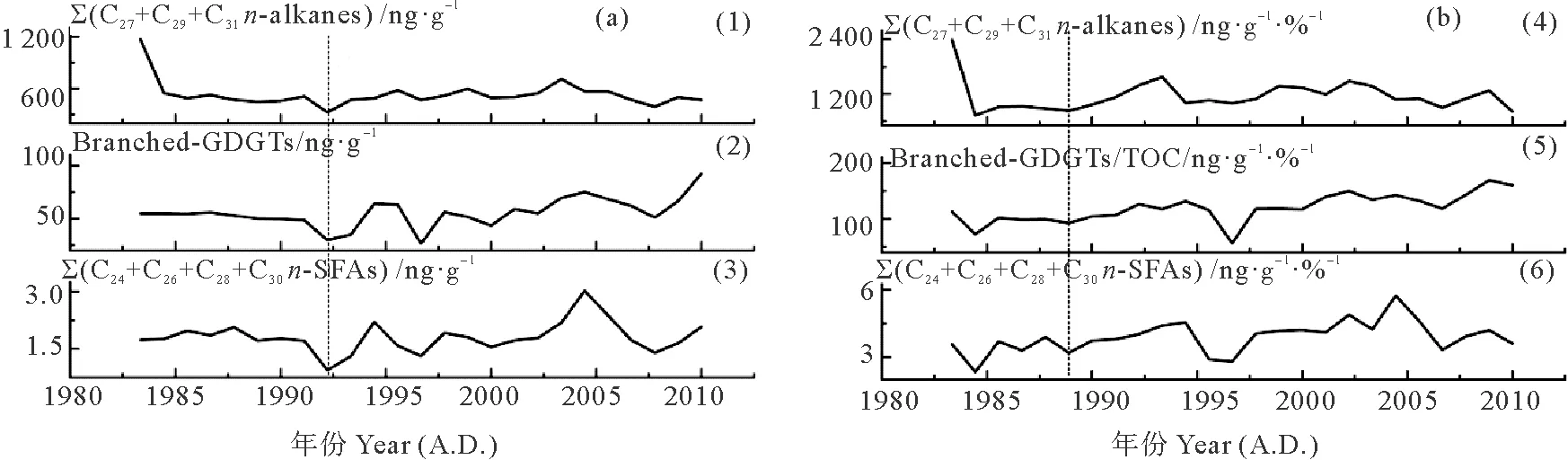
(1)∑(C27+C29+C31n-alkanes):C27+C29+C31长链正构烷烃含量;(2)Branched-GDGTs:支链GDGTs含量;(3)∑(C24+C26+C28+C30n-SFAs):C24+C26+C28+C30一元正构饱和直链脂肪酸含量;(4)∑(C27+C29+C31n-alkanes)/TOC:C27+C29+C31长链正构烷烃含量与TOC 比值;(5)Branched-GDGTs/TOC:支链GDGTs含量与TOC比值;(6)∑(C24+C26+C28+C30n-SFAs)/TOC:C24+C26+C28+C30一元正构饱和直链脂肪酸含量与TOC比值。虚线往右代表发生明显变化的时间。(1) C27+C29+C31long-chainn-alkanes contents; (2) Branched-GDGTs contents; (3) C24+C26+C28+C30n-saturated fatty acids contents; (4) TOC-normalized C27+C29+C31n-alkanes contents; (5) TOC-normalized branched-GDGTs contents; (6) TOC-normalized C24+C26+C28+C30n-SFAs contents. Dashed lines represent the time of at which major changes started. Blue arrows represent the trend of changes.)
图6 柱状样DH3-1陆源生物标志物含量(ng·g-1或μg·g-1) (a) 及与TOC比值 (ng·g-1·%-1或μg·g-1·%-1)(b)的变化
Fig.6 Terrestrial biomarker contents (ng·g-1or μg·g-1)(a) and TOC-normalized biomarker contents (ng·g-1·%-1or μg·g-1·%-1)(b) in the core DH3-1
从图6中可以看出,三种陆源生物标志物含量具有相似的变化特点,即约1992年以前,无明显变化;约1992—2004年,波动明显,稍有增加;约2004年以后,明显减少。这表明约1992年以前,陆源有机质输入量没有明显变化;约1992—2004年,稍有增加。约2004年以后明显减少。
为了区分海源与陆源有机质的相对比例,指示陆源输入的相对贡献,利用不同来源生物标志物含量的比值构建 TMBR指标[35]和BIT指标[34]。TMBR指标是将指示陆源有机质的长链正构烷烃含量(C27+C29+C31n-alkanes)与指示海源有机质的浮游植物生物标志物含量(菜子甾醇+甲藻甾醇+长链烯酮)作比值,计算公式为:TMBR = ∑(C27+C29+C31n-alkanes)/[∑(C27+C29+C31n-alkanes)+ ∑(菜子甾醇+甲藻甾醇+长链烯酮)]。TMBR的取值范围为0~1。TMBR为0时,有机质全部为海源输入;TMBR为1时,有机质全部为陆源输入。BIT指标是将指示陆源土壤有机质的三种支链 GDGTs含量(I+II+III)与指示海源有机质的泉古菌醇(IV)含量作比值,计算公式为:BIT=(I+II+III)/(I+II+III+IV)。BIT的取值范围为0~1。BIT为0时,有机质全部为海源输入;BIT为1时,有机质全部为陆源输入。
除了TMBR与BIT指标,δ13CTOC也可以用来评估陆源有机质的相对贡献,通常而言,陆源有机质δ13CTOC比海源有机质δ13CTOC更负[36]。
图7表示了DH3-1站位过去近30年间陆源输入相对贡献的变化。其中,δ13CTOC的变化范围是-23.17‰~-22.71‰,平均值为-22.80‰。TMBR的变化范围是0.21~0.77,平均值为0.45。BIT的变化范围是0.07~0.15,平均值为0.09。从图中可以看出,过去近30年间,δ13CTOC整体变正;TMBR、BIT整体减小;这表明在过去近30年间,不同方式输入的陆源有机质的相对贡献均呈现降低趋势。
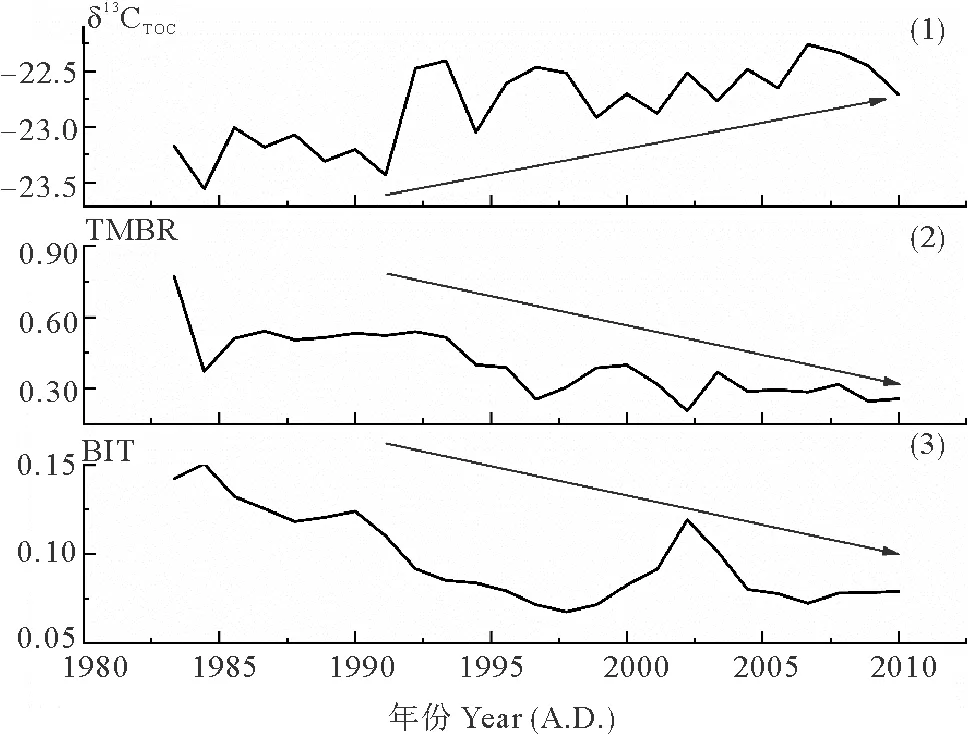
((1)δ13CTOC;(2)TMBR(=∑(C27+C29+C31n-alkanes)/[∑(C27+C29+C31n-alkanes)+ ∑(菜子甾醇+甲藻甾醇+长链烯酮)];(3)BIT=支链GDGTs/(支链GDGTs +泉古菌醇)。蓝色箭头代表变化的趋势。(1) δ13CTOC; (2) TMBR(=∑(C27+C29+C31n-alkanes)/[∑(C27+C29+C31n-alkanes)+∑(brassicasterol + dinosterol + C37alkenones)]; (3)BIT=branched-GDGTs/(branched-GDGTs + crenarcheaol). Blue arrows represent the trend of changes.)
图7 柱状样DH3-1陆源输入相对贡献指标的变化
Fig.7 Terrestrial relative contribution index in the core DH3-1
DH3-1站位陆源输入相对贡献的重建结果与前人在该海域的研究结果具有较好的一致性。Cao等[6]通过研究总有机质与生物标志物重建了东海近岸三个站位(DH5-1,DH6-2,DH6-3)百年尺度上陆源输入相对贡献的变化情况;重建结果表明:近百年来,尤其是1980年代以后,三个站位的陆源输入相对贡献均明显降低。
分析导致陆源输入相对贡献变化的原因,需要综合考虑影响陆源有机质与海源有机质输入的原因。一是海源有机质输入方面:近30年以来,工农业迅速发展导致氮磷类化肥使用量剧增,使得东海营养盐含量迅速增加,加之沿岸上升流的影响,导致海洋初级生产力提高,海源有机质输入量增加。二是陆源有机质输入方面:1980年代以来,长江流域大规模修建水坝与开展水土保持工程等人类活动,造成长江入海的沉积物通量明显减少,导致通过长江向东海输入的陆源有机质明显减少[37]。但是,由于近百年来东亚冬季风增强[38],搬运了更多的陆源物质输入海洋[39],导致通过大气向东海输入的陆源有机质明显增加。人类活动和季风搬运(自然因素)会对陆源有机质输入量产生截然不同的影响,即人类活动加剧会导致陆源有机质输入量减少,而季风搬运增强则会导致陆源有机质输入量增加。
从图7中可以看出,DH3-1站位陆源生物标志物的含量在约2004年前后交替变化,即约1992—2004年稍有增加,约2004年以后明显减少。这可能是因为不同年份人类活动与自然因素的作用强度不同,从而导致陆源有机质输入量呈现不同的变化。约1992—2004年,陆源有机质输入量稍有增加,可能是因为自然因素的影响大于人类活动;约2004年以后,陆源有机质输入量明显减少,可能是因为人类活动的影响大于自然因素。
图2的结果则表明,过去近30年间,DH3-1站位海源有机质输入量整体增加,这主要是因为近30年以来,工农业迅速发展导致氮磷类化肥使用量剧增,使得东海营养盐含量迅速增加,加之沿岸上升流的影响,导致DH3-1站位的初级生产力提高。
综上可知,在约2004年以前,陆源有机质与海源有机质含量均呈现增加的趋势,但是由于两者的控制因素存在差异,导致陆、海源有机质增加的程度不一样。海源有机质增加的比重大于陆源有机质,导致陆源有机质输入的相对贡献减少。约2004年以后,海源有机质含量呈现增加的趋势,陆源有机质含量呈现减少的趋势,导致陆源有机质输入的相对贡献减少。
3 结论
(1)菜子甾醇、甲藻甾醇、长链烯酮含量变化的记录显示,在过去的近30年间,DH3-1站位浮游植物生产力呈现上升趋势。
(2)约1992年以来,DH3-1站位的群落结构发生明显改变。约1992—2001年期间硅藻比例下降、甲藻比例上升;约2001年以后,硅藻比例上升、甲藻比例下降。
(3)约1992年以来,DH3-1站位的陆源输入相对贡献发生明显改变。δ13CTOC、TMBR、BIT三个指标指示的陆源输入相对贡献均呈现减小趋势。长链正构烷烃、一元正构饱和直链脂肪酸、支链 GDGTs含量变化的记录显示,约1992—2004年期间,陆源有机质输入量增加,与此同时,海源有机质输入量也增加且增加比重大于陆源有机质,所以陆源输入相对贡献减小;约2004年以后,陆源有机质输入量减少,海源有机质输入量依然增加,所以陆源有机质输入的相对贡献减小。
致谢:本文所使用的210Pb定年数据由台湾中央研究院地球科学研究所陈蔚芳老师提供,作者对此表示诚挚谢意。
