USP7和Ki-67在大肠癌组织中的表达及其临床意义 ①
2020-12-18高雪原齐广莹苏如葵刘家麒郑东妮廖作威
高雪原,齐广莹,苏如葵,刘家麒,郑东妮,廖作威③
(1.北海市人民医院普通外科二区,广西 北海 536000;2. 桂林医学院广西肿瘤免疫与微环境调控重点实验室,广西 桂林 541199)
在全球范围内,大肠癌(Colorectal Carcinoma, CRC)作为一种常见的消化道恶性肿瘤,一直以来严重地威胁着全人类的健康。近年来,中国的大肠癌新发病例和死亡病例已分别超过了27万和13万[1]。目前我国大多数大肠癌患者确诊时已系进展期,因而,急需我们去探索新的肿瘤靶点,为大肠癌的诊断治疗和预后评估带来新的方向和希望。
泛素特异性蛋白酶7(Ubiquitin Specific Protease 7, USP7)是去泛素化酶庞大家族中的一员,最初是在研究单纯疱疹病毒ICP0蛋白时发现的,近年研究发现USP7与人体内的癌基因、抑癌基因以及致瘤病毒的相关基因均有相互作用,影响了恶性肿瘤的发生和进展[2]。当前,在恶性肿瘤的发生机制研究中,许多学者提出了基因协同作用假说,认为在恶性肿瘤发生、发展和浸润、转移的过程中,至少存在两个或者两个以上的功能各异但异常激活和/或失调的基因,它们各自发挥着不同作用,并有可能在时间和空间上相互配合,协同并促进了正常细胞的癌变。因此,本研究旨在观察USP7和Ki-67在人大肠癌组织中的表达,以及两者相关病理特征的关联性和临床意义,为发现新的大肠癌分子治疗靶点和肿瘤标记物提供临床依据,以及为进一步探索USP7的分子作用机制奠定基础。
1 资料和方法
1.1 一般资料
选取本院2013年1月至2015年1月期间确诊为大肠癌的手术标本组织90例(存档石蜡块)作为实验组;在这些确诊病例中,随机选取20例癌旁正常黏膜组织作为对照组。所有石蜡组织均具备完整的临床病例资料,其临床病理特征包括年龄、性别、组织分化程度、淋巴结转移等。所有患者术前均未接受放化疗、靶向治疗及肿瘤免疫治疗等,术中均接受规范根治性手术切除,切除肠管组织上下切缘均为阴性。
1.2 方法
所有的手术标本均用中性福尔马林固定、脱水、石蜡包埋保存。标本组织连续切片厚度约为4 μm,随后进行免疫组织化学染色实验(Immunohistochemistry, ICH)。兔多克隆抗USP7抗体(Abcam, ab4080, 1:1 000),鼠单克隆抗Ki-67即用型抗体(中国迈新生物有限公司, Kit-0005)。组织切片经EDTA抗原修复和内源性过氧化物酶阻断剂处理完成后,滴加一抗放置于4 ℃冰箱内过夜,次日滴加二抗后置入37 ℃电热恒温箱内孵育,DAB显色,脱水,透明,封片。
1.3 观察指标
据阳性细胞所占比率及染色强度分别进行定性和分组。分级:组织切片内无阳性细胞或阳性细胞<5%视为阴性(-);组织切片内阳性细胞占5%~19%视为弱阳性(+);组织切片内阳性细胞占20%~49%视为中度阳性(++);组织切片内阳性细胞≥50%视为强阳性(+++)。分组:USP7和Ki-67的阴性(-)及弱阳性(+)均被视为低表达组;USP7和Ki-67的中度阳性(++)及强阳性(+++)均被视为高表达组。
1.4 统计学方法
采用统计学软件SPSS 22.0进行数据分析,两组间比较及独立样本计数资料差异性分析采用χ2检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 USP7和Ki-67在大肠癌组织和癌旁正常组织中的表达情况
本实验通过ICH实验方法分别检测了USP7和Ki-67在大肠癌组织与癌旁正常组织情况。在随机选取的20例癌旁正常组织中,USP7低表达为20例,高表达为0例;而在90例大肠癌组织中,USP7低表达为34例,高表达为56例。同理,ki-67在20例癌旁正常组织中,低表达为20例,高表达为0例;在90例大肠癌组织中,低表达为39例,高表达为51例。说明USP7表达与Ki-67表达在正常组织和大肠癌组织之间均有显著性差异(P<0.01)。
2.2 USP7和Ki-67在大肠癌组织中的表达关联性
依据实验结果,USP7和Ki-67在大肠癌组织中的表达具有一定的相关性。在90例大肠癌组织中,将USP7表达与Ki-67表达相互作比较,应用卡方检验,结果提示USP7和Ki-67在大肠癌组织中的表达呈现出正相关,且差异性具有统计学意义(P<0.01)。详见表1。

表1 USP7和Ki-67在大肠癌组织中的表达关联性
2.3 USP7和Ki-67在大肠癌组织中的表达与临床病理学特征的关联性
分别将USP7和Ki-67进行了与其相关的临床病理学特征关联性的检测。在90例大肠癌组织中,USP7高表达、Ki-67高表达均与临床病理学特征中的肿瘤组织分化程度、淋巴结转移具有相关性,且差异性具有统计学意义(P<0.01)。详见表2。
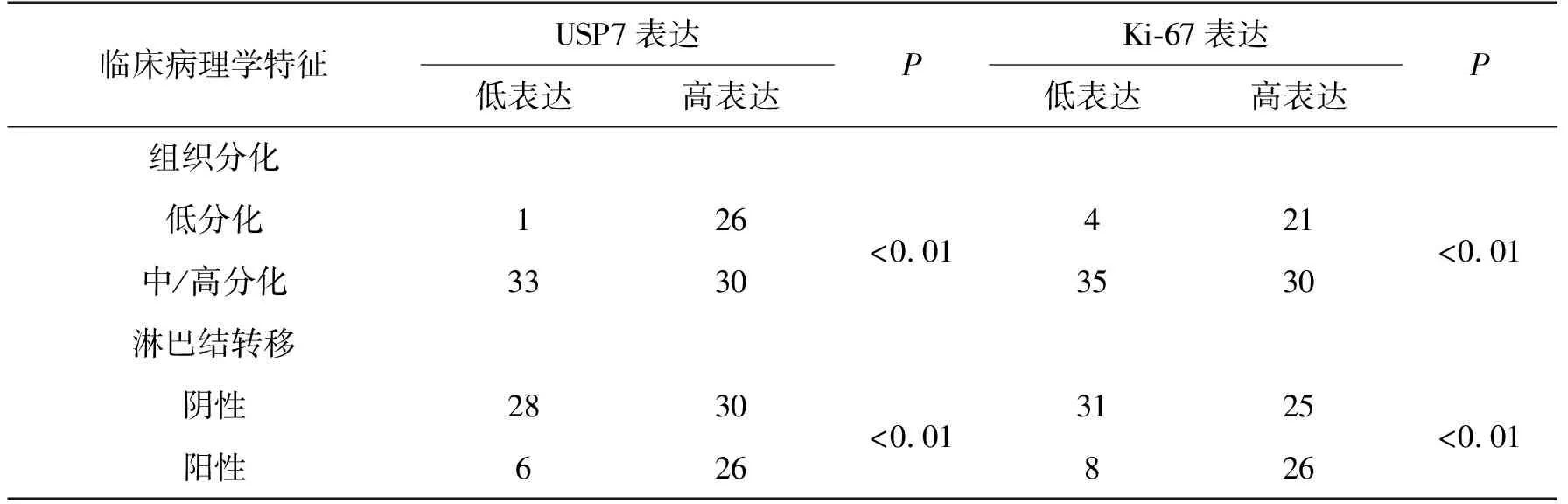
表2 USP7和Ki-67在大肠癌组织中的表达与临床病理学特征的关联性
3 讨论
USP7是目前被研究最为广泛、最为热点的一个泛素特异性蛋白酶。它能够广泛地与多种蛋白底物相结合,并对这些底物的多聚泛素链进行剪切,使泛素能够释放得以被重新利用,进而维持靶蛋白的稳态,包括细胞免疫应答、病毒的复制和感染、细胞的有丝分裂以及DNA的损伤修复[3]。已有研究发现USP7在多发性骨髓瘤、神经母细胞瘤、前列腺癌等疾病中呈现出高表达[4-5]。还有学者在非小细胞肺癌的体内外实验中发现USP7呈过表达状态,当下调USP7后可减慢癌细胞的增殖,并与Ki-67呈正相关,并得知USP7通过去泛素作用可调节Ki-67的稳定性,促进癌细胞的增殖[6]。在本实验中也发现,USP7和Ki-67在大肠癌组织中呈正相关性(表1)。在与大肠癌相关临床病理学特征的探究中,USP7和Ki-67的高表达分别与肿瘤分化程度、淋巴结转移具有一定的相关性(表2)。因此,我们大胆地推测在大肠癌中存在着USP7和Ki-67的相关性,Ki-67有可能为 USP7的底物之一,并受其泛素化/去泛素化的调节,而且USP7和Ki-67在大肠癌的病变进展中可能起了协同作用,但USP7和Ki-67之间的具体相互作用及联系机制将有待于进一步地研究,成为下一步探索的新方向。
综上所述,提示了USP7和Ki-67的高表达可能与大肠癌的发生、发展有密切关系,并且与肿瘤恶性分化程度、淋巴结转移具有一定相关性,还提示了这两个基因在某种程度上可能存在协同作用,临床上具有较大的综合检测价值,将会成为大肠癌患者临床诊疗及判断预后的潜在标志物。
