心脏移植术围术期住院患者死亡危险因素分析 ①
2020-12-18展宇飞罗天戈潘禹辰宋剑非
展宇飞,罗天戈,韩 杰,孟 旭,潘禹辰,宋剑非 ③
(1.桂林医学院第二附属医院心胸外科,广西 桂林 541199; 2. 首都医科大学附属安贞医院心外科,北京 100029)
南非医生Christiaan Barnard在1967年完成了轰动全球的首例心脏移植后开启了心脏移植的历史,到现在全球已经有10万多例心脏移植手术[1]。心脏移植是目前公认的治疗终末期心脏病的有效手段。我国心脏移植手术开始于1978年,但早期进展缓慢,直到21世纪初,随着免疫抑制领域的全面发展及手术技术的提高,我国心脏移植手术量逐年增加。截止到2016年底,我国38家心脏移植中心上报2 149例心脏移植数据,经统计,心脏移植术后院内存活率与ISHLT(国际心肺移植协会)数据基本持平,长期存活率满意,但手术量仍有较大的提升空间[2]。随着外科技术的进一步发展,未来心脏移植数量必将进一步增加,而对患者围术期的处理无疑是心脏移植成败的最关键因素。笔者总结中国人民解放军联勤保障部队第924医院单中心近10余年所有心脏移植患者临床资料,分析影响受者围术期死亡的危险因素,并探讨临床处理的改进措施,以期能够更好地改善心脏病患者预后。
1 资料与方法
1.1 一般资料
选取2006年10月至2018年3月中国人民解放军第924医院96例心脏移植手术患者,其中男71例,女25例;年龄12~73岁,平均(44.2±13.7)岁;体重29~88 kg,平均(62.1±11.1)kg。术前原发病中,扩张型心肌病67例,先天性心脏病4例,缺血性心肌病11例,风湿性心脏病6例,其他心肮病8例。
1.2 方法
术前基本情况及抽血检验指标:术前最近一次(7 d内)抽血检验指标,包括年龄、身高、体重、EF(射血分数)值、白细胞、中性粒细胞比率、淋巴细胞比率、总胆红素、直接胆红素、谷丙转氨酶、谷草转氨酶、尿素氮、肌酐。其他因素:供心热缺血时间、供心冷缺血时间、供者年龄、体重、体外循环转流时间、主动脉阻断时间、围术期红细胞悬液总输入量。
随访方案:以术后60 d为围术期时间点,记录患者在该时间点的生存状态,并以此分为围术期生存组(74例)和围术期死亡组(22例)。
手术方式均为原位双腔静脉法,体外循环均采用浅低温(32.0 ℃),供体均使用HTK液心肌保护,术中体外循环灌注压50~70 mmHg,停体外循环时温度复至鼻温37.0 ℃,肛温36.0 ℃。
1.3 统计学分析
2 结果
2.1 单因素分析结果
心脏移植围术期死亡(60 d内)单因素分析:96例患者,死亡22例(22.9%),近5年死亡率6.6%(45例死亡3例),其中多脏器功能衰竭9例(40.9%),移植物功能衰竭6例(27.3%),急性排斥反应2例(9.1%),感染4例(18.2%),其他1例(4.5%)。对21个考察因子进行单因素分析,结果显示体外转流时间及围术期红细胞悬液输注总量是术后死亡的危险因素,P值分别为0.031,0.010。详见表1。
2.2 多因素分析结果
将单因素相关分析后有统计学意义的参数指标纳入多因素回归模型,Logitic进行多因素逐步回归分析,发现体外转流时间和红细胞悬液输注总量均为术后早期受者死亡的危险因素,OR值(1.023,1.000)。详见表2。
2.3 ROC曲线
分别绘制体外转流时间及围术期输注红细胞悬液总量的ROC曲线,曲线下面积AUC(0.715,0.773),经计算体外转流时间最佳临界值为157.5 min,红细胞悬液输注总量最佳临界值2 150 ml。详见图1,图2。
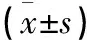
表1 96例心脏移植患者的单因素分析
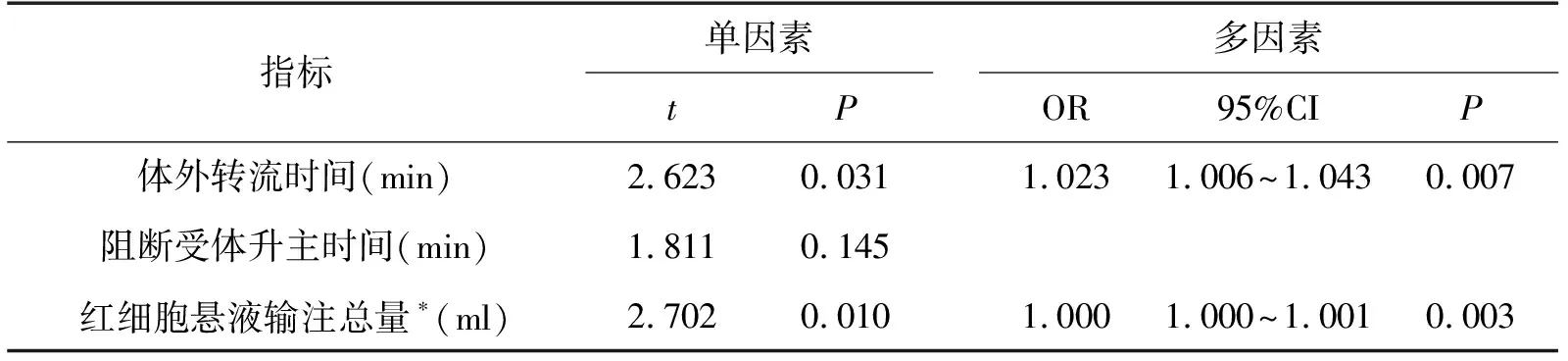
表2 心脏移植术围术期死亡相关因素分析
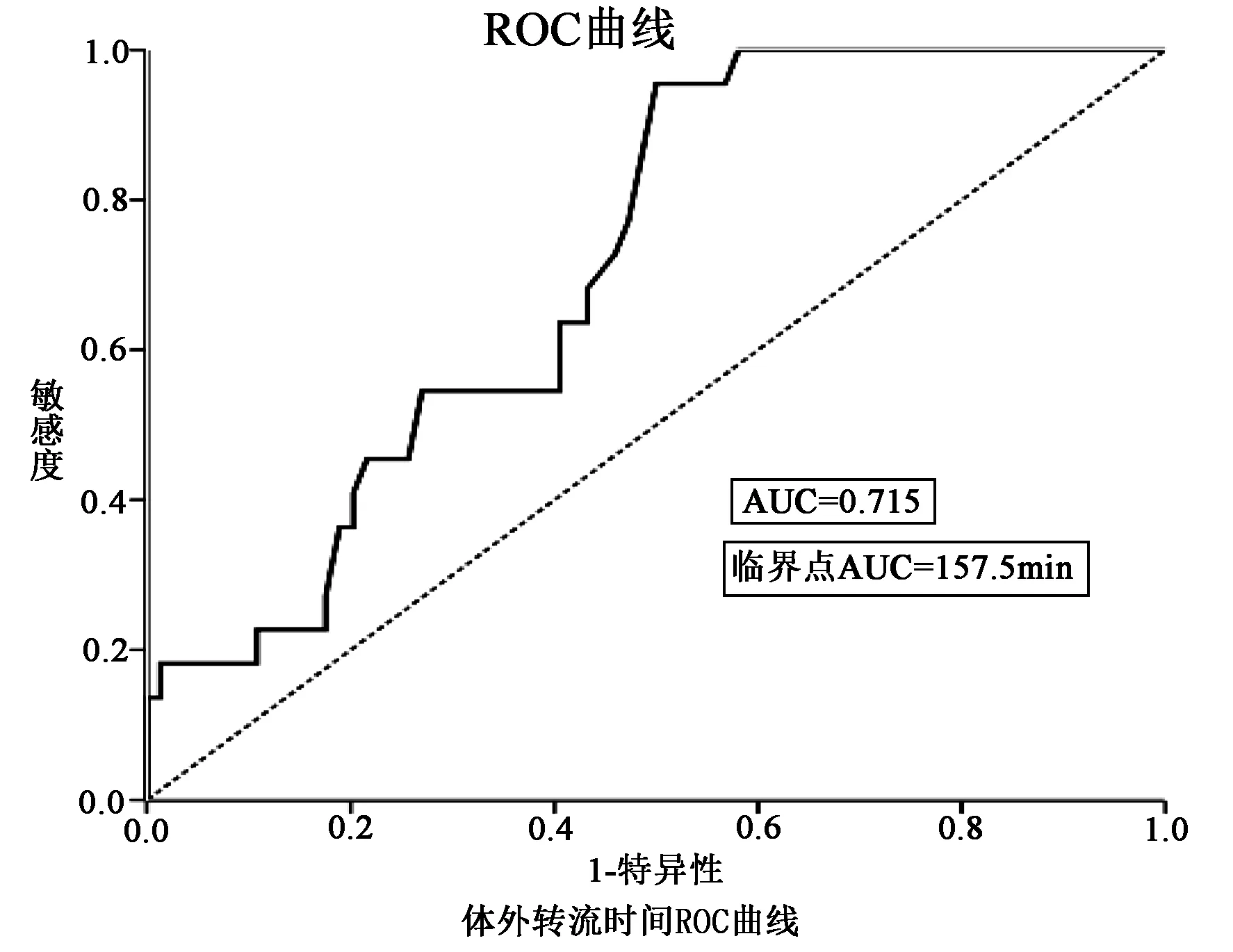
图1 体外循环转流时间与死亡率的ROC曲线
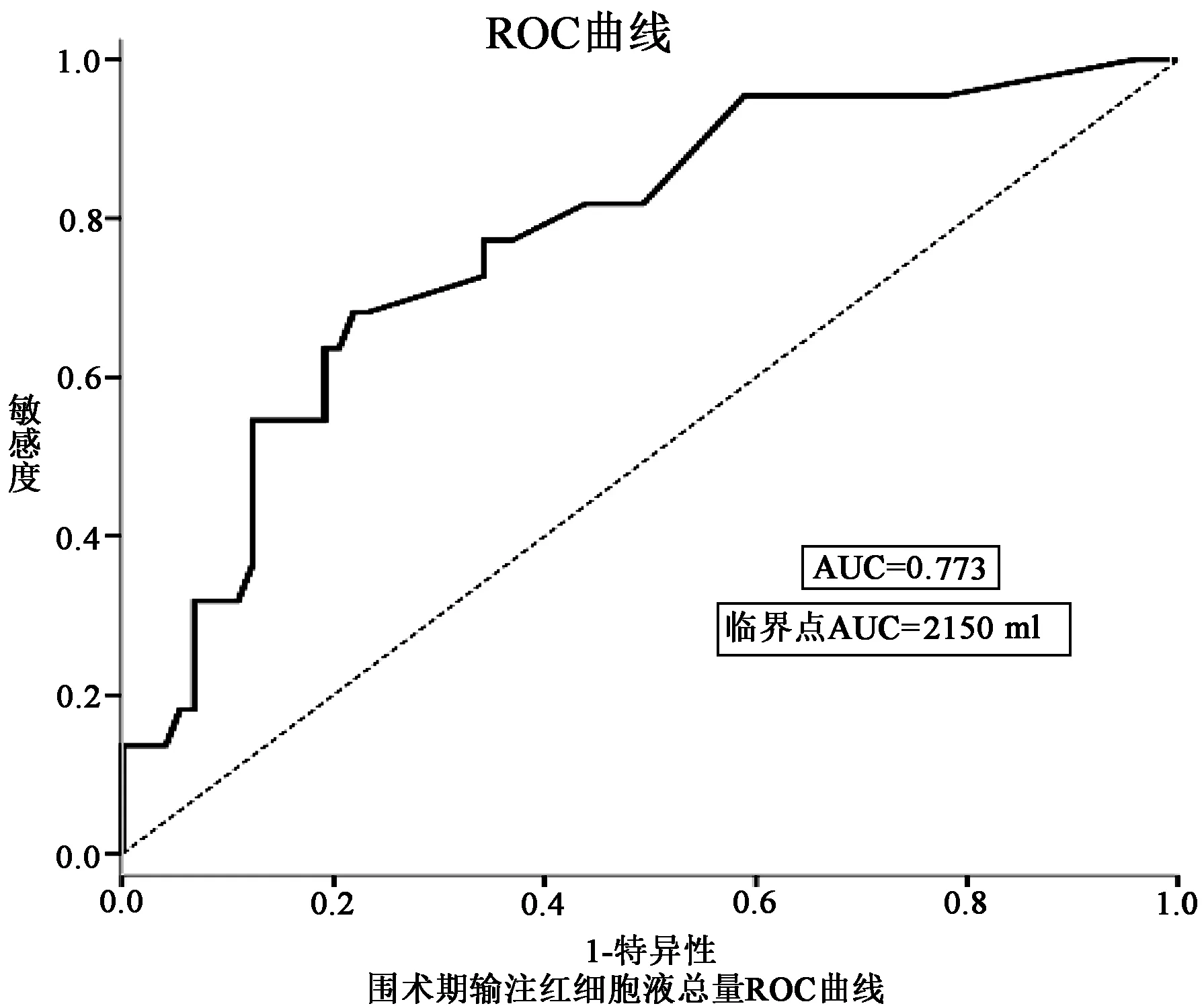
图2 围术期红细胞悬液输注量与死亡率的ROC曲线
3 讨论
随着胸腔内器官移植手术的逐步推广,以及免疫抑制领域的飞速发展,心脏移植患者的存活率明显提高。据文献报道,心脏移植后1年,5年,10年的存活率分别为85%,70%,55%,中位存活时间达10年左右,几乎接近肾移植术后生存率。我国心脏移植由于起步较晚,且受到供者数量和经济能力的限制,心脏移植整体数量仍很有限。同时在原发病、病情、术前并发症等方面具有自身特点。我国心脏移植受者原发病以心肌病为主,且就诊时间较晚,术前多合并肝瘀血,肾功能不全,肺动脉高压。供心冷缺血时间>6 h的比率远高于ISHLT(国际心肺移植协会)数据。这使得我国心脏移植术后多脏器功能衰竭和移植心脏功能衰竭占早期死亡原因50%以上。而国际心脏移植早期死亡的主要原因为移植物功能衰竭[3-4]。
从本组资料看来,我院心脏移植主要死亡原因为多脏器功能衰竭及移植物功能衰竭,与国内整体死亡原因一致。经分析体外转流时间及围术期输注红细胞量是早期死亡的独立危险因素。我院心脏移植手术平均体外转流时间(183.16±71.23)min,死亡组转流时间(227.73±113.24)min,明显高于整体平均时间。大量研究已证实,心脏手术体外循环期间,由于血液稀释,平流灌注出现低灌注压,组织与血液温差、多种酶的活性受到抑制等多种原因,均导致体外循环手术术后低心排综合征及其他脏器功能不全的发生率明显高于一般手术,从而引起其术后死亡率亦高于一般手术。对普通心脏手术来讲,体外循环转流时间主要与手术的复杂程度及术者操作熟练程度有关,而心脏移植手术又不同于一般心脏手术,其体外转流时间除了与术者操作熟练程度有关外,供心冷缺血时间及供心心脏功能状况对体外转流时间影响更大。目前心脏移植手术技术已相当成熟,我院心脏移植平均主动脉阻断时间(93.38±33.41)min,故供心冷缺血时间及供心功能对转流时间的影响显得更为重要。有研究表明,供心冷缺血时间与心脏移植术后移植物功能衰竭发生率和远期存活率成负相关[5-6]。而《国际心肺移植协会心脏移植受者管理指南》提出:供心冷缺血时间非常重要,但并不是对移植物功能产生不良影响的独立危险因素。众所周知,心脏移植体外循环后并行时间是以供心冷缺血时间为参考,故冷缺血时间长必然增加体外转流时间,从而间接增加移植患者早期死亡率。
另外,供心心功能不良易导致术后右心功能不全,往往需要更长的体外辅助时间。目前供心功能在使用前均需经过详细评估,虽尚无明确的统一标准,但可以肯定的是,患者脑死亡前心功能均处于良好状态才可考虑使用。故供者脑死亡后的心功能维护对供心功能有决定性影响,最大限度降低供心心肌损伤是心脏移植成功的重要因素[7]。由于脑死亡早期“儿茶酚胺风暴”(高血压、心动过速)增加心肌氧耗,加重潜在的心肌缺血,启动心肌过度收缩后的损伤和坏死过程,介导心肌纤维化,在这一激烈的交感风暴后随之而来的是交感张力的丧失,表现为外周循环阻力迅速下降,心肌负荷加重及冠脉灌注异常,生命体征波动大。而这时往往需要大剂量的血管活性药物支持。有研究表明,多巴胺>20 μg·kg-1·min-1合并或不合并应用其他正性肌力药物是术后发生移植物功能衰竭和受者早期死亡的独立危险因素。而国内大部分医院,尤其是尚未开展心脏移植的医院,对供心维护认识不足,为了维持正常生命体征,均会使用大量血管活性药物,从而造成潜在的心肌损伤。并且,该类患者因生命体征波动较大,长途转运风险较高,考虑到供体其他器官的安全性,很多时候要选择异地获取供心,而供心的长途转运导致了供心冷缺血时间明显增加,术中体外后并行时间延长。针对以上问题,笔者认为应从以下方面实施改进:①心脏移植中心应设立专业的供体维护团队,除了评估供体心脏整体情况外,还应认真评估供体转运风险,尽量将供体转运至心脏移植手术实施单位进行供心获取,减少冷缺血时间,减轻潜在心肌损害。②无法转运的供体,供体维护组应由心脏科成员参与,维持供体内环境及生命体征平稳,并最大限度减少血管活性药物的使用。③必须异地获取供心时,尽量采用最高效的运输方式,如直升机等。④手术方式的改良:先完成左心系统(左心房及主动脉)的缝合,完成后即开放升主动脉,在心脏跳动下完成右心系统的缝合,从而减少主动脉阻断时间,从一定程度上也降低了体外转流时间。目前北京安贞医院已有部分术者采取该方式,虽尚无与传统术式死亡率等方面的对比数据,但对冷缺血时间较长的患者不失为一种好的选择。⑤术中主动脉开放后,经充分并行循环后,若无法顺利停机,可考虑及早使用体外膜肺氧合(ECMO),减少机械泵导致的血液成分破坏及炎性因子的产生,降低远期感染的发生率。
增加心脏移植患者早期死亡率的另一个危险因素是输血,据文献报道,在各种外科手术中,心脏手术需补充血量最多,临床中80%的全部手术用血被用于心脏手术[8]。50年代后期,人们已经认识到输血使受者产生HLA同种抗体,后者不但是临床输血引起发热反应的重要原因,在器官移植时可促使排斥反应的发生。输血可导致群体反应PRA增高,一项心脏移植前瞻性调查提示,PRA增高的患者容易发生慢性排斥反应[9]。由于我国心脏移植患者原发病以心肌病为主,且患者就诊时间普遍较晚,多数在入院时已合并肝肾功能不全、肺动脉高压,同时由于我国移植供心冷缺血时间较长,术中体外循环时间较一般手术长,术后使用ECMO、CRRT、IABP等辅助治疗概率较高,这些因素均增加术中术后出血风险,增加输血概率。输血的另一个危害是导致感染风险增加,心脏移植患者感染风险明显高于其他心脏手术[10],有研究表明[11],心脏移植术后30 d内感染导致的死亡率高达12%。故围术期采取各种措施减少输血概率可进一步提高心脏移植成功率。笔者认为应从以下几方面改进:①加大心脏移植手术宣传力度,尤其对基层心内科医生,使其能及时给心脏病终末期患者提供心脏移植手术的参考,而不是等到出现多个脏器受损后再进行移植。②术前储备自体血,术中使用血液回收系统,尽量减少异体血输注。③术中操作尽量缩短时间,减少转流时间,做好外科止血。
综上所述,体外循环转流时间及围术期红细胞悬液输注量增加早期心脏移植患者死亡率,而从以上分析来看,决定转流时间的关键因素并非在术中,专业的供心维护团队可将供者脑死亡早期的内环境及生命体征维持稳定,减少潜在的心肌损害,减少冷缺血时间,从而降低体外转流时间,也从另一方面减少了输血的概率。另外,一方面,改良术式减少了主动脉阻断时间,从而也减少了体外循环时间,故组建专业供心维护团队及术式改良或将能进一步提高心脏移植患者围术期存活率;另一方面,要让更多的医生了解心脏移植手术指征,让心脏病终末期患者在出现多脏器功能不全之前进入移植等待名单,减少围术期多脏器功能衰竭的概率,进一步提高心脏移植成功率。
