外源脱落酸对干旱胁迫下谷子生长及生理特性的影响
2020-12-18宋敏丽
张 笑,宋敏丽
(太原师范学院 生物系,山西 晋中 030619)
谷子是山西的主要粮食作物之一,作为我国旱地可持续生态农业的重要组成部分,具有较强的抗旱性,耐瘠性,适应性广的特点[1],但干旱对其造成严重的生理胁迫,影响其正常发育,尤其是在需水量较大的苗期影响更为严重[2].研究表明,在干旱胁迫下谷子发芽率显著下降,苗期叶片相对含水量明显低于正常灌水处理[3,4],谷子单穗重、株高显著下降,使其产量和质量都受到严重影响[5,6].因此,在较为干旱的山西地区,通过采取一定措施减轻干旱胁迫对谷子幼苗的伤害,提高谷子抗旱性,对谷子栽培、生产具有重要意义.
脱落酸(ABA)是一种广泛分布于高等植物体内的植物激素,具有能够引起芽休眠、叶子脱落和抑制细胞生长等生理作用.研究发现,除了抑制生长以外,ABA也是启动植物体内抗逆基因表达的“第一信使”,可有效激活植物体内抗逆免疫系统,增强植物综合抗性(抗旱、抗热、抗寒、抗病虫、抗盐碱等)的能力[7].植物在处于干旱环境时,细胞会迅速积累ABA,而ABA可以通过诱导气孔关闭,从而减少叶片水分的散失,同时诱导渗透调节物质的积累,并活化与抗旱诱导有关的基因[8],从而起到减少植物体内水分散失的作用,在农业生产上对抗旱节水、减灾保产和生态环境的恢复具有重要作用.
目前,关于谷子抗旱性的研究主要集中在抗旱资源的筛选与鉴定,有关外源ABA对谷子抗旱性的研究少之又少[9].本研究以晋谷42号谷子为研究材料,在以PEG-6000模拟干旱的条件下对谷子幼苗外源施用ABA,研究外源ABA对不同干旱条件下谷子幼苗的生长和生理特性的影响,从而揭示外源ABA对谷子抗旱性的调控作用,为研究谷子抗旱作用机制及培育谷子抗旱品种提供理论依据.
1 材料与方法
1.1 试验材料
试验材料:山西省晋谷42号谷子.选取颗粒饱满的谷子种子用自来水浸泡24 h,然后摆放在铺有5层纱布的培养皿(直径150mm)中,暗培养36 h后放入光照培养箱(光照/黑暗=16 h/8 h,25 ℃/20 ℃)中培养.待幼苗出现绿芽后,每日用Hoagland营养液浇灌3次,每次大约20 ml.
试验试剂:本研究所用的PEG-6000和ABA均购于Sigma-Aldrich公司.
1.2 试验设计
当谷子幼苗长至两叶一心后进行处理.外源ABA采用均匀喷施叶片的处理方法,于每日早、中、晚各处理一次,当谷子幼苗叶片全部湿润而且不再持续滴水时停止喷施(约喷施10 mL),对照组则喷施蒸馏水.ABA处理2 d后再进行干旱处理,采用质量浓度为150 g/L的聚乙二醇(PEG-6000),分别于早、中、晚各施加在培养皿中模拟干旱胁迫,对照组则只施加Hoagland营养液,24 h后取样进行各个指标测试.所有处理设置3组生物学重复.
试验共设计5个组:空白处理(Control):Hoagland营养液正常生长+蒸馏水、处理1(T1):蒸馏水、处理2(T2):10-6mol/ L ABA、处理3(T3):10-5mol/ L ABA、处理4(T4):10-4mol/ L ABA.
1.3 测定指标及方法
相对含水率(relative water content,RWC)采用称重法测定[10];叶绿素含量采用分光光度计法测定[10];超氧化物歧化酶(SOD)活性测定采用 NBT 光化还原法[10];过氧化物酶(POD)活性测定采用愈创木酚法[10];丙二醛(MDA)含量测定采用硫代巴比妥酸比色法[16];相对电导率采用简易浸泡法测定[10].
1.4 数据处理
使用Excel 2016 和 SPSS 21.0 进行数据处理与分析.
2 结果与分析
2.1 不同浓度脱落酸对干旱胁迫下谷子叶片相对含水量和叶绿素含量的影响
从图1(A)可知,正常生长的谷子幼苗(Control)叶片中相对含水量最高,干旱胁迫(T1)使谷子幼苗的相对含水量显著降低5.28%;干旱胁迫后喷洒不同浓度脱落酸,一定程度上均可提高叶片的相对含水量.与干旱处理相比,10-6mol/L ABA处理(T2)和10-4mol/L ABA(T4)处理后叶片含水量分别提高了2.11%和1.89%,T3处理后幼苗含水量显著提高了3.43%(P<0.05),与正常幼苗含水量无显著差异.以上结果表明,不同浓度的脱落酸处理对干旱胁迫下谷子幼苗的含水量影响存在浓度效应,且浓度为10-5mol/L的脱落酸能够最有效地缓解干旱下叶片相对含水量的减少.
从图1(B)可知,与对照相比,干旱胁迫后叶片中叶绿素含量均显著降低(P<0.05),外源施加不同浓度脱落酸后,谷子叶片叶绿素含量各有所提高.与干旱处理(T1)相比,外源ABA浓度为10-6mol/L (T2)和10-5mol/L (T3) 处理下叶片叶绿素含量显著升高,且当脱落酸浓度为10-5mol/L (T3)时,叶绿素的总含量达到最大值.以上结果表明,在一定浓度范围内,外源脱落酸能够缓解干旱胁迫下谷子幼苗叶片中叶绿素含量降低的问题,当浓度太高时反而会降低幼苗的光合作用.
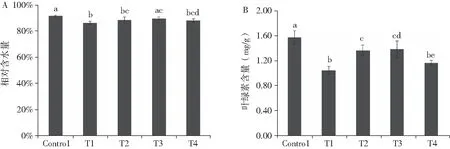
图1 外源脱落酸对干旱胁迫下谷子幼苗水分含量(A)和叶绿素含量(B)的影响
2.2 不同浓度脱落酸对干旱胁迫下谷子叶片抗氧化酶活性的影响
外源施加不同浓度的ABA后对干旱胁迫下谷子叶片中的POD和SOD酶活性进行测定.结果表明(图2A),与对照相比,模拟干旱处理后显著提高了叶片中POD的活性.而在外源施加ABA处理的情况下,谷子幼苗叶片的POD活性在不同ABA浓度处理下有不同程度的变化.与干旱处理组(T1)相比,在10-6mol/ L(T2)和10-5mol/ L(T3)外源ABA处理下叶片POD活性均显著升高,而10-4mol/ L(T4)外源ABA处理下叶片POD活性变化不明显.结果表明,喷施适量浓度的外源ABA可以显著提高干旱胁迫下谷子幼苗叶片的POD活性,但浓度过高会使这种提高作用减弱.
由图2 B可知,与正常生长组(Control)的谷子幼苗相比,质量浓度为150 g/L的PEG-6000溶液模拟干旱处理(T1)下的谷子幼苗叶片的SOD活性显著升高14.3 %.与T1相比,外源施加10-6mol/ L(T2)和10-5mol/ L(T3)的ABA后,叶片中SOD活性分别显著升高了12.5%和25%.外源施加10-4mol/ L(T4)的ABA后,谷子叶片中SOD的活性比对照组(Control)明显升高,但与干旱处理(T1)组相比无明显变化.以上结果表明,外源喷施ABA可以提高干旱胁迫下谷子幼苗叶片的SOD活性,且这种作用存在浓度效应,即外源ABA的最适浓度为10-5mol/ L.
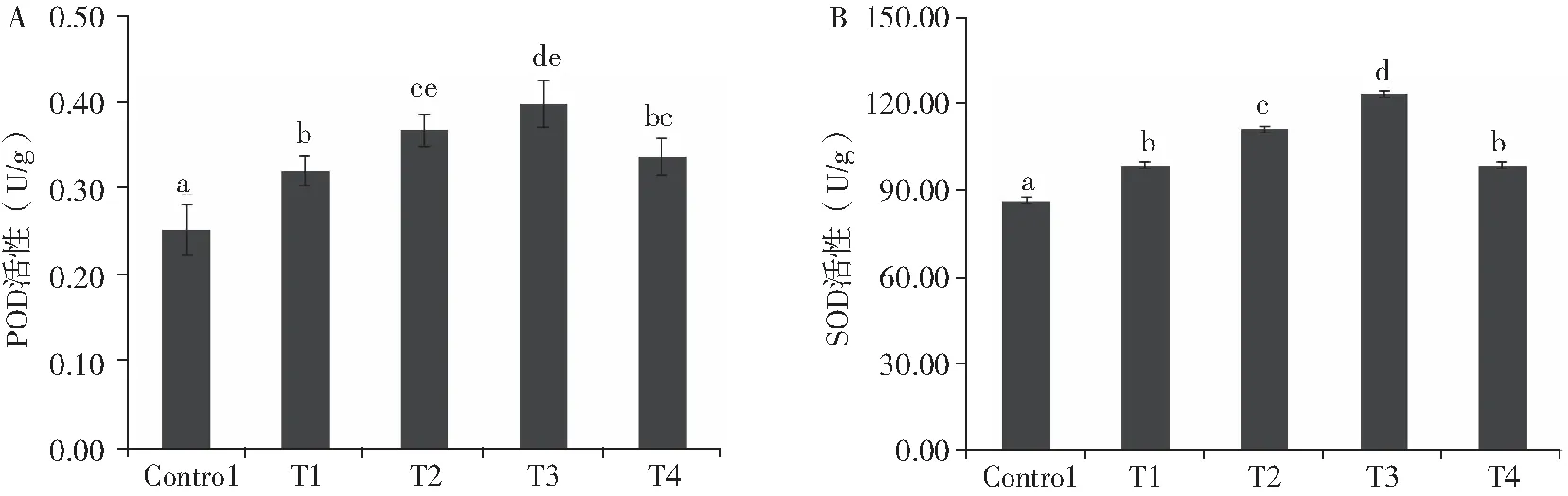
图2 外源脱落酸对干旱胁迫下谷子幼苗POD(A)和SOD(B)酶活性的影响
2.3 不同浓度脱落酸对干旱胁迫下谷子叶片质膜透性和丙二醛(MDA)含量的影响
图3A显示,与对照组幼苗(Control)相比,干旱处理(T1)下幼苗叶片的电导率显著升高;与T1相比,外源施加不同浓度的ABA(T2、T3、T4)后,谷子幼苗叶片的相对电导率均显著降低,且这种作用表现出一定的浓度效应.其中,10-5mol/ L(T3)ABA处理后,对干旱胁迫引起的谷子幼苗叶片质膜透性升高的缓解作用最为明显.以上结果表明植物在干旱胁迫下细胞结构受到破坏,导致叶片质膜透性增大,电导率升高.而外源施加ABA能一定程度降低叶片电导率,对质膜产生保护作用.
由图3 B可知,与对照组幼苗(Control)相比,干旱处理(T1)下幼苗叶片的丙二醛显著升高了30.8%;外源施加不同浓度的ABA(T2、T3、T4)后,谷子幼苗叶片中丙二醛含量与T1相比分别呈现显著下降的结果.与对照组相比,10-6mol/ L(T2)和10-4mol/ L(T4)的外源ABA处理下叶片MDA含量分别增加了11.0%和13.5%;而当外源ABA浓度为10-5mol/ L(T3)时,谷子叶片中MDA含量则与对照组叶片没有显著差异.这表明谷子在处于干旱胁迫时,植物细胞膜脂过氧化,导致体内的MDA积累.而外源喷施适量浓度的ABA可以显著降低这种作用,从而减轻植物因干旱所致的膜脂过氧化程度,但ABA浓度选择要合适,过高或过低浓度的ABA处理会减弱这种作用.

图3 外源脱落酸对干旱胁迫下谷子幼苗叶片电导率(A)和丙二醛含量(B)的影响
3 讨论与结论
植物的生长是环境与植物代谢相互作用的结果,水分在各种影响植物生长的环境因素中占主导地位,植物生长对水分不足有着极高的敏感度,并会诱导植物体内发生一系列的生理生化变化,以提高植物自身的抗旱性,因此可以使用相关生理指标的变化来检测植物抗旱性的强弱[11].外源ABA可以作为增强植物抗旱性的信号分子,已有研究表明,在干旱胁迫下,茶树内源ABA的含量会迅速增加,诱导激发茶树的抗旱性[12];对孕穗期水稻的研究发现,ABA可以使孕穗期水稻“暂时性休眠”,降低水稻的气孔导度、蒸腾速率和净光合速率,抑制其生长代谢,提高其水分利用效率[13];在对红纱幼苗[14]、北柴胡[15]、番茄幼苗[16]以及白三叶[17]的研究中发现,在干旱胁迫下施用外源ABA可以不同程度地减少植物水分散失,增加植物抗旱性.本研究结果显示,质量浓度为150 g/L的PEG-6000溶液模拟干旱胁迫处理显著影响了谷子幼苗的生长发育及生理变化;外源施加不同浓度的ABA以后,明显缓解了干旱胁迫下谷子幼苗所受损伤,并且这种作用存在浓度效应,过高或过低外源ABA浓度都不利于谷子幼苗形成更高的抗旱性,在本研究中,10-5mol/ L 外源ABA对提高干旱胁迫下谷子幼苗的抗旱能力有最显著效果.
植物受到干旱胁迫后会第一时间保持体内水分含量,减少水分的快速丢失,因此相对含水量是植物水分状况的重要指标,它影响植物的生长、气孔开闭以及作物产量[18].外源施加ABA提高了干旱胁迫下谷子幼苗的相对含水量,这有利于谷子在逆境中保持自身的水分从而保证正常的代谢[19].光合作用作为植物最重要的生理过程之一,受到植物体内叶绿素含量的影响.叶片叶绿素含量与作物的营养状况密切相关,也为提高植物的生存能力提供理论依据[20].本研究中干旱胁迫后,谷子幼苗叶绿素含量均显著下降,这是逆境下谷子应对伤害的生理反应,而外源施加ABA后缓解和降低了干旱对谷子幼苗的损伤.
超氧化物歧化酶(SOD)和过氧化物酶(POD)是植物体内抗氧化酶系统中的两种保护酶,可将有毒超氧自由基最终转化为无毒的O2,保证植物细胞的正常代谢.当植物处于不良环境时,SOD和POD的活性会被激活,从而提高植物的抗逆性[21].本研究中,与单独干旱胁迫相比,喷施外源ABA后干旱胁迫下谷子幼苗叶片中的SOD和POD的酶活性均有不同程度的增加,并且与对照组形成显著差异.这说明外源ABA可以有效提高干旱下谷子幼苗叶片SOD和POD的酶活性,从而有效清除干旱胁迫产生的氧自由基,增强谷子幼苗叶片的抗氧化能力[22].
大量研究表明,植物处于干旱环境时,体内氧自由基代谢平衡被破坏,氧自由基含量大幅增加,进而导致细胞膜脂过氧化程度加剧,产生有毒物质丙二醛(MDA),同时质膜渗透性增加,电解质外渗,电导率增强[23,24].本研究发现,在质量浓度为150 g/L的PEG-6000溶液模拟干旱胁迫处理下的谷子幼苗叶片的SOD和POD酶活性明显增加,与吴政霖[25]等研究结果一致;丙二醛(MDA)含量提高,相对电导率显著增大,与陈青奇[26]等研究结果一致.此外,干旱的谷子幼苗叶片经过外源ABA喷施处理后,SOD和POD酶活性均进一步增加,丙二醛(MDA)含量以及相对电导率均明显降低,与王晶懋[27]的研究一致,表明适度的外源ABA喷施处理可以有效减缓谷子幼苗叶片在干旱胁迫下产生的生理损伤.
综上所述,干旱胁迫降低了谷子幼苗的相对含水量以及叶绿素含量,增加了叶片质膜透性并导致电解质外渗,相对电导率升高.而外源施加一定浓度的ABA以后,显著提高了幼苗体内抗氧化酶的活性,降低了有害氧化产物丙二醛的含量,一定程度上提高了干旱下叶片的水分和叶绿素含量,从而缓解了干旱对谷子幼苗的伤害,提高了自身的抗旱性.但是,通过这种方法提高谷子幼苗叶片抗旱性对外源ABA的浓度有一定的限制,过高或过低均会使这种作用减弱,本实验中外源ABA的最适浓度为10-5mol/L.因实验所用材料、培养时间、处理方式的不同等,外源ABA的最适浓度也可能有所变化,因此,在农业实践中进行ABA喷施处理时必须要掌握好喷施浓度,减少不必要的浪费.
