枸杞子对视疲劳的缓解作用研究
2020-12-18
(天津市食品安全检测技术研究院,天津300000)
枸杞(Fructus lycii)是一种可食用的茄科植物,其干制品枸杞子在本草纲目和其它书籍中均有大量记载。王娇娇等[1]对发表在国内期刊上的文献进行统计分析,发现单味枸杞子的使用比例占到了61.1%。对于枸杞子,不同时期的中药学家都有不同的认识,但其明目、抗氧化效果被历代医学工作者所承认[2-4]。现如今,随着现代社会的高速发展,对枸杞子明目功效的研究被科学家们愈加重视。现代医学工作者研究发现,枸杞子中包含枸杞多糖(Lycium barbarum polysaccharide,LBP)、叶黄素、氨基酸、无机盐等,对这些成分进行深入研究发现[5-7],这些物质都具有抗氧化能力。在此基础上,枸杞多糖被发现具有缓解视疲劳、抗衰老和保护DNA的作用[8-9]。马小飞[10]研究发现,枸杞多糖可以代偿性激活体内部分细胞中Nrf-2抗氧化通路,从而进一步增强细胞的抗氧化能力,对眼组织起到保护作用,这些都为枸杞子在缓解视疲劳的研究提供了理论依据。
晶状体是眼球中重要的屈光间质,对光线有屈光效果,具有过滤紫外线,保护视网膜的作用。晶状体后面和玻璃体接触,光线通过晶状体后,通过玻璃体而到达视网膜,最终将捕获的光信号传至大脑。严宏等[11]研究发现,晶状体与视疲劳之间具有密切的关系。晶状体内没有血管,它所需的营养来自房水。当房水的代谢或晶状体囊出现问题时,原本透明的晶状体会变得不透明,最终影响视力,引起视疲劳及其它眼科疾病。现在缓解视疲劳的方法很多,但效果都不是十分理想。
陈艳丽等[12]研究显示过强的光照会引起视力的损伤,经常伴随色素紊乱,并引起晶状体浑浊及皮肤光老化现象。桑传兰等[13]研究发现,过强的光照会使肝脏功能受损,其机制可能是因为过强的光照促使体内产生过量的活性氧自由基,引起蛋白质和脂质过氧化[14-16],导致体内肝细胞受损。为了探究枸杞子对视疲劳的缓解作用,本文拟采用枸杞子提取物为原料,以C57BL/6J小鼠为实验动物,通过检测晶状体与肝脏抗氧化指标来评价枸杞子对视疲劳的缓解作用。
1 材料和方法
1.1 材料、试剂与仪器
基础饲料、实验小鼠:斯贝福(北京)生物技术有限公司;丙二醛(malonaldehyde,MDA)试剂盒、总超氧化物歧化酶(superoxide dismutase activity,SOD)试剂盒、过氧化氢酶(catalase activity,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase activity,GSH-Px)试剂盒、总抗氧化能力 (total antioxidant capacity,TAOC)试剂盒、三氯乙醛(纯度>99%):上海麦克林生化科技有限公司;复方托吡卡胺滴眼液:参天制药(中国)有限公司;氧氟沙星眼膏:沈阳兴齐眼药股份有限公司。
LS120d-Ⅱ型LED灯:深圳市爱图仕影像器材有限公司;U-3900型紫外分光光度计:日本HITACHI公司。
1.2 枸杞子提取物来源
称取枸杞子(符合2015版《中华人民共和国药典》标准)药材,每次提取水量为药材体积6倍,提取3次,合并提取液,提取液浓缩得到水提物浸膏,加入适量乙醇,进行醇沉,收集沉淀物,干燥醇沉沉淀物制得枸杞子提取物(每克枸杞子提取物相当于枸杞子生药3.5 g)。
1.3 实验动物的选择
健康雄性 C57BL/6J小鼠,6 周龄,(18±1)g,许可证号为SCXK(京)2016-0002,饲养于实验动物中心[(23±2)℃,相对湿度55%~75%]。老鼠置于白色塑料笼中,每笼4只,每组3笼。动物房从早上7点至晚上7点给予正常光照,其余时间无光照,并且为动物提供充足的食物和水。
1.4 光损伤模型制备及动物分组
强光照射在暗室内密闭进行,无自然光干扰。每只小鼠被单独的放置在由亚克力透明板制成的小方格中,每个格子的长、宽、高分别为 10、10、8 cm,并在光照前对小鼠眼球进行涂抹眼药处理,避免眼球表面由于长时间光照引起脱水。将光照器悬挂于小鼠顶端50 cm处,采用垂直照射方式照射,并在与小鼠同一高度处悬挂温度计,进行温度实时监控,排除温度升高引起小鼠眼球光热损伤的可能。根据前期预实验结果,实验组小鼠在(9 000±500)Lux光强下,每天照射4 h,连续照射7 d,光照期间正常进食与饮水。设立5个实验分组,每组12只,期间采用灌胃方式分别对5组实验动物给药,其中正常对照组和光损伤模型组每天灌胃等量的溶媒;枸杞子提取物低、中和高剂量组每天的给药剂量分别为280、370、460 mg/kg。连续给药8周后进行相关的抗氧化指标检测。
正常组、模型组分别用NOR、MOD表示,枸杞子低剂量组、枸杞子中剂量组、枸杞子高剂量组分别用GQL、GQM、GQH 表示。
1.5 体重及摄食量记录
体重及摄食量自给药开始后进行记录,其体重每周称量一次,共计8周,摄食量每天测量一次并记录。
1.6 晶状体中相关抗氧化能力的检测
小鼠在脱颈处死后立即摘取眼球,在高倍显微镜下,将晶状体从眼球中剥离出来,剥离过程在冰盘上进行。加入匀浆介质用匀浆器匀浆,4℃环境离心10min(12000r/min),收取上清液,供待检测指标(GSHPx、T-AOC)使用。各项步骤按试剂盒操作说明书上步骤进行。
1.7 肝组织中相关抗氧化能力指标检测
参照刘佳维等的研究方法[17],将小鼠体内取出的肝组织立即放入-80℃冰箱中保存,供待检测生化指标(SOD、MDA、CAT、GSH-Px)使用。制备肝组织匀浆时,取出于低温保存的肝组织,按料液比1∶9(g/mL)加冰生理盐水,在低温环境下用研磨棒将离心管中的肝组织研磨成组织匀浆。4℃、3 000 r/min低温高速离心机离心10min,取上清液备用。各项指标根据试剂盒说明检测。
1.8 统计学分析
统计方法采用SPSS 22.0软件进行统计学处理,结果以±SD表示,P<0.05表示具有统计学差异。
2 结果分析
2.1 体重与摄食量
各组小鼠体重自开始给药时进行记录。体重与摄食量见图1~图3。

图1 起始体重记录Fig.1 Starting weight record
由图 1可知,其 NOR、MOD、GQL、GQM 和 GQH组初始体重分别为 (21.22±2.33)、(20.36±2.14)、(22.13 ±3.21)、(21.55 ±3.11)、(20.33 ±2.54) g,GQL、GQM、GQH组与MOD组比较没有统计学差异(P>0.05)。由图2各组小鼠的最终体重上看,GQL、GQM、GQH组较MOD组体重没有统计学差异(P>0.05),其最终体重分别为(31.25±3.58)、(30.28±2.14)、(31.66±3.21)、(30.25±3.11)、(32.14±3.51)g。从图 3 摄食量上看,枸杞子提取物干预组较模型组摄食量没有统计学差异(P>0.05),NOR、MOD、GQL、GQM 和 GQH 组平均摄食量分别为(4.22±0.56)、(4.41±0.42)、(4.33±0.32)、(4.28±0.36)、(4.48±0.24)g。
2.2 晶状体抗氧化结果分析
采用酶法对各组小鼠晶状体的GSH-Px和TAOC活力进行测定,各组测定结果见表1。
如表1所示,分析小鼠在(9 000±500)Lux的光强下,不同剂量的枸杞子提取物对小鼠晶状体内抗氧化能力的影响。从GSH-Px和T-AOC两个抗氧化指标上看,药物干预组抗氧化值高于模型组,并且其活力随着枸杞子提取物剂量的升高而升高。与模型组比较,枸杞子提取物低、中和高剂量组均显著升高 (P<0.05)。从表中结果可以看出,低、中、高剂量的枸杞子提取物均对光损伤小鼠晶状体具有不同程度的抗氧化能力,并且枸杞子提取物的剂量越高,其表现的抗氧化效果越好。

图2 最终体重记录Fig.2 Final weight record

图3 小鼠日均摄入量Fig.3 Mean daily intake of mice

表1 各组晶状体抗氧化指标Table 1 Antioxidant index of lens in each group U/mg
2.3 枸杞子提取物对光损伤小鼠肝组织中MDA含量的影响
各组小鼠肝组织MDA含量测定结果见图4。

图4 枸杞子提取物对光损伤小鼠肝组织MDA含量的影响Fig.4 Effects of the extract on MDA content in liver tissue of light-damaged mice
过量的光照会引起小鼠体内产生大量的自由基,其中包括丙二醛、羟基、羰基以及新的自由基等,能攻击生物膜中的多不饱和脂肪酸。另一方面,这些物质的过度产生导致体内自身的抗氧化平衡体系失衡,并且对体内细胞DNA的合成、裂解及转录造成损伤,从而破坏生物膜结构,使体内的脂类受到不可逆损伤[18-19]。从图4结果上看,NOR和MOD组的MDA含量分别为(1.22±0.16)nmol/mg 和(3.55±0.36)nmol/mg,说明过强的光照能导致小鼠肝脏组织中MDA含量显著增加,而摄入低、中、高剂量的枸杞子提取物后,与模型组相比,MDA含量分别下降14.6%、17.2%和20.8%,其中,与模型组相比较,枸杞子提取物低、中、高剂量组具有统计学差异(P<0.05)。
2.4 枸杞子提取物对小鼠肝组织中SOD活力的影响
各组小鼠肝组织SOD活力测定结果见图5。

图5 受试物对光损伤小鼠肝组织SOD活力的影响Fig.5 Effects of the extract on SOD activity in liver tissue of lightdamaged mice
SOD是一种广泛存在于动植物、微生物中的金属酶,能催化生物体内的超氧自由基发生歧化反应,从而清除O2-自由基,减缓氧化应激引起的氧化损伤[20]。实验结果显示,过强的光照导致肝组织中SOD酶活力明显降低,SOD活力由正常组的(35.7±4.88)U/mg降至模型组的(19.33±4.42)U/mg(P<0.05),而枸杞子提取物低、中和高剂量组小鼠肝组织中的SOD活力明显上升,分别提高31.5%、39.1%和44.7%。其中,与模型组比较,枸杞子提取物低、中和高剂量组均具有统计学差异(P<0.05)。
2.5 枸杞子提取物对小鼠肝组织中CAT活力的影响
各组小鼠肝组织CAT活力测定结果见图6。
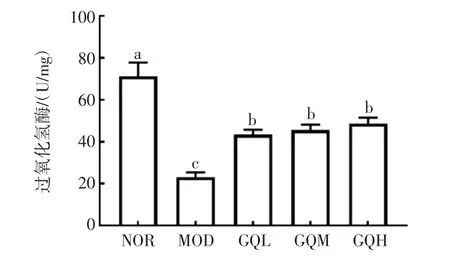
图6 受试物对光损伤小鼠肝组织CAT活力的影响Fig.6 Effects of the extract on CAT activity of liver tissue in lightdamaged mice
CAT是一种过氧化氢酶,能够有效清除体内的过氧化氢,减缓氧化应激引起的氧化损伤[21]。由图6可知,过强的光照引起肝组织中CAT酶活力明显降低(P<0.05),CAT活力由正常组的(72.33±7.58)U/mg降为模型组的(22.35±2.14)U/mg。给予低、中和高剂量的枸杞子提取物连续干预8周后,小鼠肝组织中的CAT活力与模型组相比明显上升,分别提高46.6%、53.4%和66.5%。与模型组相比,枸杞子提取物低、中和高剂量组均有统计学差异(P<0.05)。
2.6 枸杞子提取物对肝组织中GSH-Px活力的影响
各组小鼠肝组织GSH-Px活力测定结果见图7。
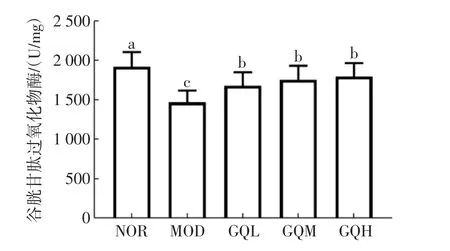
图7 枸杞子提取物对光损伤小鼠肝组织GSH-Px活力的影响Fig.7 Effects of the extract on GSH-Px activity in liver tissue of light-damaged mice
GSH-Px是机体内广泛存在的一种重要的催化过氧化氢分解的酶,能够有效清除体内的过氧化氢。它特异的催化还原型谷胱甘肽对过氧化氢的还原反应,减缓氧化应激引起的氧化损伤[22]。图7结果显示,光损伤之后导致肝组织中GSH-Px酶活力明显降低,酶活力由正常组的(1 946.00±159.6)U/mg下降至(1 486±168.9)U/mg(模型组)。给予低、中和高剂量的枸杞子提取物连续干预8周后,肝组织中的GSH-Px酶活力较模型组明显上升,分别提高11.6%、15.2%和18.7%。与模型组相比,枸杞子低、中和高剂量组均具有统计学差异(P<0.05)。
3 结论
本研究中使用的枸杞子提取物经测定含有枸杞多糖。光损伤动物实验评价发现,280 mg/kg剂量的枸杞子提取物能够明显减轻 (9 000±500)Lux光强引起的氧化应激损伤,对小鼠的视力具有一定的改善作用。通过对小鼠晶状体中抗氧化能力的测定发现,低、中和高剂量的枸杞子提取物可以明显提高GSH-Px和T-AOC活力,其抗氧化效果在干预的剂量范围内随着枸杞子提取物剂量的提高而升高。通过测定肝脏的抗氧化指标发现,枸杞子提取物可以明显降低肝脏MDA含量,升高SOD、CAT和GSH-Px酶活力,且低剂量即可起效,并呈现出剂量依赖性。这说明枸杞子提取物的抗氧化能力不仅体现在晶状体中,还可能体现在其它眼组织中,说明枸杞子提取物在体内具有抗氧化能力。由于晶状体的生理状态与视疲劳有密不可分的关系,说明枸杞子提取物具有缓解视疲劳的功效。
