不同细胞来源的外泌体在COPD中的研究进展
2020-12-17杨玥,卞涛
杨 玥,卞 涛
(南京医科大学附属无锡人民医院 呼吸与危重症科, 江苏 无锡 214000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种与增龄相关的慢性气道炎性疾病,以持续存在的呼吸道症状和气流受限为特征,与长期的香烟烟雾或其他有害气体吸入有关[1]。目前研究发现,香烟烟雾提取物(cigarette smoke extract,CSE)刺激可以诱发多种类型细胞如支气管上皮细胞、中性粒细胞和巨噬细胞向外界分泌细胞外囊泡(extracellular vesicles,EVs)。根据直径大小,EVs分为外泌体、微粒、凋亡小体及癌小体,其中外泌体是占据比重最大的细胞外囊泡[2],上述类型细胞通过释放外泌体与邻近各种细胞,如支气管上皮细胞、成纤维细胞和肺泡上皮细胞相互作用,导致黏液高分泌,成纤维细胞向肌成纤维细胞转化,肺泡上皮细胞凋亡等,最终发生气道重构与肺气肿,是COPD发病机制研究的新热点。
1 外泌体概述
1.1 外泌体的发现
外泌体是一种直径40~100 nm的盘状囊泡,在1983年, 首次于绵羊网织红细胞中发现,1987年命
名为“exosome”[3]。2007年首次发现外泌体可以携带mRNA及miRNA,并且可以进入受体细胞进行翻译表达相关蛋白[4]。之后,外泌体可以作为遗传物质载体这一观点被广泛接受。
1.2 外泌体的成分
外泌体的脂质双分子结构包裹大量内容物,主要包括蛋白质、脂质、mRNA、miRNA、lncRNA和DNA。
蛋白质是外泌体中最早研究的物质,蛋白质组学分析发现不同类型细胞所分泌的外泌体不仅有同样的蛋白质成分,而且包含分泌细胞所特有的蛋白。前者包括外泌体膜与受体细胞融合相关的Rabs蛋白,具有外泌体膜交换以及融合作用的膜联蛋白,参与外泌体运输的4跨膜蛋白家族(CD63、CD81 和CD9)、热休克蛋白家族、各种代谢酶类、核糖体蛋白(RPS3)、信号传导因子、黏附因子、细胞骨架蛋白以及泛素,等等,后者如结肠上皮细胞来源的外泌体含有A33蛋白, 抗原提呈细胞来源外泌体特有MHC-Ⅱ、CD86,T淋巴细胞来源外泌体特有的颗粒酶与穿孔素,肿瘤细胞来源外泌体特有的肿瘤相关抗原以及中性粒细胞来源外泌体表面带有中性粒细胞特异性酯酶,等等[5]。
脂质的相关研究相对较少,其组成因来源细胞不同而有所区别,外泌体富含鞘磷脂、磷脂酰丝氨酸和胆固醇,此外还包含神经节苷脂,饱和脂肪酸和神经酰胺,对维持外泌体内核酸在细胞外液中的稳定起到重要作用[6]。
外泌体中核酸物质包括DNA,各种编码及非编码RNA,自2007年以来一直是研究的重点和热点。外泌体中的RNA可以运输至相邻细胞或随着体液远程运输,进入到受体细胞内仍然保持其生物活性,可以通过转录、翻译或直接作用于蛋白质水平影响受体细胞蛋白表达,是外泌体的重要生物学特征[7]。
2 在COPD中各种类型细胞来源外泌体的作用
2.1 支气管上皮细胞来源的外泌体
支气管上皮细胞是与空气中有毒害物质接触的最主要细胞之一,在香烟烟雾刺激下能分泌多种细胞因子及趋化因子,作用于周围的平滑肌细胞和间充质成纤维细胞,并且有募集炎性细胞的作用,在COPD的发生发展中扮演重要角色[8]。支气管上皮细胞是肺内外泌体的主要生产者。香烟烟雾刺激通过耗竭支气管上皮细胞表面巯基,增加细胞内活性氧,导致更多的病理性外泌体的释放[9],通过旁分泌方式作用于周围支气管上皮细胞、巨噬细胞、成纤维细胞,这是导致COPD小气道重构及肺气肿的重要机制之一。
气道上皮之间可以通过外泌体进行信息交流。原代支气管上皮细胞HTBE分泌的主要是基本的先天保护性蛋白,包括黏蛋白5B,而培养的气道上皮细胞系Calu-3分泌的主要是病理相关蛋白,包括黏蛋白5AC。交换两种细胞上清内的外泌体之后,HTBE的外泌体中miRNA普遍升高,细胞的黏蛋白分泌显著增加,反之,Calu-3的分泌则没有明显改变[10]。
除了气道上皮之间能够通过外泌体进行沟通交流,气道上皮与巨噬细胞、成纤维细胞和肺泡上皮细胞之间也可以通过外泌体进行信息传递,参与COPD多种病理过程。
气道上皮细胞通过释放外泌体参与COPD气道重构。CSE刺激下人支气管上皮细胞(BEAS-2B)分泌出的外泌体中检测出更高水平的miR-21,外泌体进入人髓系白血病单核细胞THP-1细胞后,进一步提高THP-1细胞内的miR-21的水平,使THP-1细胞向M2型巨噬细胞分化的同时伸出伪足,分泌更多的巨噬细胞特征性细胞因子如转化生长因子-β(transforming growth factor-β,TGF-β)和白细胞介素10(interleukin-10,IL-10)等,反向促进BEAS-2B发生上皮间质转化过程[2](图1A)。但是在CSE刺激早期支气管上皮细胞保护性地减少外泌体内miR-21的分泌,这是一种早期的代偿机制。同样的,人支气管上皮细胞HBE在CSE刺激之后,外泌体中miR-21含量增加,与HBE共培养的成纤维细胞内吞外泌体后,细胞内的miR-21水平随之增加,靶向降低pVHL水平,进而使缺氧诱导因子1α水平升高,成纤维细胞向肌成纤维细胞分化,Ⅰ型胶原增加,引起气道重塑[11](图1B)。CSE刺激下BEAS-2B细胞外泌体中miR-210含量增加通过引起共培养的人成纤维细胞内自噬相关蛋白表达降低,自噬减少,人成纤维细胞向肌成纤维细胞分化。提示支气管上皮细胞通过外泌体与周围细胞交联,是长期香烟烟雾刺激致COPD气道重塑的重要原因[12](图1B)。
气道上皮细胞释放外泌体参与COPD肺气肿的形成。BEAS-2B在CSE刺激下产生的外泌体中含有半胱氨酸富集蛋白61(cysteine-rich protein 61, CYR61/CCN1)的阳性胞体从29%升高至45%,在纤维蛋白酶的作用下外泌体中的全长型CCN1裂解形成剪切型CCN1,随之引起基质金属蛋白酶1(matrix metalloproteinase 1,MMP1)水平提升,而MMP1是与肺气肿发生高度相关的经典蛋白酶,其引起肺泡细胞凋亡增加,肺泡间隔破坏[13]。支气管上皮细胞在香烟烟雾刺激下分泌出含有更多CCN1的外泌体,可能通过MMP1导致肺气肿的产生(图1C)。
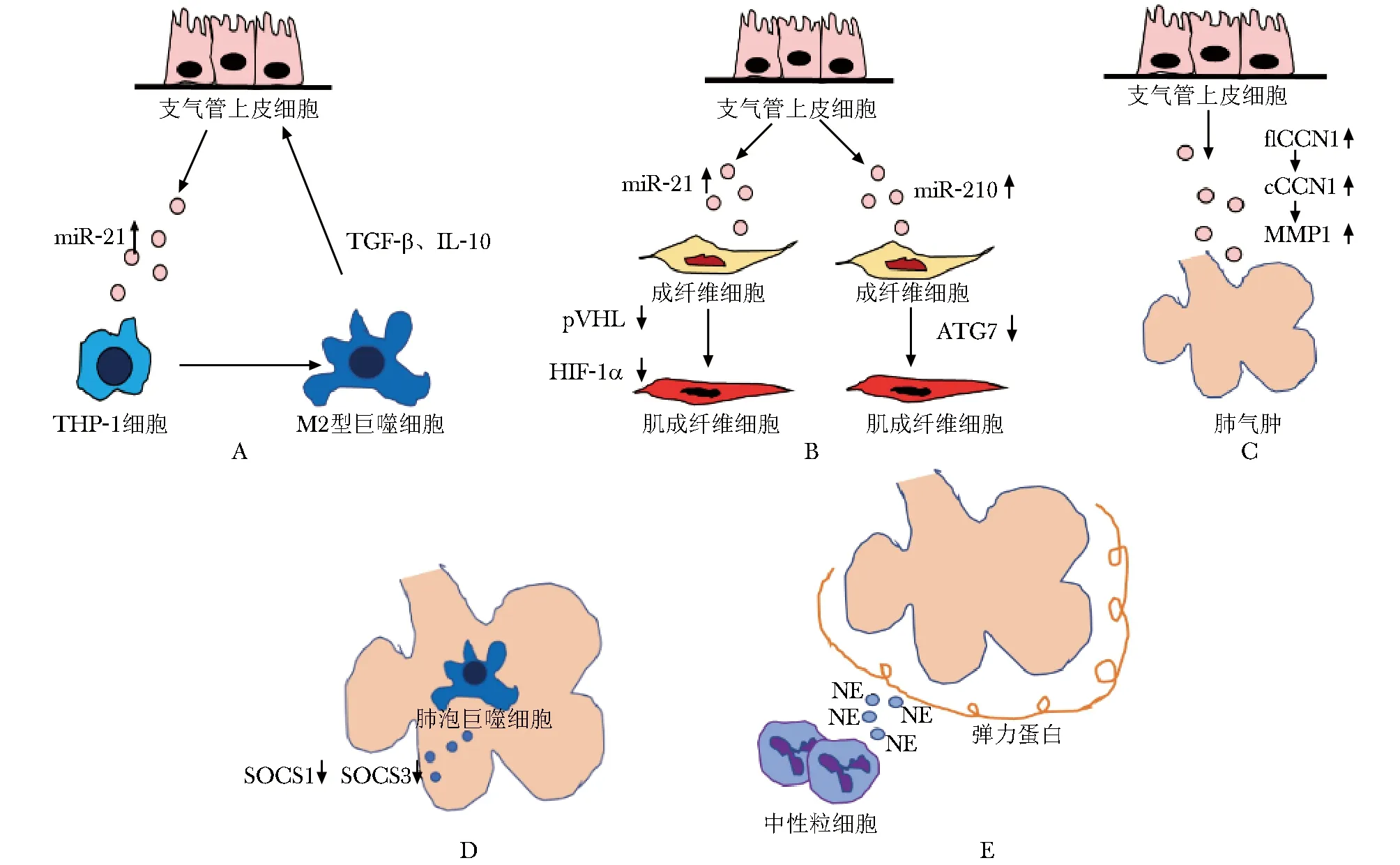
A.exosomal miR-21 derived from bronchial epithelial cells promotes the differentiation of THP-1 into M2 macrophages; B.exosomal miR-21 and miR-210 in exosomes from bronchial epithelial cells promote the differentiation of fibroblasts into myofibroblasts; C.CCN1 in exosomes derived from bronchial epithelial cells induces alveolar apoptosis via MMP1; D. the reduce of SOCS1 and SOCS3 in exosomes derived from macrophages makes the protective and anti-inflammatory effects disappear; E. elastase bounded on the surface of exosomes derived from neutrophils promotes the occurrence of emphysema
2.2 炎性细胞来源的外泌体
巨噬细胞和中性粒细胞是构成COPD慢性炎性反应的重要细胞,在COPD小鼠模型和COPD患者的肺泡灌洗液、肺组织中均发现巨噬细胞和中性粒细胞数量显著增多[14]。
2.2.1 巨噬细胞来源的外泌体:巨噬细胞是肺泡常驻免疫细胞。正常情况下,肺泡内仅含少量的巨噬细胞,香烟烟雾等有毒有害颗粒和气体可诱导巨噬细胞浸润和活化,活化的巨噬细胞分泌白细胞介素8(interleukin 8,IL-8)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白三烯B4等炎性因子,破坏周围的肺实质。因此,巨噬细胞活化是COPD气肿发生发展的重要原因[15]。
肺泡上皮和邻近的肺泡巨噬细胞在生理和病理状态下均有密切交流。肺泡巨噬细胞(alveolar macrophages, AM)的形成与肺泡上皮细胞分泌的表面活性蛋白A、TNF-α、IL-10和前列腺素E2有关[16]。生理状态下, 肺泡巨噬细胞可以向邻近的肺泡上皮细胞释放含有细胞因子信号抑制分子1(suppressor of cytokine signaling 1,SOCS1)的外泌体和富含细胞因子信号抑制分子3(suppressor of cytokine signaling 3,SOCS3)的微囊泡。炎性因子激活JAK/STAT通路,STATs磷酸化后形成二聚体,进入细胞核,诱导下游信号传导蛋白表达,而细胞因子信号传导抑制因子SOCS蛋白家族可通过使JAKs的细胞因子受体磷酸化,阻断细胞因子对JAK的激活,切断JAK/STAT信号传导通路[17]。AM来源的微粒进入肺泡上皮细胞后,SOCS1和SOCS3可以抑制胞内由炎性因子刺激导致的JAK/STAT通路的激活,阻止炎性反应的放大,从而维持肺泡周围微环境的稳态[18]。香烟烟雾刺激下,AM数量显著增加,相反的,通过AM分泌外泌体和微囊中包含的SOCS1和SOCS3蛋白水平减少,使肺泡巨噬细胞的保护抗感染作用消失(图1D)。这一现象为探讨香烟烟雾等有毒有害颗粒和气体导致肺气肿的机制提供了新思路。
2.2.2 中性粒细胞来源的外泌体:中性粒细胞是COPD主要炎性细胞之一,吸入有毒有害颗粒和气体后,肺内中性粒细胞募集活化,向周围释放弹力蛋白酶、多种细胞因子及氧自由基,同时中性粒细胞胞外杀菌网络形成增加[19-20]。中性粒细胞释放蛋白酶过量或肺内抗蛋白酶活性降低,蛋白酶/抗蛋白酶失衡会使肺泡外的弹性蛋白和Ⅰ型胶原被结合降解,导致肺气肿发生[21-22]。
与不吸烟正常人相比,在COPD患者肺泡灌洗液中发现,中性粒细胞来源外泌体表面结合有大量中性粒细胞弹力蛋白酶。进一步将COPD患者的肺泡灌洗液通过气管滴注处理小鼠后,发现小鼠出现明显的肺气肿。在细胞水平上,活化的中性粒细胞会分泌更多的外泌体,中性粒细胞弹力蛋白酶以膜结合蛋白的形式黏附在外泌体表面,不仅有经典途径分泌的中性粒细胞弹力蛋白酶一样的活性,而且可以准确定位于Ⅰ型胶原[23]。中性粒细胞来源外泌体调节可以作为治疗COPD肺气肿的新靶点(图1E)。
2.2.3 干细胞来源的外泌体:外泌体具有免疫排斥少,内含物稳定,半衰期长和靶向传递的优势,其中,人间充质干细胞和脂肪干细胞衍生的外泌体是无细胞再生医学的有前途的治疗剂,在肿瘤疾病、神经系统疾病、呼吸系统疾病和心血管系统疾病等中均有应用[24]。干细胞来源外泌体在COPD治疗方面也已经有了初步的研究。间充质干细胞释放出的外泌体可以缓解CSE诱导的支气管上皮细胞线粒体功能障碍,同时,间充质干细胞联合其外泌体腹腔注射可以减轻香烟烟雾刺激引起的小鼠气道炎性反应[25];人胎盘提取的间充质细胞来源的外泌体与免疫调节因子混合,在小鼠和临床实验中均证实其具有促进抗炎因子释放、减少炎性细胞浸润、改善肺功能等作用[26];脂肪干细胞衍生的人工外泌体同样具有生物活性,可在较低剂量促进Ⅱ型肺泡上皮增殖,经气管内滴注后,其可通过增加小鼠肺部成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)蛋白水平而有效地缓解弹力蛋白酶构建的小鼠肺气肿,为未来在治疗COPD肺气肿提供了新的思路[27]。
3 问题与展望
综上所述,外泌体是近年来受到广泛关注的细胞间通讯工具和靶向治疗药物载体,可能是肺内各类细胞交流的关键因素。有毒有害颗粒及气体刺激下,肺内多种细胞通过外泌体相互沟通,参与COPD病理特征形成,同时,干细胞来源外泌体可应用于COPD的治疗。虽然对外泌体与COPD的关系的研究越来越多,但是外泌体在COPD临床应用方面的价值仍待进一步探索。
外泌体一定程度上可以反应细胞状态,是细胞向周围甚至远隔细胞传递信息的桥梁。理论上,根据这些信息的组合及分析可以判断疾病的发生、严重程度和预后等。但是由于在体液中尤其是肺泡灌洗液中,提取外泌体往往较为困难,因此,外泌体在COPD中的应用还较少。近年来外泌体分离和检测技术日渐成熟,高通量检测数据库的逐渐完善,其他疾病中外泌体在诊断、治疗和预后方面的应用不断增多,为外泌体在COPD方面应用打下基础,在不久的将来,外泌体用以作为监测COPD疾病进程和风险预估的标志物也将成为可能。
