环状RNA在椎间盘退变中的作用机制及临床价值
2020-12-17张凯施锦涛张晓勃王克平周海宇
张凯,施锦涛,张晓勃,王克平,周海宇,*
1兰州大学第二医院骨科,兰州 730030;2甘肃省骨与关节疾病研究重点实验室,兰州 730030;3兰州市西固区人民医院骨科,兰州 730060
腰背痛是骨关节疾病最常见的症状之一,与椎间盘退变(intervertebral disc degeneration,IDD)密切相关[1]。据统计,有75%~80%的人群在生活中经历过这种疼痛[2]。IDD导致的病理改变主要包括髓核(nucleus pulposus,NP)细胞凋亡和细胞外基质(extracellular matrix,ECM)分解,而目前的治疗以缓解症状为主,并不能逆转IDD的病理改变。最新研究发现,环状RNA(circular RNAs,circRNAs)作为内源性竞争RNA能够自发地与微小RNA(microRNA,miRNA)结合,调控IDD相关基因的表达,通过影响髓核细胞凋亡、ECM稳态,诱导促炎因子表达及调节压力负荷等方式参与IDD的病理过程[3]。本文对近年来circRNAs在IDD发病机制中的研究进展进行综述,旨在为IDD的诊断和治疗提供参考。
1 CircRNA概况
CircRNA是一种普遍存在于真核生物中的新型非编码RNA(noncoding RNA,ncRNA),是由单链线性RNA的首尾端以3',5'-磷酸二酯键形成的闭合环状分子[4]。1976年,Sanger等[5]在研究类病毒RNA时发现了一种无蛋白外壳包裹的单链闭合环状RNA,首次证实了circRNAs的存在。但受限于当时的研究技术及检测水平,其发现并未引起研究者的广泛关注。随着高通量测序和生物信息学技术的广泛应用,越来越多的circRNAs相继被发现和报道[6-9],其生物学功能相关研究也更加深入。
CircRNAs由来源于外显子和(或)内含子的核酸片段组成,根据来源不同可分为外显子circRNA (ecRNA)、内含子circRNA(ciRNA)和外显子-内含子circRNA(EIciRNA)。这些核酸片段通过不同的排列组合组成了数量庞大的circRNAs库,目前人体中明确存在的circRNAs至少在14万种以上[10],研究其功能对人们了解疾病的发展进程起着至关重要的作用。根据目前的研究结果,可将其生物学功能总结为以下几方面:①作为内源性竞争RNA(ceRNA)。CircRNAs具有大量的miRNA应答元件(miRNA response element,MRE),能够竞争性结合miRNA,继而抑制miRNA发挥其生物学功能,如circCCDC9能结合miR-6792-3p并抑制miRNA对靶基因CAV1的调控作用,继而延缓胃癌的发展[11]。②调控基因转录。CircRNAs能与mRNA结合并参与mRNA的转录调控,如circ_406961可与白细胞介素增强结合因子2(ILF2)相互作用,影响其对转录激活因子3(STAT3)和丝裂源蛋白激酶8(MAPK8)的磷酸化[12]。③与蛋白产生交互作用。如circPABPN1可与RNA结合蛋白HuR结合,抑制后者与核多聚腺苷酸结合蛋白(PABPN1)mRNA的结合,降低PABPN1翻译的效率[13]。④直接翻译合成蛋白质。CircRNAs可像mRNA一样作为模板并指导蛋白质的合成,如circSHPRH可以编码一种新肽SHPRH-146aa,能防止SNF2组蛋白连接子PHD环解旋酶(SHPRH)被E3连接酶降解[14]。除上述主要生物学功能外,circRNAs还可通过调控细胞间信号传递、调节细胞分化、充当蛋白质支架等[15-16]方式参与疾病的发生发展。
2 CircRNAs与椎间盘退行性疾病
椎间盘退行性疾病(intervertebral disc degeneration disease,DDD)是一种以IDD为特征性改变的脊柱关节疾病,也是临床上引起腰背痛的主要原因。正常的椎间盘由中心的髓核、外层的纤维环和上下软骨终板组成,其中髓核是维持椎间盘功能的主要部分,可通过产生ECM、分泌促炎因子、缓冲压力负荷等方式保持椎间盘的完整性[17]。目前引起IDD的确切病因仍不清楚,可能与髓核细胞凋亡、ECM代谢失衡、炎性因子增多、压力负荷过度和软骨终板变性等多种因素相关[18]。随着测序技术和生物信息学的广泛应用,越来越多的研究发现circRNAs参与调控IDD相关基因的表达,可通过影响髓核细胞凋亡、破坏ECM稳态、诱导促炎因子表达等方式调节IDD的病理过程。
3 CircRNAs在IDD中的作用
3.1 CircRNAs与髓核细胞凋亡 凋亡是机体为维持内环境稳态而自主控制的程序性细胞死亡过程,正常椎间盘的增殖和凋亡保持相对稳定,但年龄增长、过度的压力负荷及炎症反应等因素都会引起髓核细胞过度凋亡,使椎间盘的正常结构难以维持,加速其退变过程,所以维持髓核细胞数量稳定在椎间盘退变过程中至关重要。Guo等[19]通过生物信息学分析发现circGRB10与miR-328-5p之间存在负向调控关系;应用RT-qPCR技术对比40对样本中circGRB10和miR-328-5p的表达水平发现,退变的髓核细胞中circGRB10表达下降而miR-328-5p表达上升。随后,通过实验验证了circGRB10可结合miR-328-5p并导致细胞增殖相关靶基因通过酪氨酸激酶受体(ERBB2)通路表达上调,抑制髓核细胞凋亡。Xie等[20]也在分析circRNAs芯片数据的基础上发现,circERCC2在椎间盘退变过程中低表达,并通过体内和体外实验证实circERCC2可通过与miR-182-5p结合而调控去乙酰化酶SIRT1(Sirtuin1)的表达,而SIRT1又可通过SIRT1/Parkin途径调控细胞的自噬和凋亡[21-24]。Cui等[25]通过siRNA干扰髓核细胞中circ_001653的表达并进行流式细胞检测发现,与对照组比较,干扰组中G1期细胞数量减少而S期细胞数量增多,说明circ_001653能够抑制髓核细胞增殖。此外,circVMA21能通过影响X连锁凋亡抑制蛋白(XIAP)的表达而调控髓核细胞凋亡,加快或延缓IDD进程[26]。
3.2 CircRNAs与ECM稳态 ECM是髓核细胞生存的微环境,主要由胶原蛋白、聚蛋白聚糖、非胶原蛋白、弹性纤维、糖蛋白及水组成,其中Ⅱ型胶原蛋白和聚蛋白聚糖是维持椎间盘正常结构和功能的最重要成分。在正常椎间盘中,ECM的分解和合成相对稳定,各种原因引起的ECM分解增加都会对椎间盘的正常结构和功能产生不良影响,如Ⅱ型胶原蛋白和聚蛋白聚糖过度分解会引起纤维环溶解,髓核脱水和纤维化,以及软骨终板钙化[27],还会使ECM的吸水性减弱、含水量降低,导致椎间盘不能耐受压力,髓核细胞也会因为缺乏营养物质和生长因子而凋亡,继而加速IDD过程[28]。目前研究发现,circRNAs调控ECM主要通过影响ECM代谢和调控促炎因子的表达两种方式。
3.2.1 CircRNAs与ECM代谢 基质金属蛋白酶(M M Ps)及血小板反应蛋白去整合素金属肽酶(ADAMTSs)是降解ECM中胶原蛋白和聚蛋白聚糖的主要酶。研究显示,MMPs和ADAMTSs在IDD组织中表达升高,而抑制其表达可促进ECM修复并延缓IDD进程[29]。Guo等[30]通过RT-qPCR技术对比了正常和退变的髓核组织,发现circFAM169A在退变组织中表达增高,随后通过细胞实验证实circFAM169A能通过miR-583/BTRC途径激活NF-κB通路,促进髓核细胞中MMP-13和ADAMTS-5的合成,进而降低ECM中Ⅱ型胶原蛋白和聚蛋白聚糖的含量,促进IDD的发生。Cui等[25]通过分析芯片数据发现,circ_001653在椎间盘退变组织中高表达,且circ_001653能下调miR-486-3p介导的细胞迁移,从而诱导透明质酸结合蛋白(CEMIP)的表达,促进MMP-3、MMP-13和ADAMTS-4、ADAMTS-5的合成,影响ECM中Ⅱ型胶原蛋白和聚蛋白聚糖的含量,加速IDD进程。除了能促进ECM分解外,部分circRNAs还可抑制MMPs和ADAMTSs的表达,从而抑制胶原蛋白和蛋白聚糖的过度降解,延缓IDD进程。Chen等[31]应用免疫荧光和Western blotting检测发现,circGLCE在退变组织中表达下降,而circGLCE能抑制MMP-13和ADAMTS-4的合成、增加ECM中Ⅱ型胶原蛋白和蛋白多糖的含量,表明circGLCE在IDD过程中起保护作用。Song等[32]发现,circRNA_104670可以与miR-17-3p直接结合,而miR-17-3p的靶基因为MMP-2,所以circRNA_104670能间接调控MMP-2的表达,延缓ECM中Ⅱ型胶原蛋白的分解。此外,circRNAs还能通过影响炎性因子的表达、调节压力负荷诱导的基质降解等方式,间接延缓IDD的进程,如circ_4099、circCIDN等[33-34]。
3.2.2 CircRNAs与促炎因子 研究表明,促炎因子增多也是IDD的主要特征之一,其能刺激神经内生长并引起神经性疼痛,是造成腰背痛的主要原因[35]。促炎因子如肿瘤坏死因子(TNF)、白细胞介素(IL)和干扰素(IFN)等,主要由髓核细胞分泌[36],其中TNF-α和IL-1β的研究最为深入。IL-1β和TNF-α能诱导ECM降解相关酶基因的表达,如MMP-1、3、7、9、13和ADAMTS-1、4、5、9、15等,所以抑制促炎因子的表达能维持ECM稳态、缓解椎间盘退变[37]。目前研究发现,多种circRNAs可作为ceRNA与miRNAs结合,调控下游促炎因子的表达,影响IDD的病理进程。Guo等[30]研究发现,circFAM169A在退变的髓核组织中高表达,且能作为miR-583的ceRNA与其竞争性结合,影响miR-583对下游靶基因BTRC的调控,而BTRC能使NF-κB的结合物降解,激活NF-κB通路诱导的IL-1β和TNF-α的表达,上述促炎因子已被证实可以降解ECM、加重IDD[37]。Cui等[25]的研究发现,circ_001653能通过与miR-486-3p竞争性结合,间接调控其靶基因CEMIP介导的TNF-α和IL-1β表达,致使促炎因子介导的ECM降解作用增强。Wang等[38]通过研究IL-1β介导的IDD模型发现,过表达的circSEMA4B能竞争性结合miR-431,促进Wnt/β-catenin通路介导的ECM分解。此外,TNF-α还能通过NF-κB/MAPK通路诱导circ_4099的表达,而升高的circ_4099能通过miR-6161-5p/Sox9信号轴调节转录因子Sox9对Ⅱ型胶原蛋白和聚蛋白聚糖的表达,起到维持ECM稳态和保护椎间盘的作用[33]。
3.3 CircRNAs与压力负荷 椎间盘作为一个吸收和缓冲机械应力的结构,在日常生活中会受到不同程度的压力负荷。研究表明,过度的压力负荷会增加普通人群患IDD的风险,而且机械应力也是导致椎间盘重塑的主要原因[39]。已有研究证实,过度的压力负荷会诱导髓核细胞凋亡和ECM降解,加速IDD进程[40-41]。Xiang等[34]初次揭示了压力损伤中circRNAs的作用,通过对比压力损伤的髓核细胞和正常髓核细胞中circRNAs的表达变化发现,circCIDN在压力损伤细胞中表达显著降低。随后,通过分析StarBase和TargetScan数据库,预测circCIDN可能通过与miR-34a-5p结合,影响其靶基因SIRT1对髓核细胞自噬、凋亡以及衰老的调控功能,并通过细胞和动物实验进行了验证。此外,软骨终板变性也是IDD的主要改变之一。Xiao等[42]研究发现,压力负荷能够诱导终板软骨细胞表达circRNA_0058097,而后者可通过miR-365a-5p/HDAC4通路导致终板软骨细胞退变。所以,压力负荷导致的circRNAs改变也在IDD过程中起到重要作用。图1简要总结了上述与IDD相关的circRNAs的表达差异及作用机制,如circFAM169A在退变组织中表达升高,继而竞争性结合miR-583,阻断了miRNA对下游BTRC/NF-κB通路的抑制作用,该通路激活会诱导TNF-α和IL-1β的表达,促进ECM降解,加重IDD。
4 CircRNAs的临床研究价值
4.1 作为疾病诊断的标志物 CircRNAs的特殊闭环结构能够保护其不受核酸外切酶的影响,所以较线性RNA分子更加稳定。有研究显示,circRNAs的半衰期是线性RNA的2.5倍[43]。CircRNAs具有稳定性好、表达丰度高的特点,且在不同疾病中存在明显的表达差异,在疾病的临床诊断中具有潜在的实用价值[44]。表1总结了部分可作为骨科疾病诊断标志物的circRNAs。随着circRNAs研究的不断深入,将来会有更多与疾病相关的circRNAs被发现并运用到各种疾病的诊断中。
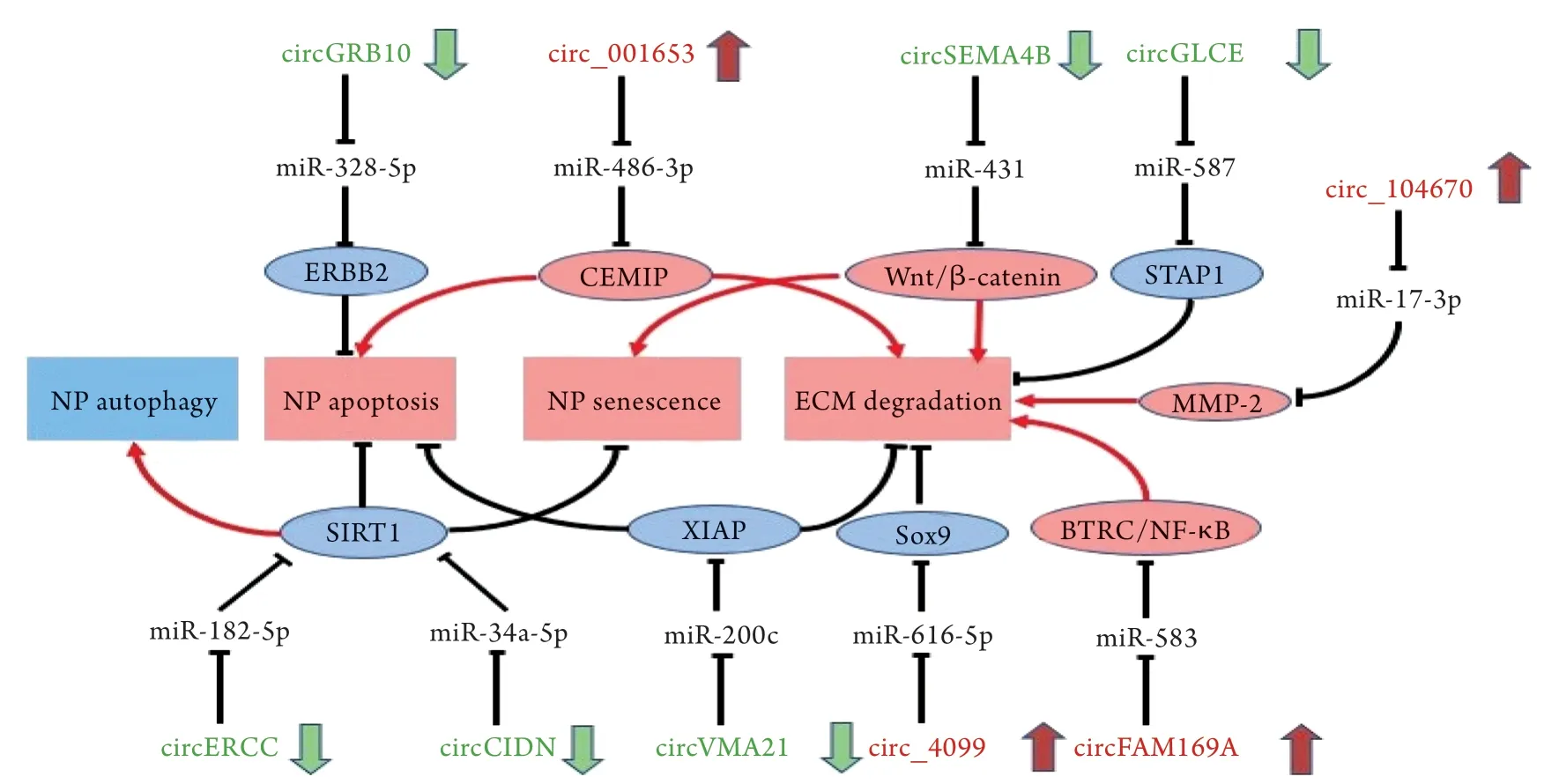
图1 CircRNAs在椎间盘退变组织中的表达差异及作用机制Fig.1 Expression differences and mechanisms of circRNAs in the degenerative tissue of intervertebral disc
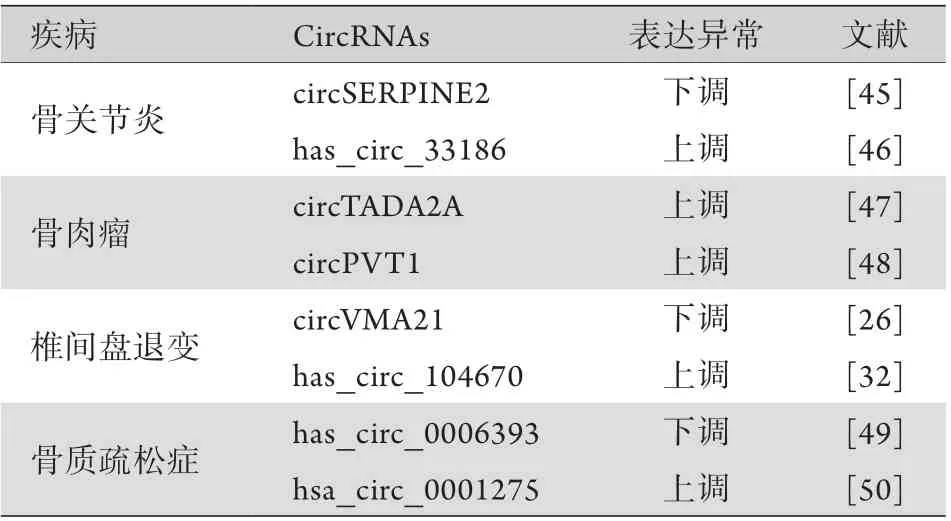
表1 常见骨科疾病的诊断标志物circRNAsTab.1 The circRNAs as biomarkers in common orthopedic diseases
4.2 作为疾病的靶向治疗药物 随着对外泌体研究的不断深入,人们发现其包含的内容物非常广泛,包括各种生长因子、蛋白质、脂质、核酸和circRNAs等[51],而且外泌体中含有的circRNAs丰富且稳定,并可在外周循环和尿液中检测到[52]。最近研究发现,包含circRNA_0000253的外泌体在退变组织中含量最高,且能通过miR-141-5p/SIRT1轴促进IDD,表明circRNAs可通过外泌体转运的方式转移至不同组织而发挥生物学功能,这为生物治疗(包括基因靶向治疗)提供了理论依据,使其有望成为一种新型的靶向治疗药物[53]。
综上所述,近年来,IDD的发病率逐年增高且发病人群呈年轻化趋势,目前最有效的治疗措施仍是外科手术,虽然手术治疗能缓解或消除患者的症状,但并不能逆转IDD的进程,所以亟需新的有效的治疗手段。随着芯片测序和生物信息学的快速发展,越来越多的研究证实circRNAs在多种疾病的发生发展过程中发挥着重要调控作用。目前研究发现,circRNAs在IDD进程中主要充当ceRNA而发挥miRNA“海绵”的作用,通过结合miRNAs影响其对靶基因转录和翻译的调控,而circRNAs在IDD中是否具有其他生物学功能仍需进一步研究。由于circRNAs具有稳定性、保守性及组织特异性等特点,并且能通过外泌体转运至靶组织发挥生物学效应,其在疾病筛查、诊断和药物靶向治疗方面具有巨大潜能,因此未来需进一步研究circRNAs在IDD诊断和治疗中的作用。
