氨基葡萄糖对IL-1β诱导人骨关节炎软骨细胞蛋白聚糖分解代谢的影响
2013-09-13杨建辉吕建国申晓东西安交通大学第一医院疼痛科陕西西安710061
杨建辉 吕建国 王 辉 申晓东 (西安交通大学第一医院疼痛科,陕西 西安 710061)
蛋白聚糖是软骨细胞分泌的一种蛋白多糖大分子,是关节软骨细胞外基质的主要成分之一。在骨关节炎(OA)发病机制的研究中,人们发现蛋白聚糖和胶原纤维的降解是OA发病的主要生理和病理学基础〔1〕。氨基葡萄糖不仅可以减轻OA疼痛症状,同时可以延缓OA的病理改变,为改变病情药物〔2〕。本研究利用体外培养OA患者软骨细胞体系,通过检测软骨细胞糖胺多糖(GAG)及蛋白聚糖代谢片段的变化,以及蛋白聚糖、可聚蛋白聚糖酶-1(Aggrecanase-1)和可聚蛋白聚糖酶-2(Aggrecanase-2)mRNA的表达,了解氨基葡萄糖对白细胞介素-1β(IL-1β)诱导OA软骨细胞蛋白聚糖分解代谢的作用。
1 材料与方法
1.1 试剂与药品 胰蛋白酶、细胞培养液达氏修正依氏培养基(DMEM)/F12(Gibco公司),Ⅱ型胶原酶、IL-1β(Sigma公司),噻唑蓝(MTT,Amresco公司),二甲基亚甲蓝(DMMB,Serva公司),硫酸软骨素A(Seikagaku Kogyo公司),总RNA提取试剂盒(RNeasy MiniKit,QIAGEN Pty Led Australia),反转录-聚合酶链式反应(RT-PCR)试剂(华美生物制品公司),抗蛋白聚糖单克隆抗体(monoclonal antibody,Mab)3B3及5D4(Invitrogen公司),引物由上海生工生物工程有限公司提供。氨基葡萄糖(商品名:伊索佳-浙江海正药业生产)。
1.2 含药血清和正常兔血清的制备 根据文献〔3〕,将氨基葡萄糖按体表面积折算动物的等效剂量,再用生理盐水配成8 ml溶液给新西兰大白兔灌胃,正常兔血清则以生理盐水8 ml灌胃。连续2次灌胃,中间间隔2 h,在末次灌胃的3 h后,乙醚和氯胺酮复合麻醉下腹主动脉采血,4℃冰箱过液后,离心2 500 r/min ×25 min,抽取血清,56℃、30 min 灭活,经 0.45 μm滤膜抽滤除菌、分装,-20℃保存备用。
1.3 软骨细胞的分离与培养 软骨细胞取自OA患者进行膝关节置换术的软骨组织,参考文献〔4〕,用尖刀片仔细分离胫骨平台、股骨髁以及髌骨关节面的软骨。将软骨块用D-Hank's液漂洗,剪碎至1 mm3大小,加入0.25%胰蛋白酶消化30 min,然后再加入0.2%Ⅱ型胶原酶,置震荡器上,37℃震荡消化1 h,将游离出的带有酶溶液的软骨细胞用吸管吸出,120目尼龙网筛过滤,获取软骨细胞,细胞活力分析仪检测细胞活力>95%。将消化所得的细胞悬浮于含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM/F12培养基中,密度为105cells/ml(Vi-cell细胞活力分析仪计数)接种于25 cm2培养瓶中,置37℃ 5%CO2培养箱中培养,逐日倒置显微镜观察,隔2~3 d换液,原代贴壁细胞单层融合后按1∶2传代。第一代软骨细胞采用MTT法检测不同浓度IL-1β和含氨基葡萄糖血清兔血清存在条件下的细胞存活率,选择细胞存活率均≥95%的适当IL-1β和含氨基葡萄糖血清浓度做进一步的实验。结果IL-1β浓度为10 ng/ml,含氨基葡萄糖兔血清最高浓度为40%。
1.4 加药培养 将第一代软骨细胞转入12孔的组织细胞培养板,每孔细胞数为1.5×105/L,培养48 h后,用不含小牛血清的培养液洗2次,此后的培养均采用无小牛血清的培养液,以去除小牛血清对GAG和蛋白聚糖分解片段测定的干扰。吸弃孔中培养液,进行试验分组。实验分为5组,A组(兔血清对照组):培养液中无任何刺激因子,每孔加入正常兔血清100 μl;B组(IL-1β对照组):培养液含10 ng/ml IL-1β+正常兔血清100 μl;C组:培养液含10 ng/ml IL-1β+10%含氨基葡萄糖血清100 μl;D组:培养液含10 ng/ml IL-1β+20%含氨基葡萄糖血清100 μl;E组:培养液含10 ng/ml IL-1β+40%含氨基葡萄糖血清100 μl;每组设4个复孔,连续培养48 h进行检测。实验重复3次。
1.5 溶解软骨细胞用于测定细胞内GAG含量 全过程均在碎冰上进行。将细胞培养板移至碎冰上,用1 ml磷酸盐缓冲液(PBS)轻柔洗细胞1次,然后每孔加人300 μl细胞溶解液,冰上作用20 min,将溶解液移至离心管,4℃离心10 min,收集上清液透析后储存于-20℃,用于检测细胞内GAG。
1.6 软骨细胞及培养液中GAG的测定 GAG的含量测定是检测蛋白聚糖代谢的一个常用指标〔5〕。体外软骨细胞培养过程中,GAG释放入培养液中的水平代表蛋白聚糖的降解程度,释放入培养液中的GAG越多,表明蛋白聚糖的降解越明显。本实验采用GAG释放至培养液中的量占总体GAG(细胞内+培养液)的百分率表示蛋白聚糖的降解程度。GAG的含量采用DMMB分光光度法测定〔2〕,以硫酸软骨素A作为标准参照物,计算测定结果。
1.7 竞争性酶联免疫吸附试验(ELISA)法测定蛋白聚糖的两种代谢片段 Mab 3B3和5D4(购自Invitrogen公司)为两种识别蛋白聚糖不同代谢片段的Mab。Mab-3B3可检测蛋白聚糖中核心蛋白区硫酸软骨素(CS)的特定片段,是蛋白聚糖合成的标记。Mab-5D4可与蛋白聚糖核心蛋白区的硫酸角质素(KS)链中重复出现的硫酸化己糖结合,是蛋白聚糖降解的标志物〔6〕。ELISA方法参照 Chan等〔7〕的方法,标准参照物为软骨素酶处理后的蛋白多糖。
1.8 RT-PCR检测软骨细胞蛋白聚糖、可聚蛋白聚糖酶-1和可聚蛋白聚糖酶-2 mRNA的表达 选取经不同处理因素作用48 h的12孔板细胞,每孔加入1 ml Trizol按说明书提取总RNA;然后通过RT-PCR反转录合成cDNA,以18 S mRNA作为内对照,对比分析各组软骨细胞内蛋白聚糖、可聚蛋白聚糖酶-1和可聚蛋白聚糖酶-2基因mRNA的表达量。各基因的上下游引物序列以及退火温度见表1。PCR反应体系为:上下游引物各 0.5 μl,dNTP(10 mmol)2 μl,25 mmol MgCl22 μl,Taq DNA聚合酶 0.5 μl,cDNA 模板 2 μl,10 × PCR 缓冲液 2.5 μl,总反应体系25 μl。PCR反应扩增条件:90℃预变性5 min,进入循环,95℃变性45 s,分别在蛋白聚糖:55℃;可聚蛋白聚糖酶-1:60℃;可聚蛋白聚糖酶-2:60℃;18 S mRNA:57℃的温度退火45 s后,72℃延伸45 s的条件下循环扩增,进行35个循环,72℃再延伸7 min。扩增产物在1.5%琼脂糖凝胶上电泳,紫外分析仪下观察扩增产物特异条带。产物经凝胶成像及分析系统进行图像分析,测定条带的A值。以18 S作内参照,用蛋白聚糖、可聚蛋白聚糖酶-1和可聚蛋白聚糖酶-2条带的A值与18S条带的A比较,进行目的基因表达的半定量分析。

表1 半定量RT-PCR引物系列及产物长度
1.9 统计学处理 数据用SPSS11.0统计软件处理,采用独立样本t检验和单因素方差分析(LSD)。
2 结果
2.1 GAG结果 比较5组细胞释放入培养液的GAG百分比,其中B组最高(56.4±2.2)%,显著高于C组(t=6.54,P<0.01)、D 组(t=5.34,P <0.01)、E 组(t=5.34,P <0.01)和 A组(兔血清对照组)(t=6.24,P<0.01);C组其次(40.4±2.2)%,明显高于D组(23.4±2.4)%(t=4.98,P<0.01)和E组(11.4±2.4)%(t=5.98,P<0.01),但与A组差异无统计学意义;A组(42.4±2.2)% 明显高于D组和E组,差异有统计学意义(P均<0.01);E组最低,与D组相比差异有统计学意义(P<0.01),提示氨基葡萄糖能够抑制IL-1β对OA软骨细胞蛋白聚糖分解的促进作用,对OA软骨细胞蛋白聚糖的降解亦有明显的抑制作用。
2.2 培养液中3B3片段含量的比较 见表2。E组最高、D组相对较高,与A组、B组相比差异显著(P均<0.01);其次是C组,与A组、B组相比差异显著(P均<0.05);B组、A组最低,二者相比差异无统计学意义(P>0.05)。
2.3 培养液中5D4片段含量的比较 见表2。B组最高,A组和C组次之,其次是D组,E组最低。B组与E组、D组、A组、C组相比差异均有统计学意义,其中 B组与 E组、D组相比(P均<0.01);B组与A组、C组相比(P均<0.05);A组与C组相比差异无统计学意义(P>0.05);E组与D组相比差异有统计学意义(P<0.05)。
表2 不同培养条件软骨3B3片段、5D4片段含量比较(±s ,n=3)

表2 不同培养条件软骨3B3片段、5D4片段含量比较(±s ,n=3)
与A组、B组比较:1)P<0.01;2)P<0.05;与B组相比:3)P<0.05
组别 3B3片段 5D4片段A组 120.43±5.11 209.43±0.0213)B组 123.23±4.12 251.32±0.120 C组 144.32±5.152) 216.43±0.1133)D组 164.23±4.171) 190.45±0.0921)E组 204.14±5.181) 160.52±0.0811)
2.4 蛋白聚糖、MMPs-1及MMPs-3 mRNA的表达 各组软骨细胞蛋白聚糖、可聚蛋白聚糖酶-1、可聚蛋白聚糖酶-2 mRNA相对含量(即与18 S mRNA A值的比值)的比较(见表3)。半定量RT-PCR显示氨基葡萄糖加药组的蛋白聚糖mRNA表达的均值均较对照组明显增高,其中与B组相比(P均<0.01),D组、E组与 A组相比(P<0.01),C组与 A组相比(P<0.05),随氨基葡萄糖浓度的增加,蛋白聚糖mRNA表达逐渐增加;氨基葡萄糖加药组的可聚蛋白聚糖酶-1、可聚蛋白聚糖酶-2 mRNA表达均较对照组明显降低,其中与B组相比(P均<0.01),E组、D组与A组(对照组1)相比(P<0.01),C组与A组相比(P<0.05),随氨基葡萄糖浓度的增加,可聚蛋白聚糖酶-1、可聚蛋白聚糖酶-2 mRNA的表达逐渐降低。
表3 不同培养条件软骨细胞蛋白聚糖、可聚蛋白聚糖酶-1和可聚蛋白聚糖酶-2表达强度比较(±s ,n=3)
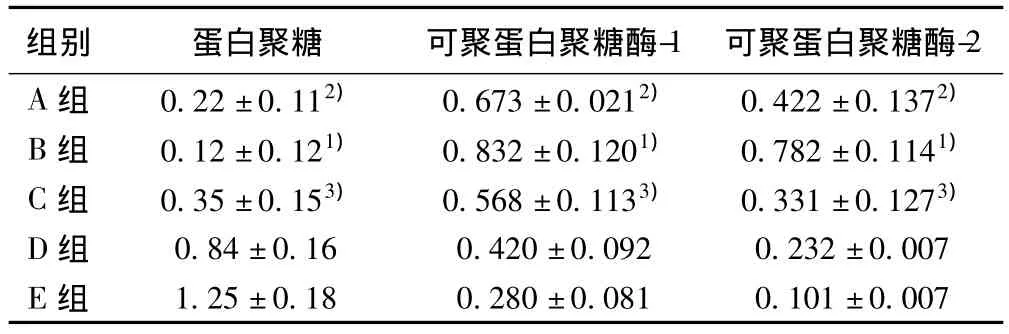
表3 不同培养条件软骨细胞蛋白聚糖、可聚蛋白聚糖酶-1和可聚蛋白聚糖酶-2表达强度比较(±s ,n=3)
组别 蛋白聚糖 可聚蛋白聚糖酶-1 可聚蛋白聚糖酶-2 A组 0.22±0.112) 0.673±0.0212) 0.422±0.1372)B组 0.12±0.121) 0.832±0.1201) 0.782±0.1141)C组 0.35±0.153) 0.568±0.1133) 0.331±0.1273)D组 0.84±0.16 0.420±0.092 0.232±0.007 E组1.25±0.18 0.280±0.081 0.101±0.007
与E组、D组、C组比较:1)P<0.01;与E组、D组比较:2)P<0.01;与A组相比:3)P<0.05
3 讨论
OA是以关节软骨退变为主要表现的常见疾病,软骨细胞功能异常导致蛋白聚糖的代谢紊乱是OA的特征之一〔1〕。既往OA被认为是一种非炎症性的关节病变,但近年来大量的研究证实异常炎症反应在OA的发病中起着重要的作用。已经证实,在骨关节炎关节中有过度的前炎性细胞因子如IL-1β、肿瘤坏死因子(TNF)和炎性介质NO等生成〔8〕。其中IL-1β是存在于OA软骨及滑液中的重要炎性细胞因子,不仅抑制软骨基质的合成,加速胶原和蛋白多糖的降解,而且诱导软骨细胞的凋亡,已作为人工制作OA模型的诱导剂而广泛使用〔9,10〕。氨基葡萄糖是治疗OA的特异性药物,有研究显示氨基葡萄糖能够刺激软骨细胞产生蛋白多糖,参与透明质酸和多聚氨基葡萄糖的合成,同时具有抑制肉芽组织增生、血管渗出和细胞游离,有效改善关节炎的症状〔11〕。
蛋白聚糖是一种复杂的蛋白多糖大分子,它的主体结构主要由核心蛋白、3个球状结构域和1个球间区组成;核心蛋白由大量的GAG链包绕,GAG占蛋白聚糖分子量的80%~90%〔12〕,是蛋白聚糖的决定性功能基团。研究认为,GAG更适合作为蛋白聚糖转化的参考数值,软骨细胞外基质蛋白聚糖解聚、降解,游离的GAG增多等,使得蛋白聚糖失去其正常结构和功能。当软骨细胞功能异常导致蛋白聚糖的降解增多时,过多的GAG可被释放到细胞外基质中,故检测细胞外GAG的含量可反映蛋白聚糖的总体代谢情况〔13〕。OA动物模型关节液中GAG水平异常升高并与病程相关,且经IL-1β作用于OA患者的软骨细胞后,释放入培养液中GAG的百分比明显升高,提示细胞因子IL-1β可促进蛋白聚糖的降解〔14〕。本研究结果验证了IL-1β的确可促进蛋白聚糖的降解,并随氨基葡萄糖浓度的增加,释放入培养液中GAG的百分比逐渐降低。说明氨基葡萄糖能够抑制IL-1β对OA软骨细胞蛋白聚糖分解的促进作用,对OA软骨细胞蛋白聚糖的降解亦有明显的抑制作用。
当软骨细胞功能异常时,过多的蛋白聚糖酶及多种基质金属蛋白酶可作用于蛋白聚糖的不同部位,产生不同的代谢片段。目前针对于蛋白聚糖不同代谢片段的Mab广泛用于蛋白聚糖的代谢研究,它可特异性地与蛋白聚糖的不同代谢片段结合,从而了解蛋白聚糖的代谢状况〔15〕。Mab-3B3和5D4是分别识别CS和KS两种GAG的单克隆抗体,其中Mab-3B3可检测CS区末端天然的CS链,它所检测的3B3片段大量见于胎儿软骨及新合成的软骨中,正常成熟的软骨中几乎检测不到,故研究者认为3B3是蛋白聚糖合成的标记物。研究发现,在早期兔的OA模型中,关节液中3B3片段明显升高,而晚期却检测不到,故认为OA病变早期蛋白聚糖合成活跃可能有利于修复和重建损伤的软骨组织〔16〕。Mab-5D4可与蛋白聚糖的核心蛋白区KS链中重复出现的硫酸化六糖结合,可以检测蛋白聚糖代谢所产生的KS片段,是蛋白聚糖降解的标志物。本实验说明氨基葡萄糖不但能够抑制OA患者蛋白聚糖的降解,而且能够抑制IL-1β诱导的OA患者蛋白聚糖的降解,同时可增加蛋白聚糖合成,达到治疗OA的目的。但IL-1β只具有促进蛋白聚糖降解的作用,而无促进蛋白聚糖合成的作用。
关节软骨破坏有两种途径:一种是内在途径,即软骨细胞自身降解软骨细胞外基质;另一种是外在途径,如炎症滑膜、血管翳组织、浸润的炎症细胞,通过关节滑液破坏软骨细胞外基质。两种途径中酶性降解细胞外基质是软骨破坏的主要原因〔17〕。除基质金属蛋白酶(MMPs)外,可聚蛋白聚糖酶-1和可聚蛋白聚糖酶-2是近年来发现的两种重要的蛋白聚糖降解酶,在OA患者的关节软骨中,这两种酶的mRNA表达均明显增高〔18〕。不同于MMPs作用于蛋白聚糖核心蛋白球间区域(IGD)Asn341 Phe342位点,可聚蛋白聚糖酶的作用部位则是蛋白聚糖核心蛋白IGD区域 Glu373 Ala374位点,而且该位点被认为是蛋白聚糖降解的关键部位〔19〕。随后的研究发现,Aggrecanase介导的蛋白聚糖降解在OA软骨退变中首先发生,依赖MMPs的蛋白聚糖核心蛋白的降解开始大约3 w后才能检测到,与此同时,胶原的降解才开始发生〔20〕。并且同时抑制可聚蛋白聚糖酶-1和可聚蛋白聚糖酶-2能防止关节软骨的蛋白聚糖降解,据此相信,Aggrecanase介导的蛋白聚糖降解,在软骨细胞外基质代谢平衡异常的退变破坏过程中不仅起重要作用,而且可能是事件的始发者〔18〕。本研究观察到代表核心蛋白降解的5D4片段明显升高,推测这两种酶可作用于人软骨蛋白聚糖的核心蛋白区,导致蛋白聚糖的降解。
1 Krasnokutsky S,Samuels J,Abramson SB.Osteoarthritis in 2007〔J〕.Bull NYU Hosp Jt Dis,2007;65(3):222-8.
2 皮俊杰,吕志伟,闫志荣,等.前交叉韧带切断诱导兔膝骨关节炎模型:阿仑磷酸钠与盐酸氨基葡萄糖对其关节软骨和软骨下骨的保护作用〔J〕.中国组织工程研究与临床康复,2010;14(28):5151-4.
3 詹红生,赵咏芳,冯 伟.含药血清方法在中药调节骨与软骨代谢基础研究中的应用〔J〕.中国骨伤,2000;13(11):661-2.
4 司徒镇强,吴军正.细胞培养〔M〕.西安:世界图书出版西安公司,2004:21-3.
5 Farndale RW,Buttle DJ,Barrett AJ.Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue〔J〕.Biochem Biophys Acta,1986;442(883):173-7.
6 Garnero P,Rousseau TC,Delmas PD.Molecular basis and clinical use of biochemical markers of bone,cartilage,and synovium in joint disease〔J〕.Arthritis Rheum,2000;12(43):953-68.
7 Chan SS,Kent GN,Will RK.A sensitive assay for the measurement of serum chondroitin sulfate 3B3(-)epitope levels in human rheumatic disease〔J〕.Clin Exp Rheumatol,2001;7(19):533-40.
8 Jatvinen K,Vuolteenaho K,Nieminen R,et al.Selective inNOS inhibitor 1 400 W enhances anti-catabolic IL-10 and reduces destructive MMP-10in OA cartilage.Survey of the effects of 1 400 W on inflammatory mediators produced by OA cartilage as detected by protein antibody array〔J〕.Clini ExpRheumatol,2008;26(2):275-82.
9 de lsla NG,Stoltz JF.In vitro inhibition of IL-1 beta catabolic effects on cartilage:a mechanism involved on diacerein anti-OA properties〔J〕.Biorheology,2008;45(34):433-8.
10 Schuerwegh AT,Dombrecht ET,Stevens WJ,et al.Influence of pro-inflammatory(IL-alpha,IL-6,IFN-gamma)and anti-inflammatory(IL-4)cytokines on chondrocyte function〔J〕.Osteoarthritis Cartilage,2003;11:681-7.
11 张伟斌,庄澄宇,李健明,等.盐酸氨基葡萄糖治疗骨性关节炎有效性与安全性评价〔J〕.中华外科杂志,2007;45(14):998-1001.
12 Kiani C,Chen L,Wu YJ,et al.Structure and function of aggrecan〔J〕.Cell Res,2002;12(14):19-32.
13 Pottenger LA,Webb JE,Lyon NB.Kinetics of extraction of PG from human cartilage〔J〕.Arthritis Rheum,1985;28(3):323-30.
14 Innes JF,Little CB,Hughes CE,et al.Products resulting from cleavage of the interglobular domain of aggrecan in samples of synovial fluid collected from dogs with early-and late-stage osteoarthritis〔J〕.Am J Vet Res,2005;66(34):1679-85.
15 Caterson B,Flannery CR,Hughes CE,et al.Mechanisms involved in cartilage proteoglycan catabolism〔J〕.Metrix Biol,2000;19(13):333-44.
16 Lovasz G,Park SH,Ebramzadeh E,et al.Characteristics of degeneration in an unstable knee with a corona surface step-off〔J〕.J Bone Joint Surg(Br),2001;83-B:428-36.
17 Yasuo Y,Hiroyuki N,Kenichi O,et al.Matrix metalloproteinases and tissue inhibitors of metalloproteinases in synovial fluids from patients with rheumatoid arthritis or osteoarthritis〔J〕.Ann Rheum Dis,2000;59(12):455-61.
18 Malfait AM,Liu RQ,Ijiri K,et al.Inhibition of ADAM-TS4 and ADAMTS5 prevents aggrecan degradation in osteoarthritic cartilage〔J〕.J Biol Chem,2002;21:22201-8.
19 Caterson B,Flannery CR,Hughes,et al.Mechanisms involved in catabolism〔J〕.Matrix Biol,2000;19(6):333-4.
20 Little CB,Hughes CE,Curtis CL,et al.Matrix metalloproteinases are involved in C-terminal and interglobular domain processing of cartilage aggrecan in late stage cartilage degradation〔J〕.Matrix Biol,2002;21(9):271-88.
