三七对急性脑缺血/再灌注损伤大鼠神经血管单元的整体保护作用研究
2020-12-17农立宇蒙兰青
梁 萍,黄 清,农立宇,林 军,刘 蕾,蒙兰青,3
(1.右江民族医学院桂西地区高发病防治研究重点实验室,广西 百色 533000;2.广东医科大学附属第二医院神经内科,广东 湛江 524000;3.右江民族医学院附属医院神经内科,广西 百色 533000)
缺血性脑卒中(ischemic stroke,IS)是由缺血缺氧性脑组织坏死导致神经功能缺失症状的一种疾病,约占全球死亡总数的11%[1]。脑缺血/再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是IS重要的级联反应过程,涉及多个病变机制,最终导致神经元等多种脑细胞凋亡、坏死[2]。 “神经血管单元(neurovascular unit, NVU)”作为IS的整体救治模型,旨在挽救包含神经元、星形胶质细胞、微血管内皮细胞在内的缺血脑组织[3]。随着医学水平的提高和中药整体观的认可,人们发现被誉为“人参之王”的三七(PanaxNotoginseng,PN)在CIRI治疗过程发挥了较大的作用。PN是五加科人参属草本植物,含有多种活性成分,可通过抑制CIRI后多个病理生理环节[4-5],促进脑缺血后NVU组分的修复[6],发挥明显的抗CIRI作用。但目前,三七总皂苷(PanaxNotoginsengSaponins,PNS)(PN的有效活性成分之一)在临床中IS的治疗更加常见。将PN整体活性成分用于CIRI的治疗是一个新的探索。本研究中,通过观察大鼠神经行为学表现、脑梗死体积百分比、NVU超微结构变化,同时测定氧糖剥夺再灌注(oxygen-glucose deprivation and reperfusion,OGD/R)后,细胞共培养模型中的4 h渗漏及细胞凋亡率,进一步评价PN对脑缺血后NVU的保护作用,也为将PN开发成一种治疗IS的多靶点保护药物提供实验依据。
1 材料与方法
1.1 动物SPF级SD♂大鼠100只,体质量(250±30)g,制作MCAO大鼠模型。2 ∶1雌雄比例的大鼠共15只,体质量(300±30)g,用来繁殖新生幼鼠。大鼠均购自湖南长沙市天勤生物技术有限公司,许可证号为SCXK(湘)2014-0011。实验过程严格按照《中国实验动物使用和管理办法》执行。
1.2 药品三七粉,购自文山市苗乡三七实业有限公司,执行标准:《中国药典》2015年版一部,产品批号:C20180803。称取一定量三七粉,将其用生理盐水稀释配成终浓度为5、10、15 g·L-1的溶液灌胃。
1.3 主要试剂与耗材4%多聚甲醛(货号:P110)、氯化2,3,5三苯基四氮唑(TTC,货号:G3005)、含EDTA胰蛋白酶(货号:T1300)、不含EDTA胰蛋白酶(货号:T1350)、10×多聚赖氨酸(货号:P2100)、PBS(货号:P1020)、细胞培养瓶(货号:30710126,156499)、15 mL离心管(货号:430790)、0.22灭菌滤器(货号:SLGP033RB)均购自Solarbio公司;电镜固定液(货号:G1102)购自Servicebio公司; 812包埋剂(货号:90529-77-4)购自SPI公司;胎牛血清(货号:A3161002)、DMEM无糖培养基(货号:C1995500BT)、DMEM含糖培养基(货号:C11995500BT)购自Gibco公司;PET膜 Transwell 透明嵌套(0.4 μm,货号:3450)购自Corning公司;100~1 000 μL枪头(货号:CS015)购自Excell Bio公司;大鼠皮质神经元细胞完全培养(货号: CM-R105)、大鼠神经星形胶质细胞完全培养基(货号: CM-R137)、大鼠脑微血管内皮细胞完全培养基(货号: CM-R108)购自Procell公司;浓缩型正常山羊血清(货号: AR1009)、荧光(Cy3)标记羊抗兔 IgG(货号: BA1032)购自BOSTER公司;TritonX-100(货号: ST795)、DAPI(货号: C1002)购自碧云天公司;β-tubulin(种属:兔,货号:10094-1-AP)、GFAP(种属:兔,货号: 16825-1-AP)购自Proteintech公司;CD31(种属:兔,货号: ab222783)购自Abcam公司;BD凋亡试剂盒(货号: 556547)购自BD Pharmingen公司。
1.4 主要仪器Leica UC7型超薄切片机购自Leica公司;Ultra 45°型钻石切片刀购自Daitome公司;HT7700型透射电子显微镜购自HITACHI公司;MDF-U72V(-80 ℃)超低温冰箱购自日本三洋公司;Eppendorf research plus 移液枪购自德国eppendorf 公司;BS/BT223S电子天平购自北京赛多利斯科学仪器有限公司;DZG-303A纯水机购自上海爱莫电气科技有限公司;MIC101厌氧箱(含双流量计、氧电极)购自北京久易科仪科技有限公司;CO2培养箱购自SANYO公司;倒置相差显微镜购自OLYMPUS公司;流式细胞仪购自Becton Dickinson公司;台式离心机购自湘仪离心机仪器有限公司;荧光显微镜购自奥林巴斯BX53公司。
1.5 在体实验
1.5.1大鼠CIRI模型的分组、制作 将符合实验条件的大鼠随机分为假手术组(Sham)、动物模型组(CIRI)和三七组(PN)。PN组又分为50、100、150 mg·kg-1三个剂量组。每组10个大鼠。CIRI组和PN组大鼠参照课题组前期实验造模方法制作大鼠局灶性大脑中动脉闭塞模型[6],即大鼠实验线栓进入右侧颈内动脉约18~19 mm。假手术组线栓插入颈内动脉深度为8~10 mm,未造成脑缺血。缺血2 h后缓慢拔出栓线约1 cm,使Willis环血流通畅、右侧大脑中动脉恢复血供,完成脑缺血/再灌注损伤,剪掉暴露在术口外的线栓。
1.5.2选取造模成功的大鼠 CIRI后2 h分别根据Longa 5级神经功能评分标准对各组大鼠进行神经功能行为学评分。评分1~3分的大鼠继续下一步实验。
1.5.3动物模型的给药 PN组内每个剂量组大鼠在CIRI 1~2 h后分别根据大鼠体重取适当的三七粉,分别给予已配好的三七溶液灌胃。从低到高剂量组分别对应的三七溶液浓度是5、10、15 g·L-1。首日1次,之后每天2次。Sham、CIRI组大鼠在相同的时间点给予等量生理盐水灌胃。术后干预7 d。其余组术后不予处理。
1.5.4大鼠用药后神经功能学再评分 CIRI后7 d再采用Longa 5级评分法进行各只大鼠的行为学评分。
1.5.5大鼠脑梗死体积比的测定 7 d后,每组取3只大鼠腹腔注射麻醉取脑,切成2 mm厚片。适当的2% TTC染液、37 ℃恒温水浴箱对脑切片进行避光染色,每10 min翻动1次。染色时长30 min。脑片经终止染色、固定24 h后拍照。Image-Pro Plus 6.0软件分析。
1.5.6CIRI后大鼠NVU超微结构的观察 干预7 d后的相应时间点对3组大鼠神经功能缺损评分后腹腔麻醉、心脏放血、断头取材,取缺血灶周边脑组织、剪成小于1 mm3,漂洗(生理盐水)、室温固定(3%戊二醛,2 h)、4 ℃固定(3%戊二醛,2 h以上)、漂洗(0.1 mol PBS,3次,45 min)、固定(1%锷酸,2 h)、酒精脱水(50%、70%、80%、90%、95%各15 min)、包埋(Epon812)、超薄切片(片厚60 nm)、染色(2%醋酸双氧铀和柠檬酸铅),在透射电镜下采集图像分析。
1.6 离体实验
1.6.1三种原代细胞的培养 参照文献报道所述方法[7-8],仔细分离大脑皮层组织,经过清洗、消化、吹打、过滤、离心、重悬等步骤后接种于培养瓶中(除神经元外,其他无需多聚赖氨酸提前包被),于CO2孵箱中正常培养。皮层神经元培养24 h后向培养液内加入阿糖胞苷(5 μmol·L-1)抑制非神经细胞生长。48 h后均更换培养基,以后每3 d换液1次,直至细胞长满。
1.6.2细胞形态观察及免疫荧光鉴定 倒置显微镜下对各组细胞进行形态观察后,采用免疫荧光技术分别对神经元β-Tubulin、星形胶质细胞GFAP和微血管内皮细胞CD31进行检测,经爬片、固定、室温通透、浸洗、封闭、双抗体孵育、复染、封片等操作后置于荧光显微镜下观察并采集图像。
1.6.3NVU体外模型构建 根据实验要求将纯化培养的单细胞一起培养于Transwell内。首先将Transwell插入池翻转至无菌饭盒中,将传代至第3代的星形胶质细胞种植到插入池的外侧面(1.5×105cells·cm-2),等待4 h至星形胶质细胞贴壁后,将Transwell插入池转入六孔板中;2 d后将成熟的脑微血管内皮细胞种植到Transwell插入池内池(1.0×105cells·cm-2),与星形胶质细胞共培养2 d;将共培养的Transwell 插入池放置于已生长2-3 d左右的神经元培养孔中(0.5×105cells·cm-2),共培养3-4 d;即建成体外NVU共培养模型。
1.6.44 h渗漏实验[9]细胞共培养3~4 d后,在Transwell池内加满培养液,使六孔板内的培养液液面加至低于Transwell池液面0.5 cm处,培养箱中正常培养4 h后观察液面变化。若液面无明显降低,则造模成功。
1.6.5含药血清制作 大鼠脑缺血/再灌注7 d,末次给药1 h后取CIRI组、PN不同剂量组各6只大鼠,分别收集相应组别的血液。参照文献所述方法进行处理血制品[9],最终得到空白血清和PN不同剂量组含药血清。
1.6.6OGD/R模型制作、分组及给药 将成功造模的NVU模型随机分为对照组(Control)、细胞模型组(OGD/R)以及对应在体实验不同剂量的三七含药血清组(PN drug serum,PNDS)。OGD/R组、PNDS组制作OGD/R模型,即缺血缺糖培养基置换含糖含血清培养基,然后放入37 ℃、95% N2和5% CO2混合气缺氧装置中进行OGD 2 h;2 h后,OGD/R组予更换DMEM含糖培养基时,加入10%的空白血清;PNDS组分别于更换DMEM含糖培养基时加入10%对应浓度的含药血清;Control组不作OGD/R处理,但同样更换含10%空白血清的DMEM含糖培养基;37 ℃的CO2培养箱内复氧24 h,最终完成OGD/R模型制作。
1.6.74 h渗漏实验 复氧20 h时进行,方法同“1.6.4”。
1.6.8细胞凋亡率检测 各组细胞于OGD/R 24 h后经消化、冲洗,并按照试剂盒步骤操作,流式细胞仪上机。单染组校正电压。
2 结果
2.1 三七对CIRI大鼠神经功能缺损评分的影响Sham组大鼠无神经缺损症状,评分为0;CIRI 2 h评分显示,PN组、CIRI组大鼠评分无明显差异。CIRI 7 d评分显示,与Sham组相比,CIRI组出现不同程度的神经功能缺损症状,评分有明显升高(P<0.01);与CIRI组相比,PN组大鼠神经功能缺损评分明显改善(P<0.01)。见Tab 1。
2.2 TTC染色对各组大鼠脑梗死体积的影响如Fig 1所示,Sham组未见梗死灶,脑梗死体积为0;与Sham组相比,CIRI组出现明显脑梗死灶,差异显著(P<0.01);与CIRI组相比,PN各剂量组脑梗死体积明显缩小(P<0.01)。见Fig 2。
2.3 各组大鼠脑细胞透射电镜下的超微结构变化
2.3.1各组大鼠神经元电镜下形态学变化 Sham组(N1)细胞结构较清晰,部分细胞器稍扩张,但细胞整体状态良好。CIRI组(N2)细胞膜破裂,核周片状溶解、水肿,细胞器流失;核皱缩;现存线粒体结构模糊伴肿胀扩张。PN组(N3、N4、N5)细胞周围无明显水肿;细胞核无明显皱缩,染色质分布较均匀;细胞器结构尚清晰可见,但仍有部分细胞器肿胀明显。PN减轻了脑缺血引起的细胞超微结构损伤,同时间点观察细胞器结构状态发现相对于CIRI组较好, 如Fig 3。
2.3.27组大鼠星形胶质细胞电镜下形态学变化 Sham组(A1)细胞膜结构完整;出现染色质碎裂现象;部分细胞器轻度微扩张;但整体无明显异常改变。CIRI组(A2)细胞明显呈空洞样改变;细胞核异型改变,核内可出现空洞;细胞器明显扩张,高尔基体板层结构消失,细胞器内大量空泡形成;细胞整体状态不佳。50 mg·kg-1PN组(A3)仍可见肿胀空泡样细胞器改变,但较CIRI组相比异常改变略微减轻。100 mg·kg-1PN组(A4)细胞外形较不规则,周围轻度水肿;细胞核皱缩,染色质边集;大部分细胞器中度肿胀呈空泡样。150 mg·kg-1PN组(A5)细胞水肿、核皱缩、染色质改变及细胞器结构方面评价细胞状态,发现PN组减轻了脑缺血引起的细胞超微结构损伤,同时间点观察细胞结构状态相对于CIRI组较好,见Fig 3。
Tab 1 Effect of Panax Notoginseng on neurological function and behavior scores in each group of
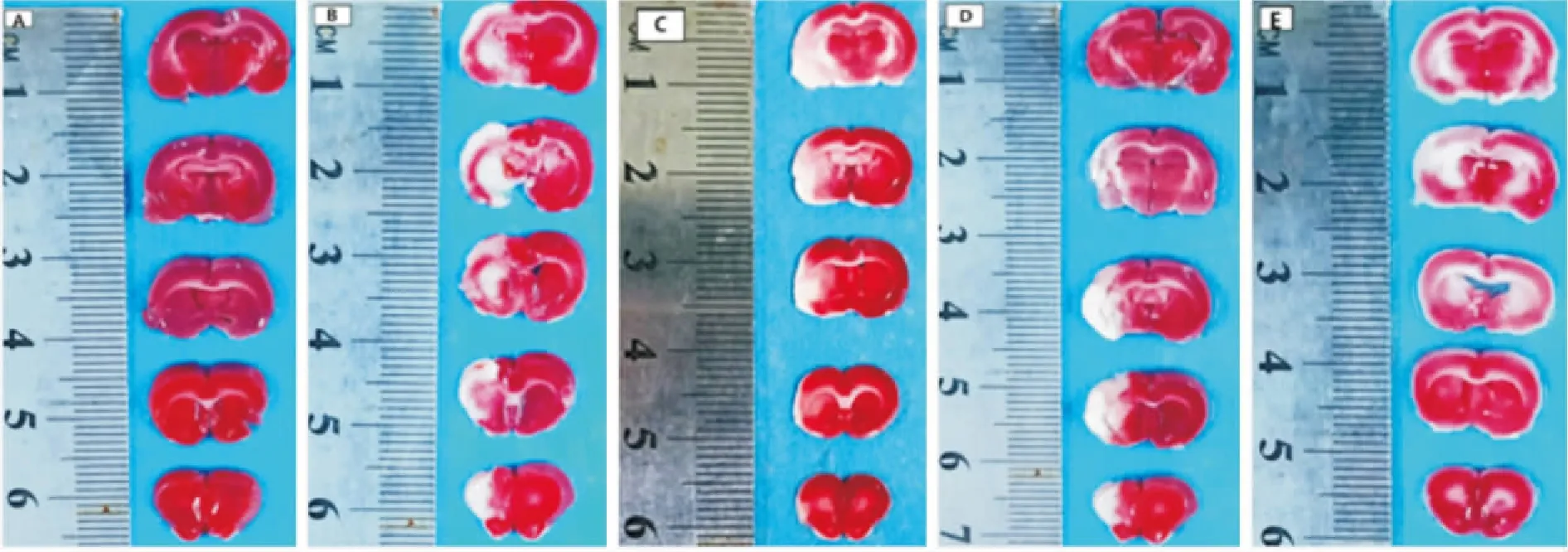
Fig 1 Photographs of brain sections with TTC staining
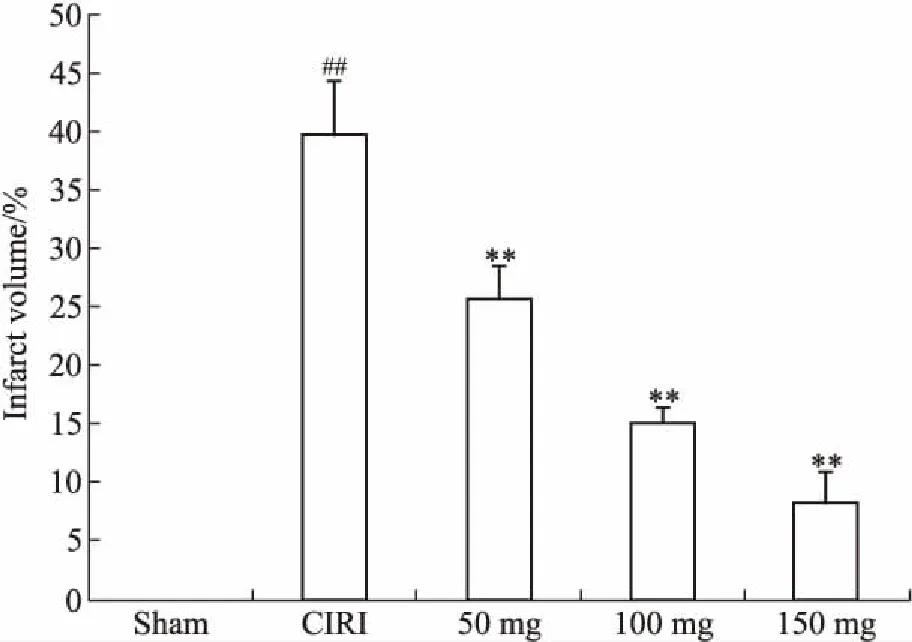
Fig 2 Effects of Panax Notoginseng on cerebral infarction volume in different groups of
2.3.3各组大鼠微血管电镜下形态学变化 Sham组(B1)内皮细胞周围连接紧密;微血管管腔通畅;细胞器结构模糊;CIRI组(B2)内皮细胞周围出现严重的水肿;微血管管腔狭窄严重;细胞核异型改变,细胞器结构模糊;PN组仍可观察到细胞核异型性改变,但总体而言,PN组在微血管管腔、细胞连接方面较CIRI组均有所减轻。见Fig 3。
2.4 细胞免疫学荧光鉴定① 神经元β-Tubulin:图中(Fig 4)红色荧光为β-Tubulin阳性,阳性率>90%,即:细胞纯度>90%。② 星形胶质细胞GFAP:图中(Fig 5)红色荧光为GFAP 阳性,阳性率>90%,即:细胞纯度>90%。③ 微血管内皮细胞CD31:图中(Fig 6)红色荧光为CD31阳性,阳性率>90%,即:细胞纯度>90%。
2.5 PN对NVU共培养模型屏障功能的影响如Tab 2所示,与Control组对比,OGD/R组transwell池内液面明显下降(P<0.01);经PN含药血清干预后的PNDS组液面无明显下降,与OGD/R组相比差异较明显(P<0.01)。
2.6 PN对NVU共培养模型细胞凋亡的影响Fig 7、Fig 8分别显示了各组共培养模型经OGD/R处理后的神经元及脑微血管内皮细胞凋亡情况。结果显示, OGD/R组神经元、脑微血管内皮细胞凋亡率较Control组明显增加(P<0.01),PN含药血清干预后的PNDS组神经元、脑微血管内皮细胞凋亡率有明显下降(P<0.01)。
3 讨论
CIRI是由NVU组分共同参与的级联反应过程。脑微血管内皮细胞在CIRI作用下受损,进一步导致的血管痉挛及继发的血管通透性增高加剧脑缺血所致的缺血缺氧损伤;脑缺血早期的逐层放大效应可逐渐累及血管周边的星形胶质细胞,当血脑屏障被破坏,外周有害代谢物质侵入并破坏大脑的微环境;继而凋亡的星形胶质细胞在CIRI早期分泌兴奋性神经递质和炎症因子破坏周围的神经元。这一系列复杂的细胞、分子和代谢事件,归咎于CIRI发生后的能量代谢障碍、钙超载、自由基连锁反应以及细胞凋亡等过程[9-10]。各个病理过程相互重叠、相互联系、相互加强,导致不可逆的脑损伤。随着IS病程的进展,神经血管病变加重,脑缺血灶增大。同时,缺血性脑损伤破坏血脑屏障,继而引发一系列事件,导致脑水肿形成、出血转化和继发性神经功能不良[11]。临床上,有超过1/3的脑卒中患者发生脑血脑屏障破坏,并且与IS后的不良预后和较低的生存率密切相关。神经元保护是目前临床上脑组织保护的主要手段,但是由于治疗靶点的单一性以及缺血损伤过程的不可逆性,其治疗作用甚微[12]。神经血管单元强调了NVU整体保护的重要性。为此有些研究者提出了CIRI的鸡尾酒疗法[13],如钙离子拮抗剂和自由基清除剂的联合用药,以针对CIRI不同的发病过程或不同的细胞靶点;多种药物合用,一方面有助于IS患者神经功能的恢复,缩短住院时间,但是另一方面可能增加了临床药物使用的毒副作用,并且极大地增加了人们的负担。
Tab 2 Effects of diverse drug serum on 4 h leakage level difference in NVU co-culture
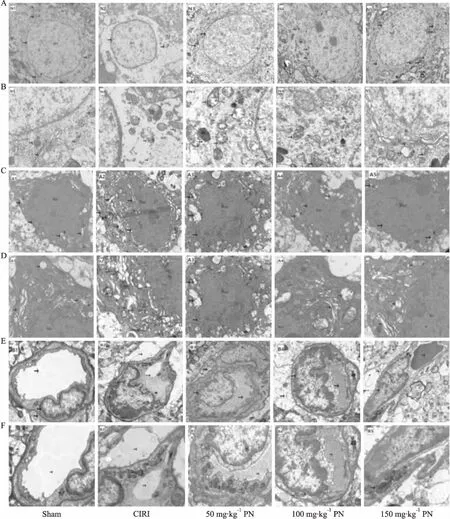
Fig 3 Ultrastructure of NVU in each group of rats
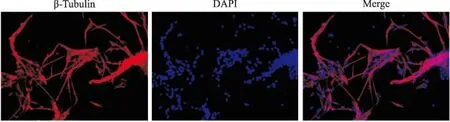
Fig 4 β-Tubulin of immunofluorescence in neurons(×200)
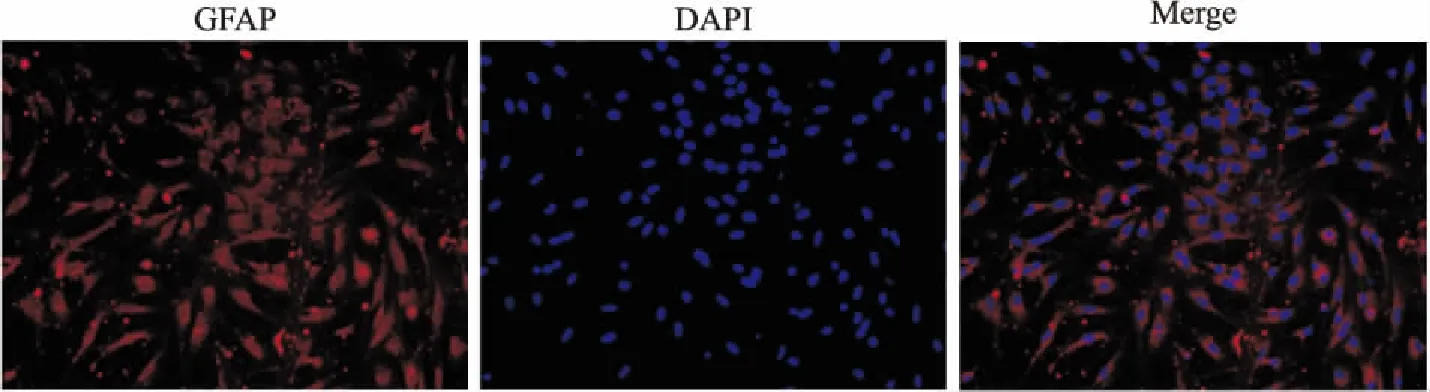
Fig 5 GFAP of immunofluorescence in astrocytes(×200)
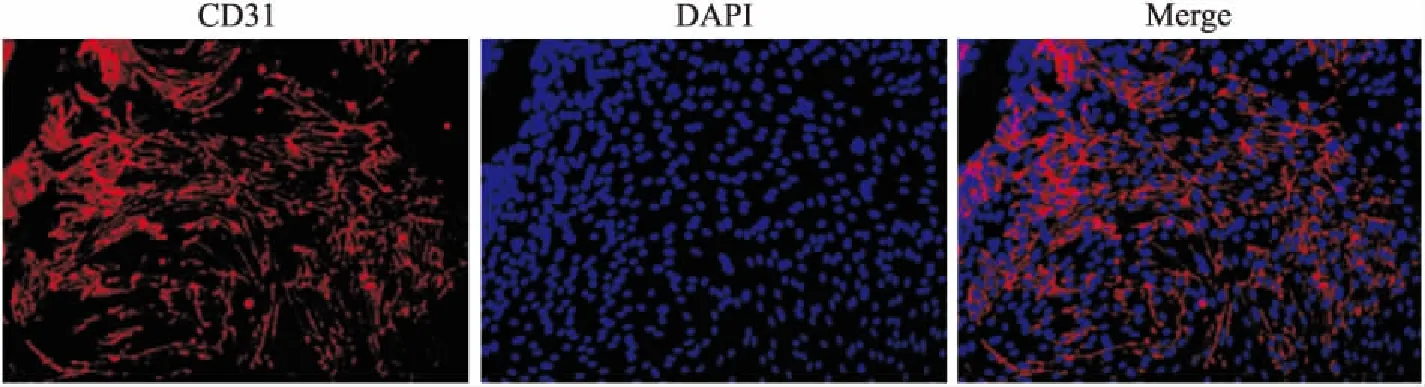
Fig 6 CD31 of immunofluorescence in cerebral microvascular endothelial cells(×200)
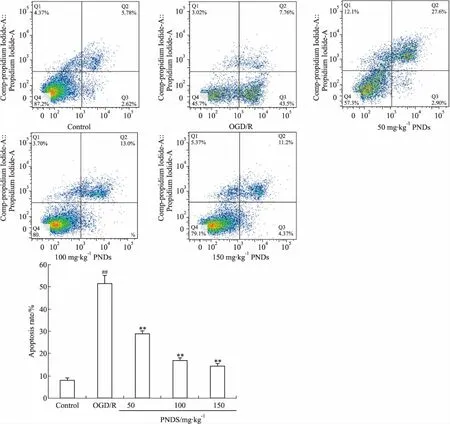
Fig 7 Effects of Panax Notoginseng drug serum on neuronal
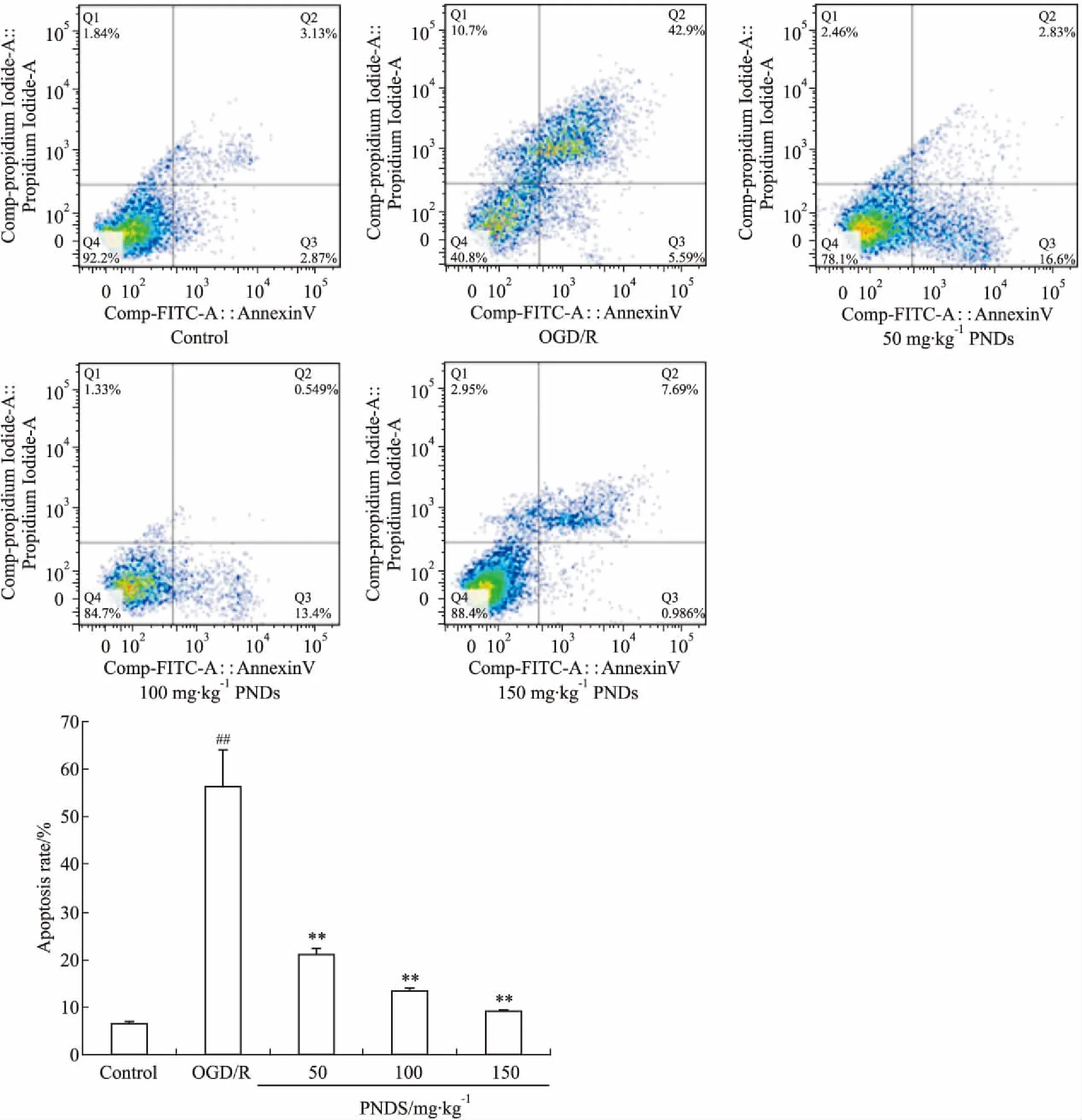
Fig 8 Effects of Panax Notoginseng drug serum on apoptosis of cerebral microvascular endothelial cells after vs control;**P<0.01 vs OGD/R.
PN治疗靶点多且不良反应少,具有传统中医药的优势,与CIRI的后的NVU整体治疗靶点相契合。研究证实,PN可通过抑制细胞内钙超载[14]、抗炎[15]、抑制细胞凋亡[16]及降低血脑屏障通透性[17]等方面作用于CIRI中多个病理过程,促进神经系统功能恢复,对脑缺血损伤有确切疗效。我们的研究表明,在大鼠CIRI后1~2 h开始给予PN溶液灌胃,可以显著降低大鼠神经功能评分,减少皮层和皮层下梗死体积,以及减轻NVU主要结构损害,从而促进大鼠的神经行为恢复。同样,OGD/R细胞模型进行氧糖剥夺2 h,经过PN含药血清24 h干预的细胞凋亡率明显降低,而且Transwell池内渗漏液面无明显下降,提示PN在促进神经元、微血管内皮细胞的存活,并降低屏障的通透性方面发挥了重要的作用。表明PN作用于CIRI的机制之一可能是同时抑制NVU多种细胞凋亡,对NVU具有整体保护作用。本课题组将继续深入研究PN如何多途径作用于脑缺血/再灌注损伤。
