槲皮素对大鼠皮层神经元的雌激素样作用研究
2020-12-17甄艳杰刘靓靓赵雨薇沈丽霞
甄艳杰,刘靓靓,赵雨薇,钟 明,沈丽霞
(河北北方学院药学系,河北省神经药理学重点实验室,河北 张家口 075000)
阿尔茨海默病(Alzheimer’s disease,AD)属于一种典型的中枢神经系统退行性疾病,临床表现为进行性的记忆的减退以及认知功能的损害[1]。目前认为AD有两个比较明显的病理学特征:由β-淀粉样蛋白(amyloid-β protein,Aβ)沉积形成的老年斑(senile plaques)在大脑皮层和海马神经元细胞外大量出现;由神经元细胞内高度磷酸化的tau蛋白所导致的神经纤维缠结(neurofibrillary tangles)。而研究发现AD最终都表现着相同的病理改变,即大脑皮层、海马、额颞叶中的神经元突触大量缺失和神经元的细胞凋亡,这些神经元突触和神经细胞与认知功能密切相关[1]。由于其发病机制尚不清楚,目前临床治疗药物只能短期改善症状,而不能阻止或延缓疾病的进展,因此寻找能够治疗AD的有效药物是当前亟待解决的难点。
雌激素对大脑中神经元有明确的保护作用,可对抗Aβ诱导的神经退行性病变[2-4],雌二醇可通过上调Bcl-2 mRNA的表达以及下调Bax mRNA的表达从而减少Aβ25-35对PC12细胞的神经毒性[5]。女性进入绝经期后,体内雌激素水平明显下降,长期以来临床采用人工合成的雌激素替代治疗(estrogen replacement treatment,ERT),使患阿尔茨海默病危险下降50%。然而ERT所带来的如生殖系统肿瘤及乳腺癌的发生等不良反应影响其推广应用。人们致力于寻求雌激素的替代物,期望这种替代物能保留雌激素的保护作用,同时避免上述的不良影响,来源于植物而且结构类似雌激素的植物雌激素(phytoestrogen)正是其中的重要一类,有望成为预防和治疗AD的雌激素替代物。如金雀异黄素(genistein,Gen)可通过与胞膜胞内的雌激素受体(estrogen receptor,ER)结合从而发挥神经保护作用,可以明显提高Aβ31-35损伤后的皮层神经元活性,并减少彗星细胞的数量及其拖尾长度[6]。
槲皮素(quercetin,Que)属天然黄酮类物质,与雌激素有着相似的化学结构,具有雌激素样作用。目前已有研究发现,槲皮素可以减少SH-SY5Y细胞中淀粉样前体蛋白(amyloid precursor protein)的成熟,可以减少AD模型大鼠中Aβ所占的比例。课题组前期研究表明,槲皮素可通过经典的ER途径,影响PI3K/Akt/GSK-3β 信号通路的激活,并且对Aβ25-35诱导的PC12细胞的损伤具有类雌激素样神经保护作用[7]。本研究将从槲皮素对大鼠皮层神经元细胞的保护作用入手,对槲皮素介导雌激素受体途径影响大皮层神经元进行研究。同时利用ER完全拮抗剂,进一步探索槲皮素发挥神经保护作用的相关途径,并为神经系统疾病药物的开发提供新的思路和策略,从而探索植物雌激素能够替代雌激素作为未来参与治疗AD药物的可行性。
1 材料与方法
1.1 材料
1.1.1动物 Sprague Dawley(SD)大鼠,许可证号:SYXK(京)2014-0037,新生24 h内的SD大鼠(乳鼠)
1.1.2药物与试剂 槲皮素(中国药品生物制品检定研究所,批号:100081-200907)、金雀异黄素(中国药品生物制品检定研究所,批号:111704-201302)、17β-雌二醇(abcam 公司,批号:APN11282-1-1)、ER完全拮抗剂(ICI182,780,abcam 公司,批号:APN07104-1-1)、Neurobasal-A Medium培养基(Gibco 公司,批号:1645623)、B-27 Supplement(50×)(Gibco 公司,批号:1674937)、DMEM/高糖培养基(HyClone 公司,批号:SH30284.01)、胎牛血清(杭州四季青生物工程材料有限公司,批号:20150715)、MTT(Sigma 公司,批号:MKBS4732V)、Neuronal ClassⅢ β-Tubulin (Tuj1)抗体(碧云天生物技术公司)、CyTM3-conjugated Affinipure Goat Anti-Mouse IgG(Jackson Immuno Research 公司,批号:101887)、辣根过氧化物酶标记羊抗鼠二抗IGG(H+L)(Novus Biologicals 公司,批号:4103945)、β-actin(Santa Cruz 公司,批号:C2014)、ERβ抗体(Novus Biologicals 公司,批号:2100-1P140905)、ERα抗体(Novus Biologicals 公司,批号:2100-1P140905)
1.1.3仪器 CO2培养箱(Thermo 公司),超速冷冻离心机(Sigma公司),荧光倒置显微镜(Nikon公司),体视学显微镜(Leica公司),多功能酶标仪(Tecan公司),化学发光凝胶成像系统(ProteinSimple公司)。
1.2 方法
1.2.1大鼠皮层神经元的原代培养 在低温条件下取乳鼠的大脑皮层组织,小心剥去脑膜及血管,剪碎成小块,大小为1 mm3左右,加入0.125%的胰蛋白酶,加入离心管中,在37 ℃水浴10 min。用含10%胎牛血清的高糖培养基终止消化,离心除去上清,重复上述操作两次。加入培养基吹散,通过200目筛,预先用多聚赖氨酸包被培养板,而后将细胞悬液移入包被完成的培养板中,并在37 ℃,5% CO2培养箱中孵育培养,6 h后,将培养基改为Neuronbasal +B27的神经元专用无血清无酚红培养基,继续在此培养基中培养。培养6 d后,通过免疫荧光染色法鉴定神经元纯度。将培养至6 d的细胞用Tuj1抗体和DAPI进行标记,倒置显微镜下观察,镜下可见所有细胞核均发出蓝色荧光,而Tuj1阳性细胞则显示红色荧光,将两图进行重叠可计算出神经元细胞所占的比例,将计算出的比例用作神经元细胞的纯度。
1.2.2MTT检测槲皮素对神经元细胞活性的影响 以合适的细胞密度在包被后的96孔板中接种皮层神经元细胞,培养6 d后,按如下分组加入不同的含药培养基继续培养24 h,DMSO空白对照组(体积含量比不超过0.1%)、17β-E2阳性药对照组(0.02 μmol·L-1)、Gen阳性药对照组(25 μmol·L-1)、Que低剂量组(50 μmol·L-1)、Que中剂量组(100 μmol·L-1)、Que高剂量组(200 μmol·L-1),每组设置6个复孔。同时完全拮抗ER的皮层神经元细胞模型,以检测槲皮素对完全拮抗ER的皮层神经元细胞活性的影响,在药物干预前每孔加入ER完全拮抗剂ICI182,780(每孔中的ICI182,780终浓度为1 μmol·L-1),置于37 ℃,5% CO2培养箱中孵育2 h。孵育完成后弃去板中含拮抗剂的培养基,并按依次加入上述含药培养基,每组设置6个复孔,每孔加入100 μL含药培养基,继续培养24 h和48 h。采用MTT法测定OD值并计算细胞存活率(实验组OD值/DMSO空白对照组OD值×100%,survival rate,SR)。
1.2.3免疫荧光检测槲皮素对神经元细胞形态的影响 在包被后的24孔板将皮层神经元接种后培养6 d,按照以下不同的分组添加不同的含药培养基继续培养24 h,DMSO空白对照组(体积含量比不超过0.1%)、17β-E2阳性药对照组(0.02 μmol·L-1)、Gen阳性药对照组(25 μmol·L-1)、Que低剂量组(50 μmol·L-1)、Que中剂量组(100 μmol·L-1)、Que高剂量组(200 μmol·L-1)。培养24h后弃去培养基,加入新鲜配制的4% 多聚甲醛在室温下固定30 min,用体积分数为0.2%的TritonX-100在室温下进行透化处理20 min,使用5%的牛血清白蛋白封闭30 min,将稀释后的Tuj1抗体加入孔板中,并在4 ℃下孵育过夜,再加入荧光二抗(CyTM3-conjugated affinipure goat anti-mouse IgG,1 ∶800 PBS稀释),于暗盒中在室温条件下孵育1 h。去除移去荧光二抗,滴加完成稀释的DAPI染色工作液(1 ∶80 PBS稀释),于暗盒避光对细胞核进行复染15 min。在荧光倒置显微镜下观察细胞形态,并拍照采集图像,采集的图像使用Image-Pro Plus软件进行分析处理。
1.2.4Western blot检测槲皮素对神经元细胞ER蛋白表达的影响 将皮层神经元细胞接种在包被后的6孔板中培养6 d。根据“1.2.2”中的实验组,添加不同含药培养基,培养24 h。收集培养后的细胞,添加细胞裂解液,置于冰上,裂解30 min,用移液枪不断吹打以确保细胞充分裂解,4 ℃,12 000 r·min-1离心5 min。用BCA法测定蛋白含量,裂解液调整蛋白浓度,使各不同分组的蛋白浓度一致,按4 ∶1的比例混合蛋白样品和蛋白上样缓冲液,在95 ℃金属浴中10 min,以确保蛋白充分变性。确保每孔蛋白上样量20-25 μg,使用10% SDS-PAGE凝胶进行蛋白分离,转膜,5 %脱脂牛奶封闭2 h后,加入一抗β-action(1 ∶500)、雌激素受体α/β一抗(1 ∶300),4℃孵育过夜。第二天将膜用TBST洗3次,每次洗10 min。室温孵育二抗(Goat anti-mouse IgG/HRP,1 ∶4 000)2 h。用TBST将膜清洗3次,每次清洗10 min,发光,拍照,成像,分析条带灰度。
2 结果
2.1 原代培养皮层神经元细胞纯度神经元培养5 d后,神经细胞生长较好,细胞突触进一步伸长和增粗,具有双极、多极突起,并交织成网络;在培养7 d后,细胞体较大,周围可见明显光晕,细胞突触延长、增粗且分支较多,突触间、突触与胞体之间联系增多,形成密集的神经网络;培养9 d后,神经元细胞开始退化,大量细胞体团聚成簇,且折光性降低,突触减少、缩短,以及胞质内空泡或颗粒增多;结果显示培养5-8 d的细胞处于最佳状态,可将其用于后续试验。用Tuj1抗体和DAPI进行标记后,随机选取6个视野中Tuj1阳性神经元细胞的数目占总细胞的比例,显示培养的细胞中神经元纯度在95%左右。
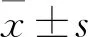
2.2 槲皮素对大鼠皮层神经元细胞活性的影响与溶剂对照组相比,17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)处理细胞24 h、48 h时可以提高大鼠皮层神经元细胞的活性,且差异有统计学意义(P<0.05);而与17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)相似,Que浓度为50 μmol·L-1、100 μmol·L-1时,在处理24 h、48 h后也可以明显提高皮层神经元的活性,差异有显著性(P<0.01),而Que(200 μmol·L-1)组仅在药物干预24 h时才可提高皮层神经元的细胞活性,并且差异有统计学意义(P<0.05)(Tab 1)。不同浓度的Que对大鼠皮层神经元的活性有不同的影响,通过组间两两比较发现Que(50、100 μmol·L-1)处理组的大鼠皮层神经元的细胞活性均高于Que(200 μmol·L-1)处理组(P<0.05),而Que(50 μmol·L-1)和Que(100 μmol·L-1)两组之间仅在药物进行干预48 h时才会显示出差异具有统计学意义(P<0.05)(Tab 1)。使用ICI182,780拮抗剂孵育后,再使用药物干预,发现孵育组与未孵育组比较,17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)、Que(50、100 μmol·L-1、200 μmol·L-1),神经元活性存在明显差异(P<0.05)(Tab 2、3),皮层神经元细胞活性的影响均可被ICI182,780完全拮抗。但是溶剂对照组与使用拮抗剂的对照组相比差异无显著性(Tab 2、3)。
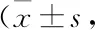
Tab 1 Effect of Que on activity of cortical neurons n=6 )
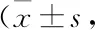
Tab 2 Effect of Que treatment for 24 h on activity of antagonist estrogen receptor in cortical neurons (positive control group: 17β-estradiol) n=6)
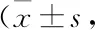
Tab 3 Effect of Que treatment for 24 h on activity of antagonist estrogen receptor in cortical neurons (positive control group: genistein) n=6)
2.3 槲皮素对大鼠皮层神经元细胞形态的影响与对照组相比,用17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)、Que(50、100 μmol·L-1)处理过的大鼠皮层神经元细胞的突触数目明显增多(P<0.05)(Fig 1),从图片上可看出,和对照组相比,17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)、Que(50、100 μmol·L-1)组中神经元细胞的生长状态较好,细胞突触明显增粗且分支较多,并且突触间、突触与胞体之间联系更加紧密;当分别与ICI182,780共同孵育时,17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)、Que(50、100 μmol·L-1)对皮层神经元突触的促生长作用减弱,突触数量明显减少(P<0.05)(Fig 2),突触明显变细,并且突触间的连接变少。
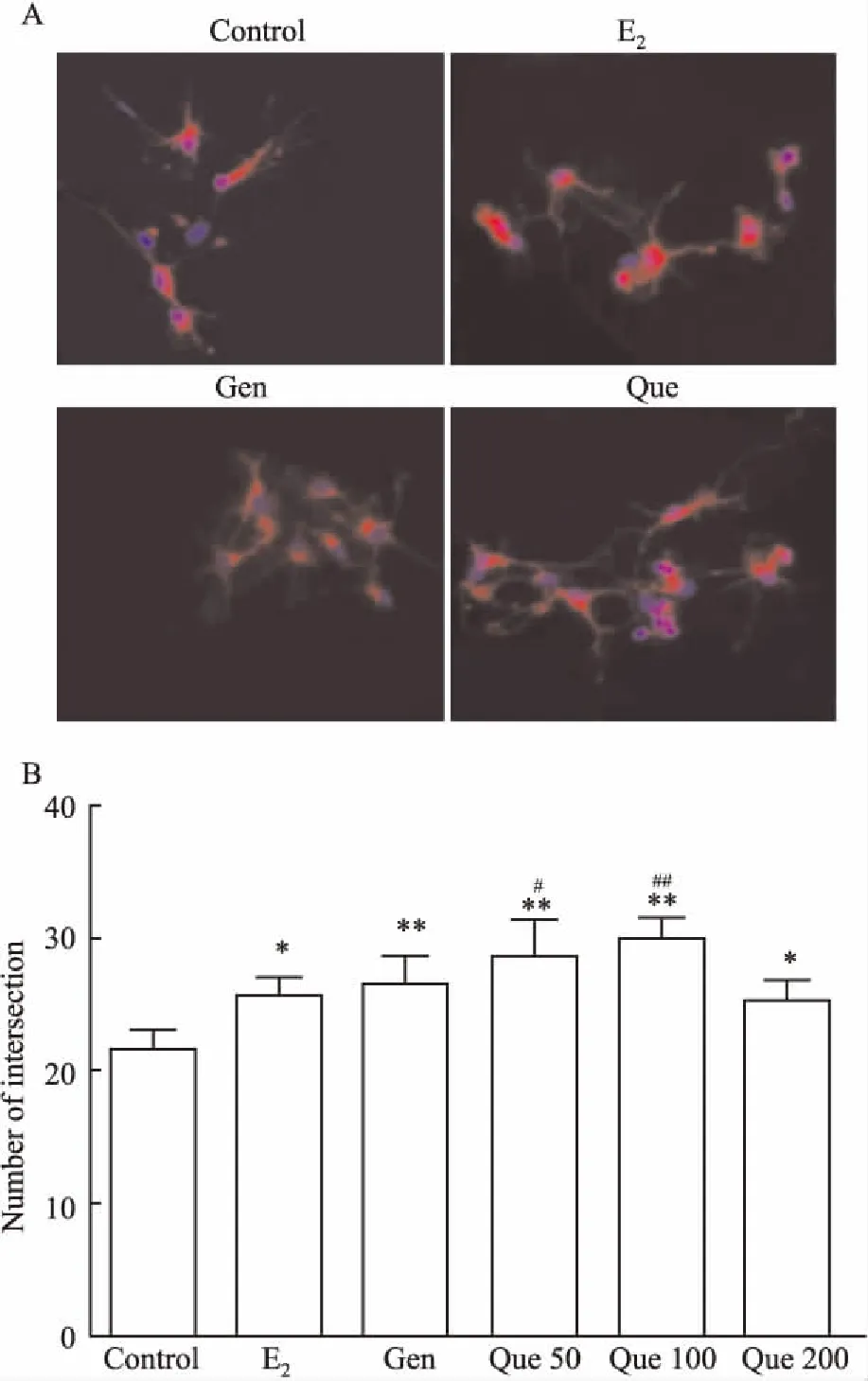
Fig 1 Neurite outgrowth of cortical neurons treated with E2 (0.02 μmol·L-1), Gen (25 μmol·L-1) and Que (50 μmol·L-1, 100 μmol·L-1 and 200 μmol·L-1) for 24 h
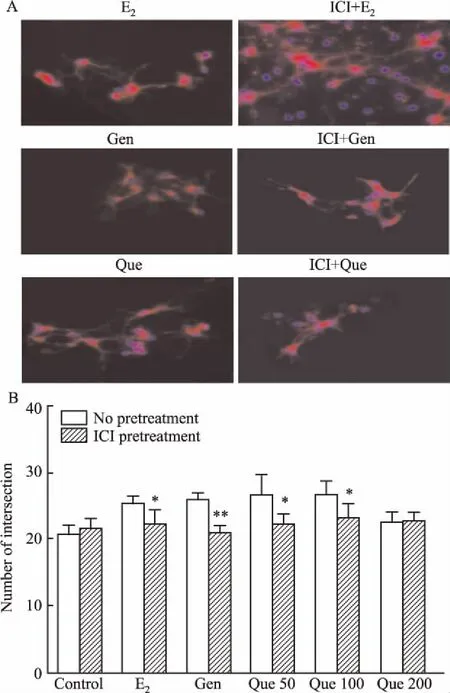
Fig 2 Neurite outgrowth of cortical neurons treated with E2 (0.02 μmol·L-1), Gen (25 μmol·L-1) and Que (50 μmol·L-1, 100 μmol·L-1 and 200 μmol·L-1) for 24 h with or without pre-incubated with ICI182,780 for 2 h
2.4 槲皮素对大鼠皮层神经元ER表达量的影响β-actin作为内参蛋白,与对照组相比,17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)、Que(50 μmol·L-1、100 μmol·L-1)处理组均能上调大鼠皮层神经元细胞ERα蛋白水平(P<0.05),而对ERβ蛋白表达的影响并不明显(Fig 3)。当用ICI182,780孵育后,与未孵育组比较,17β-E2(0.02 μmol·L-1)、Gen(25 μmol·L-1)、Que(50、100 μmol·L-1)ERα蛋白表达表达被拮抗,未见明显上调(Fig 4)。
3 讨论
随着我国人口老龄化,罹患AD的老年患者日渐增多,AD的主要病理症是多种原因导致的神经元的损伤,因此对于神经元细胞的保护就显得非常重要。新生SD大鼠皮层神经元细胞的原代培养已被作为神经系统疾病的细胞模型[8],为探索神经系统疾病的发病机理及药物筛选提供了良好的平台。大鼠皮层神经元细胞在培养至d5-8时生长状态最佳;培养皮层神经元细胞时使用不含酚红的培养基,即培养基中不存在酚红等具有雌激素样作用的物质,因此,可以确保培养5-8 d的皮质神经元细胞可以保存在雌激素耗竭状态;Tuj1是一种微管蛋白,广泛存在于细胞骨架中,其主要的功能是参与神经元细胞类型特异性的分化,Tuj1抗体广泛用于鉴定神经元细胞的标记物[9]。原代培养的皮层神经元的特异性及纯度通过免疫荧光实验进行检测,其纯度高达95%。
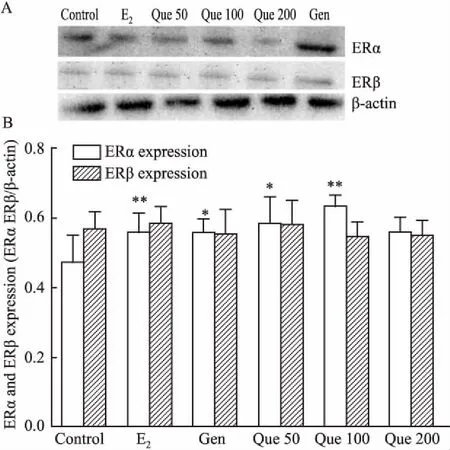
Fig 3 Protein abundances of ERα and ERβ in cortical neurons treated with E2(0.02 μmol·L-1), Gen(25 μmol·L-1) and Que (50 μmol·L-1, 100 μmol·L-1 and 200 μmol·L-1) for 24 h n=3)
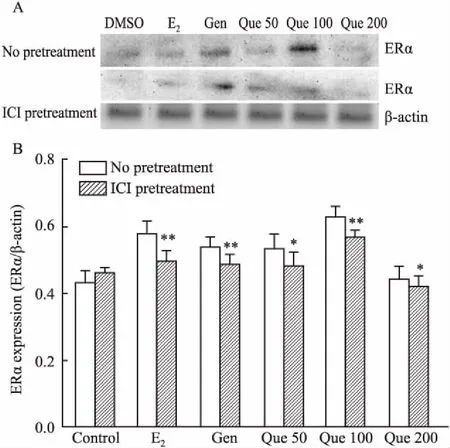
Fig 4 Protein abundances of ERα in cortical neurons treated with E2 (0.02 μmol·L-1), Gen (25 μmol·L-1) and Que (50 μmol·L-1, 100 μmol·L-1 and 200 μmol·L-1) for 24 h with or without pre-incubated with
槲皮素是一种天然的黄酮类化合物,其化学结构和雌激素极其相似,是植物雌激素的一种,可从多种食物和植物中提取,而无明显毒性和不良反应。近年来研究显示槲皮素作为一种植物雌激素同样具有神经元保护作用,可明显改善神经退行性病变动物的记忆和行为能力[10-11]。MTT实验结果显示槲皮素在一定的剂量范围内可以提高大鼠皮层神经元细胞的活性,初步验证了槲皮素的神经元保护作用。通过观察皮层神经元突触的数目,结果显示槲皮素可以明显促进皮层神经元生长,增加皮层神经元的突触密度,并可见不同形态的突触结构,这与17β-E2, Gen的神经元保护作用作用相类似。目前研究发现植物雌激素主要通过与ERs结合发挥雌激素样作用[12]。ICI182,780作为实验用ER完全拮抗剂,可以完全阻断雌激素等具有雌激素样作用的物质通过ER介导的生物学活性,在MTT实验中,当使用ICI182,780孵育后,槲皮素对大鼠皮层神经元的保护作用明显被抑制,同时也可抑制17β-E2,金雀异黄素的神经元保护作用。Western blot结果显示槲皮素可以明显提高ERα的蛋白表达,而对于ERβ,槲皮素和对照组的蛋白表达量之间差异无显著性;而在使用ICI182,780孵育后ERα蛋白的表达量明显少于未孵育组。表明槲皮素具有一定的雌激素样作用,且对皮层神经元的保护作用可能主要是由ERα介导的。
