卵巢早衰动物模型的建立
2020-12-17李慧王双杰叶雪程洪艳马瑞琼张孟蕾昌晓红
李慧,王双杰,叶雪,程洪艳,马瑞琼,张孟蕾,昌晓红
·论著·
卵巢早衰动物模型的建立
李慧,王双杰,叶雪,程洪艳,马瑞琼,张孟蕾,昌晓红
100044 北京,北京大学人民医院妇产科(李慧、王双杰、叶雪、程洪艳、马瑞琼、昌晓红),妇科肿瘤中心(李慧、叶雪、程洪艳、马瑞琼、昌晓红),动物实验室(张孟蕾)
应用不同化疗药物建立卵巢早衰动物模型,探索有效的卵巢早衰动物模型建立方法。
采用两种临床常用化疗药物紫杉醇、环磷酰胺诱导处理动情周期正常的雌性 Wister 大鼠,分为紫杉醇组与紫杉醇对照组、环磷酰胺组与环磷酰胺对照组。一段时间后观察大鼠一般生理情况,检测各组大鼠体重的变化,应用 ELISA 技术检测各组血清中 E2、FSH 的表达情况,同时比较各组卵巢组织形态、卵泡数的变化。
环磷酰胺组较对照组,大鼠活动减少,体重下降,E2 水平明显下降(< 0.05),FSH 水平明显升高(< 0.05),卵巢结构萎缩,卵泡数明显减少。紫杉醇组与对照组大鼠相比,雌激素含量明显降低,活动量未见明显减少,体重均呈增加趋势,卵巢结构、卵巢长径、卵泡数以及促卵泡素均未见明显差别。
环磷酰胺在建立卵巢早衰的动物模型中比紫杉醇具有优势,更适用于卵巢早衰相关研究。
环磷酰胺; 紫杉醇; 卵巢早衰; 动物模型
目前,卵巢早衰(premature ovarian failure,POF)通常采用激素替代疗法(HRT)进行治疗[1-2]。然而,HRT 仅能缓解症状,不能改善患者生育能力。因此,迫切需要一种治疗的新策略。干细胞具有自我更新和多向分化潜能,在多种疾病的研究中取得丰硕的成果,也为 POF 的治疗带来了希望[3]。目前,在干细胞进行 POF 治疗临床研究时,通常先采用化疗药物建立动物模型进行临床前研究[4-5]。然而,不同化疗药物卵巢毒性和作用时间不同,可能导致部分模型功能自行恢复,不利于后续研究。本研究采用不同化疗药物环磷酰胺(cyclophosphamide,CTX)和紫杉醇(paclitaxel,P)建立 POF 模型,探索模型制备方法,为后续干细胞研究 POF 提供有效的动物模型。
1 材料与方法
1.1 材料
1.1.1 实验试剂 注射用环磷酰胺(C3250000)购自美国 Sigma 公司;紫杉醇(MB1178)购自大连美伦生物技术有限公司;大鼠雌二醇酶联免疫检测试剂盒(CSB-E05110r)、大鼠促卵泡素酶联免疫检测试剂盒(CSB-E06869r)购自武汉华美生物工程有限公司;多聚甲醛、生理盐水购自上海优宁维生物科技股份有限公司;采血管、采血针、离心管等购自北京索莱宝科技有限公司。
1.1.2 实验仪器 电子天平(P6107-A600g-1EA)购自北京飞默生物科技有限公司;低速自动平衡离心机购自白洋离心机厂;倒置荧光相差显微镜、RM2016 型轮转式切片机购自德国徕卡仪器有限公司;–80 ℃冰箱购自海尔公司;YD-6L 生物组织包埋机购自金华市益迪医疗设备有限公司。
1.2 方法
1.2.1 实验动物 选取雌性、6 ~ 8 周龄、体重 180 ~ 220 g、健康 Wister 大鼠 16 只,北京维通利华公司提供。饲养于北京大学人民医院实验动物中心,室温控制在(23 ± 2)℃,相对湿度 45% ~ 55%,光照时间 12 h,自由饮食,适应性饲养 1 周。动物实验经北京大学人民医院福利伦理委员会批准。
1.2.2 实验分组与模型建立 本研究选择目前文献报道较多的化疗药物紫杉醇和环磷酰胺,并采用其常用剂量及周期来诱导卵巢早衰动物模型[5-6]。将大鼠随机分为四组,紫杉醇组和紫杉醇对照组,环磷酰胺组和环磷酰胺对照组。紫杉醇组给予单剂量 7.5 mg/kg 的紫杉醇腹腔注射,紫杉醇对照组给予单剂量 7.5 mg/kg 的生理盐水腹腔注射;环磷酰胺组给予单剂量 120 mg/kg 的环磷酰胺腹腔内注射;环磷酰胺对照组给予单剂量 120 mg/kg 溶解环磷酰胺的溶剂二甲基亚砜(DMSO)腹腔内注射。2 周后处死动物。
1.2.3 一般情况观察及大鼠体重变化 观察大鼠的活动情况、饮食情况、二便及鼠毛脱落情况。自药物注射开始,连续称重 14 d 并记录分析体重的变化。
1.2.4 血清性激素 从注射开始前一天标记为第 0 天,注射当天记为第 1 天,以此类推。分别于第 0、14 天在大鼠的内眦处采血 2 ml,静置 2 h。待血完全凝固,用离心机 3000 r/min 离心 15 min,然后取上清,置于–80 ℃冰箱内。血清收集完成后,酶联免疫吸附法(ELISA)检测大鼠血清雌二醇(E2)和促卵泡素(FSH)的含量。
1.2.5 卵巢形态学观察 观察周期结束后,处死大鼠,取大鼠双侧卵巢。生理盐水清洗去除血迹,剥离掉多余的脂肪组织后,观察卵巢结构,用标尺测量卵巢长径的大小。
1.2.6 卵泡计数 用 4% 多聚甲醛溶液固定卵巢组织 24 h,经脱水、透明后石蜡包埋,5 μm 切片,每隔 20 μm 取一张,每个组织取 3 张切片,常规 HE 染色后,每张切片随机取 5 个视野,观察卵巢的组织学变化及总卵泡数。
1.3 统计学处理

2 结果
2.1 用药后大鼠生理表现
紫杉醇组、紫杉醇对照组及环磷酰胺对照组的大鼠毛色亮、无明显掉毛现象、精神佳、活动可、饮水饮食正常,体重呈逐渐增长趋势;环磷酰胺组的大鼠出现不同程度的掉毛、毛色灰暗、精神欠佳、食欲不振、活动量减少等表现。
2.2 用药后大鼠体重的比较
处理 2 周后,紫杉醇与其对照组大鼠体重均较处理前有增加趋势,紫杉醇对照组大鼠体重增加更明显,但两组无明显统计学差异。环磷酰胺组较其对照组大鼠的生长受到影响,体重增加不明显,甚至有下降趋势,两组间存在统计学差异(图 1)。
2.3 大鼠卵巢的大体外观形态比较
肉眼下观察发现紫杉醇组、紫杉醇对照组与环磷酰胺对照组大鼠卵巢外观均呈球性,呈淡粉红色或白色,表面凹凸不平,可见大小不等半透明或透明的卵泡。环磷酰胺组大鼠卵巢体积缩小,苍白,表面半透明或透明的隆起减少,大小不均匀,透明度差。部分卵巢局部见充血。提示环磷酰胺作用后实验组大鼠的卵巢结构受到影响。

图 1 两种不同的化疗药物处理后大鼠体重的比较(*P < 0.05)
Figure 1 Comparison of body weight of rats treated with two different chemotherapy drugs (*< 0.05)

图 2 两种不同的化疗药物处理后卵巢长径的比较(*P < 0.05)
Figure 2 Comparison of ovarian length after treatment with two different chemotherapy drugs (*< 0.05)
2.4 用药后大鼠双侧卵巢长径的变化
紫杉醇组与其对照组处理 2 周后大鼠卵巢长径无明显变化。环磷酰胺组大鼠的左右卵巢长径较其对照组均有下降的趋势,存在统计学差异。同时观察发现右卵巢长径较左卵巢长径有下降的趋势,分析表明可能与卵巢注射部位有关(图 2)。提示,环磷酰胺可能影响卵巢结构。
2.5 用药后两组间雌激素、促卵泡素水平的比较
分别比较紫杉醇组与其对照组,环磷酰胺组与其对照组血清中 E2 的含量,发现均存在 E2 明显下降(图 3A)。提示,紫杉醇和环磷酰胺均对大鼠E2 的表达产生影响,明显影响卵巢分泌 E2 的功能。同时,分别比较紫杉醇组与其对照组,环磷酰胺组与其对照组血清中 FSH 的表达,发现紫杉醇组与紫杉醇对照组中 FSH 表达未见明显差异,环磷酰胺对照组较环磷酰胺组 FSH 水平明显升高(图 3B)。提示环磷酰胺明显影响大鼠体内 FSH、E2 的分泌,影响卵巢功能,紫杉醇仅降低了 E2 的分泌,未影响 FSH 的分泌,说明紫杉醇对卵巢的损伤作用有限。
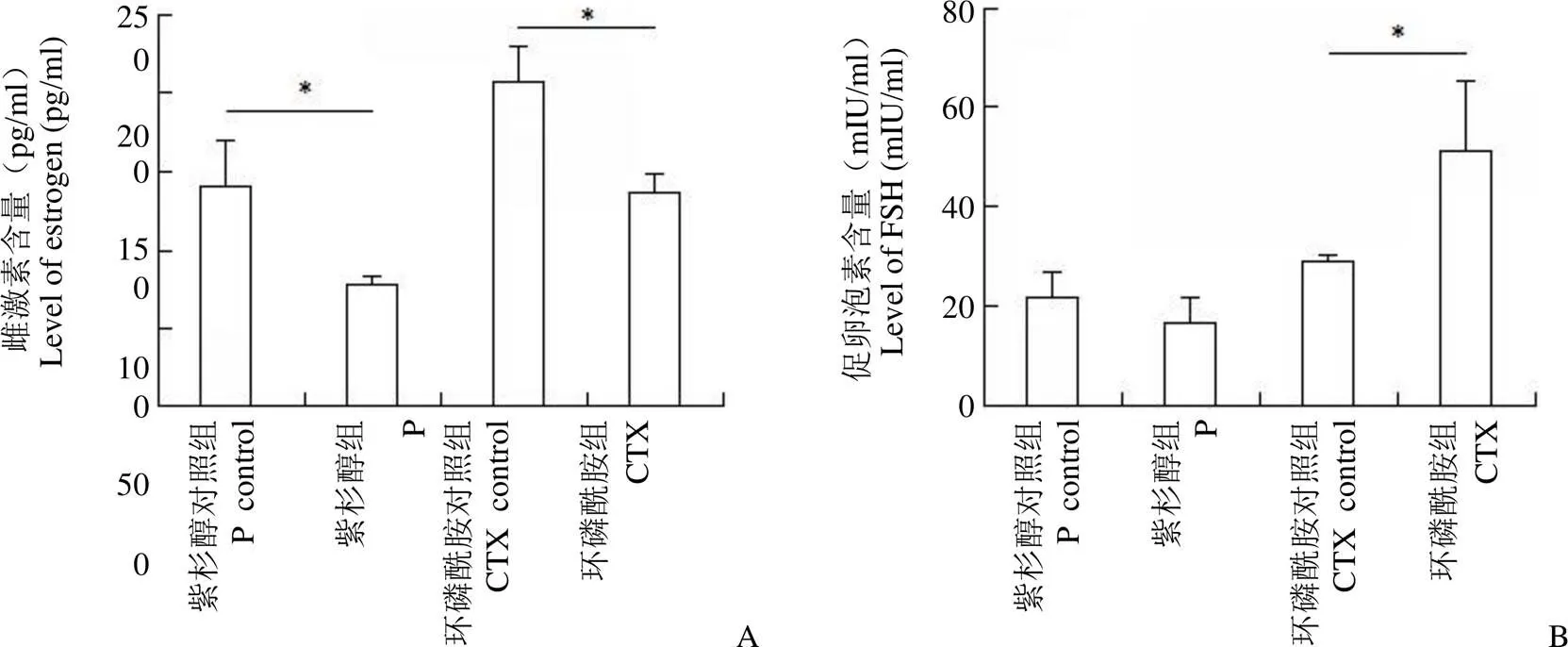
图 3 两种不同的化疗药物处理后雌激素(A)和促卵泡素(B)含量的比较(*P < 0.05)
Figure 3 Comparison of estrogen (A) and follicle stimulating hormone (B) content after treatment of two different chemotherapy drugs (*< 0.05)
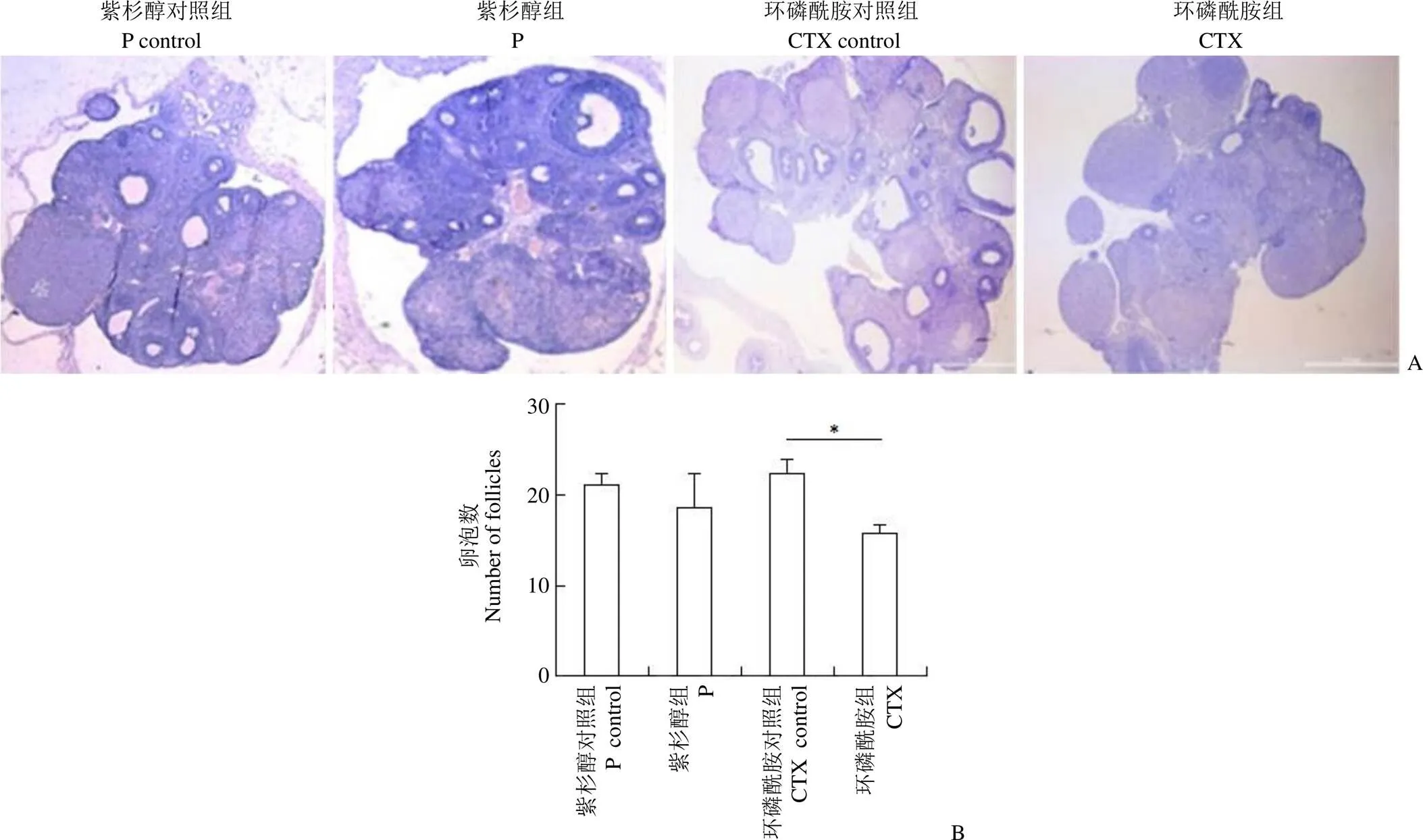
图 4 光镜下两种不同化疗药物处理后卵巢结构(A)及各组总卵泡数(B)的比较(*P < 0.05)
Figure 4 Comparison of ovarian structure (A) and total follicle number (B) of each group after treatment with two different chemotherapy drugs under light microscope (*< 0.05)
2.6 两种诱导剂处理后大鼠卵巢卵泡数的比较
各组卵巢 HE 染色后的显微镜下影像显示,紫杉醇组与其对照组总卵泡数比较,未发现明显的差别;环磷酰胺组与其对照组比较,卵泡数明显减少(图 4)。提示该剂量下的紫杉醇未影响卵泡的生长发育,环磷酰胺可影响卵泡的生长发育。
3 讨论
卵巢早衰病因复杂,可能与内源性基因、异常自身免疫、心理因素、外源性物质、感染、药物治疗如化疗,手术(如双侧卵巢切除术)等因素密切相关,但在大多数情况下,病因仍然未知[7-8]。对于育龄妇女来说,化疗和放疗损害了性腺功能,是发生 POF 的重要原因[9-10]。虽然许多药物可用于 POF 的治疗,但这些药物效率较低,同时产生很多副作用。因此,寻找有效的治疗 POF 的药物仍是当务之急。
近年来,人们对干细胞的研究与日俱增,对干细胞的认识逐渐成熟。干细胞不仅具有自我更新多向分化潜能,也分泌多种生长因子、趋化因子、细胞因子等活性物质,同时调节免疫反应、细胞增殖、促进损伤组织修复等方面发挥巨大作用[11]。目前,应用干细胞治疗卵巢早衰已成为当前的研究热点。然而干细胞的无限增殖潜能、致瘤性、异体移植的免疫排斥反应,限制了其临床应用。因此,干细胞在进入 POF 临床研究前需要进行临床前研究,即动物模型进行评估。
在前期研究中,为了进一步提高对 POF 发病原因、机制和治疗方法的认识,建立了很多种 POF 动物模型,如免疫型、基因型、代谢型、化疗药物作用型等[12]。理想的 POF 动物模型的建立是以能快速模拟 POF 的临床症状,同时出现激素变化、卵泡卵巢损伤为标准的。目前存在多种建模方式,操作复杂程度不一,模型稳定性差异较大,其中造模时间短,操作简单,稳定性好且重复率高的化疗药物所造模型较为常用。尽管不同的化疗药物,如烷化剂、紫杉醇、甲氨蝶呤和阿霉素等造模时均可出现 POF 的典型特点,但是不同的诱导剂的性质,作用方式及机制的不同,使模型的稳定型存在差异[13]。因此,本研究选择两种常用的化疗药物环磷酰胺和紫杉醇作为诱导剂,比较两种诱导剂建立模型的差异,建立稳定的模型制备方法。
癌症是世界范围内的主要公共卫生问题,据报道中国每年约有 169 万女性被诊断为癌症,其中处于前五的癌症种类中,2.78% 的患者年龄在 30 岁以下,12.25% 的患者年龄在 30 ~ 44 岁之间[14]。肿瘤诊疗技术的发展显著提高了患者的预期寿命,据报道预计到 2024 年,美国将有 1900 万癌症存活者[15]。而化疗常常导致生育能力和生殖内分泌功能丧失,从而增加 POF 的风险。化疗引起的 POF 受多种因素的影响,其中化疗药物较强的性腺毒性发挥着重要作用。据报道,紫杉醇是治疗卵巢癌、宫颈癌、乳腺癌和肺癌等上皮癌最常用的化疗药物之一。同时,也是复发淋巴瘤、小细胞肺癌、食管癌、胃癌等恶性肿瘤化疗的二线药物[16]。紫杉醇以剂量依赖的方式损害健康,影响卵母细胞的成熟,同时影响生育力[17]。环磷酰胺是临床常用的烷化剂类化疗药物,对女性生殖器官尤其卵巢特别敏感。有研究显示,接受环磷酰胺、甲氨蝶呤和氟尿嘧啶化疗的女性患者有 60% ~ 80% 发展为 POF[18]。环磷酰胺加速卵巢原始卵泡发展为成熟卵泡,减少卵巢储备,从而导致年轻女性发生卵巢功能衰竭。紫杉醇和环磷酰胺均是临床常用的化疗药物,能够引起卵巢功能不同程度的损伤,从而引起 POF[19-20]。本研究检测了环磷酰胺与紫杉醇对大鼠卵巢结构、卵泡数及卵巢内分泌功能的影响,结果显示环磷酰胺处理后大鼠卵巢萎缩,卵泡数减少,雌激素水平下降,促卵泡素升高,与临床卵巢早衰患者血清学表现一致。证实了环磷酰胺可通过影响卵巢结构、卵泡数及内分泌功能促使卵巢功能受损,从而促使卵巢早衰模型成功。
而以往的研究中,未重视 POF 模型建立过程中出现假阳性的情况,即可能由于化疗药物毒性作用,存在对大鼠卵巢功能的急性损伤或药物毒性一过性,一段时间后卵巢功能可能自发修复。为避免对后续机制和治疗等方面研究的影响,本研究认为可选择毒性更大,作用时间更长的环磷酰胺作为诱导剂建立动物模型,同时设置空白对照组排除化疗药物引起卵巢功能急性损伤的干扰及假阳性动物模型的建立[21]。
综上所述,环磷酰胺处理大鼠后,卵巢结构出现不同程度的损伤,卵泡数下降,同时可降低血清雌激素的水平,升高 FSH 水平,造模成功。本研究操作简单,模型可靠,可为卵巢功能损伤的发病机制的探索及后续干细胞治疗研究提供有效的动物模型。
[1] Chen X, Wang Q, Li X, et al. Heat shock pretreatment of mesenchymal stem cells for inhibiting the apoptosis of ovarian granulosa cells enhanced the repair effect on chemotherapy-induced premature ovarian failure. Stem Cell Res Ther, 2018, 9(1):240.
[2] Kokcu A. Premature ovarian failure from current perspective. Gynecol Endocrinol, 2010, 26(8):555-562.
[3] Jin J. Stem cell treatments. JAMA, 2017, 317(3):330.
[4] Liu M, Qiu Y, Xue Z, et al. Small extracellular vesicles derived from embryonic stem cells restore ovarian function of premature ovarian failure through PI3K/AKT signaling pathway. Stem Cell Res Ther, 2020, 11(1):3.
[5] Melekoglu R, Ciftci O, Eraslan S, et al. Beneficial effects of curcumin and capsaicin on cyclophosphamide-induced premature ovarian failure in a rat model. J Ovarian Res, 2018, 11(1):33.
[6] Elfayomy AK, Almasry SM, El-Tarhouny SA, et al. Human umbilical cord blood-mesenchymal stem cells transplantation renovates the ovarian surface epithelium in a rat model of premature ovarian failure: possible direct and indirect effects. Tissue and Cell, 2016, 48(4):370-382.
[7] Ge W, Li L, Dyce PW, et al. Establishment and depletion of the ovarian reserve: physiology and impact of environmental chemicals. Cell Mol Life Sci, 2019, 76(9):1729-1746.
[8] Kiriakova V, Cooray SD, Yeganeh L, et al. Management of bone health in women with premature ovarian insufficiency: Systematic appraisal of clinical practice guidelines and algorithm development. Maturitas, 2019, 128:70-80.
[9] Spears N, Lopes F, Stefansdottir A, et al. Ovarian damage from chemotherapy and current approaches to its protection. Hum Reprod Update, 2019, 25(6):673-693.
[10] Wong QHY, Anderson RA. The role of antimullerian hormone in assessing ovarian damage from chemotherapy, radiotherapy and surgery. Curr Opin Endocrinol Diabetes Obes, 2018, 25(6):391-398.
[11] Tam PP, Pera MF. Stem cell science and regenerative medicine. Bioessays, 2013, 35(3):147-148.
[12] Zhang T, Yan D, Yang Y, et al. The comparison of animal models for premature ovarian failure established by several different source of inducers. Regul Toxicol Pharmacol, 2016, 81:223-232.
[13] Song D, Zhong Y, Qian C, et al. Human umbilical cord mesenchymal stem cells therapy in cyclophosphamide-induced premature ovarian failure rat model. Biomed Res Int, 2016, 2016:2517514.
[14] Yang L, Zheng R, Wang N, et al. Incidence and mortality of stomach cancer in China, 2014. Chin J Cancer Res, 2018, 30(3):291-298.
[15] Badawy A, Sobh MA, Ahdy M, et al. Bone marrow mesenchymal stem cell repair of cyclophosphamide-induced ovarian insufficiency in a mouse model. Int J Womens Health, 2017, 9:441-447.
[16] Yucebilgin MS, Terek MC, Ozsaran A, et al. Effect of chemotherapy on primordial follicular reserve of rat: an animal model of premature ovarian failure and infertility. Aust N Z J Obstet Gynaecol, 2004, 44(1):6-9.
[17] Roness H, Kalich-Philosoph L, Meirow D. Prevention of chemotherapyinduced ovarian damage: possible roles for hormonal and non-hormonal attenuating agents. Hum Reprod Update, 2014, 20(5):759-774.
[18] Bines J, Oleske DM, Cobleigh MA. Ovarian function in premenopausal women treated with adjuvant chemotherapy for breast cancer. J Clin Oncol, 1996, 14(5):1718-1729.
[19] Meirow D, Biederman H, Anderson RA, et al. Toxicity of chemotherapy and radiation on female reproduction. Clin Obstet Gynecol, 2010, 53(4):727-739.
[20] Kovanci E, Schutt AK. Premature ovarian failure: clinical presentation and treatment. Obstet Gynecol Clin North Am, 2015, 42(1):153-161.
[21] Ling L, Feng X, Wei T, et al. Effects of low-intensity pulsed ultrasound (LIPUS)-pretreated human amnion-derived mesenchymal stem cell (hAD-MSC) transplantation on primary ovarian insufficiency in rats. Stem Cell Res Ther, 2017, 8(1):283.
Establishment of animal model of premature ovarian failure
LI Hui, WANGShuang-jie, YEXue, CHENG Hong-yan, MA Rui-qiong, ZHANG Meng-lei, CHANG Xiao-hong
To establish animal models of premature ovarian failure using different chemotherapy drugs, and to explore the establishment of stable animal models of premature ovarian failure.
Two common chemotherapeutic drugs, paclitaxel and cyclophosphamide, were used to induce female wister rats with normal estrous cycles. They were divided into paclitaxel group, paclitaxel control group, cyclophosphamide group and cyclophosphamide control group. After a period of time, the general physiology of the rats were observed, and the changes in the body weight of each group were detected. ELISA technique was used to detect the expression of E2 and FSH in the serum of each group, and the changes in the morphology of the ovaries and the number of follicles were compared.
Compared with the control group, the cyclophosphamide group had reduced activity, weight loss, lower E2 level (< 0.05), higher FSH level (< 0.05), atrophy of the ovaries, and significant reduction in the number of follicles. Compared with the control group, the paclitaxel group showed significant decrease in estrogen content and increase in body weight. There were no significant differences in activity, ovarian structure, ovarian length, follicle number, and follicle-stimulating hormone.
Cyclophosphamide has advantage over paclitaxel in establishing an animal model of premature ovarian failure and is more suitable for studies related to premature ovarian failure.
Cyclophosphamide; Paclitaxel; Premature ovarian failure; Animal model
CHANG Xiao-hong, Email: changxiaohong@pukph.edu.cn
北京大学人民医院研究与发展基金(RDH2017-06)
昌晓红,Email:changxiaohong@pukph.edu.cn
10.3969/j.issn.1673-713X.2020.06.003
Author Affiliations: Department of Obstetrics and Gynecology (LI Hui, WANG Shuang-jie, YE Xue, CHENG Hong-yan, MA Rui-qiong, CHANG Xiao-hong),Gynecological Oncology Center (LI Hui, YE Xue, CHENG Hong-yan, MA Rui-qiong, CHANG Xiao-hong), Animal Laboratory (ZHANG Meng-lei), Peking University People’s Hospital, Beijing 100044, China
2020-04-13
