人淋巴细胞国家参考品的协作标定
2020-12-17胡泽斌高飞孙彬裕孙楠杨振黄杰
胡泽斌,高飞,孙彬裕,孙楠,杨振,黄杰
·技术与方法·
人淋巴细胞国家参考品的协作标定
胡泽斌*,高飞*,孙彬裕,孙楠,杨振,黄杰
100050 北京,中国食品药品检定研究院体外诊断试剂检定所
根据卫生行业标准 WS/T 360-2011《流式细胞术检测外周血淋巴细胞亚群指南》[1]以及业内共识,通常使用白细胞分化抗原 CD45/CD4/CD8/CD3/CD19/CD16 和(或)CD56 单一检测试剂或组合亚群检测试剂(流式细胞法),通过流式细胞术检测外周血或骨髓细胞表面的白细胞分化抗原(CD)表达,来分析不同亚群淋巴细胞的绝对计数和百分比[2-4]。CD45+用于鉴别白细胞,在所有白细胞上都有表达,称为白细胞共同抗原,CD3+用于鉴别成熟 T 淋巴细胞,CD3+CD4+双阳用于鉴别 T 淋巴细胞中的辅助/诱导淋巴细胞亚群,CD3+CD8+双阳用于鉴别 T 淋巴细胞中的抑制/细胞毒性淋巴细胞亚群。CD3-CD19+用于鉴别 B 淋巴细胞,CD3-CD16+和(或)CD56+用于鉴别自然杀伤细胞(NK 细胞)。
标准物质是具有准确量值的一种或多种足够均匀且稳定特性的材料,标准物质的定值是对标准物质特性量赋值的过程[5-7]。一般有以下四种定值方式可根据实际情况进行选择。①用高准确度的绝对测量方法定值,如参考测量程序和方法;②采用两种以上不同原理的已知准确度的可靠方法定值;③多个实验室合作定值,即协作标定;④使用已有的一级标准物质对正在研制的二级标准物质进行比较定值。本单位研制的人淋巴细胞国家参考品,预期用途是评价淋巴细胞亚群检测试剂的准确性。而目前尚无绝对测量方法对 CD45+/CD4+/CD8+/CD3+/CD19+/CD16+和(或)CD56+细胞亚群的绝对数量和百分比进行定值,故采用公认的流式细胞法,多家实验室协作标定的方式对其进行定值。
1 材料与方法
1.1 材料
1.1.1 仪器 BD FACS Calibur 流式细胞仪由巴德生物科技有限公司提供;FACS Calibur 和 Canto II 流式细胞仪由 BD 公司提供;Beckman Coulter 流式细胞仪、Navios 流式细胞仪、DxFLEX 流式细胞仪由贝克曼库尔特公司提供;ACEA Novocyte 流式细胞仪由艾森生物提供;Beckman Navios 流式细胞仪、BD Canto II 流式细胞仪由北京旷博生物技术股份有限公司提供;Bricyte E6 流式细胞仪由迈瑞生物医疗电子股份有限公司提供。
1.1.2 试剂 商品化全血质控品为美国 Beckman Coulter 和 IMMUNO-TROL Cells 以及 Statusflow 的产品;CD4+细胞国际质控品为英国生物制品检定所的质控品;BD MultiTEST IMK Kit(淋巴细胞亚群检测试剂盒)和绝对计数管为美国 BD Biosciences 公司产品;4 色 TBNK 荧光单克隆抗体试剂盒和绝对计数微球为北京同生时代公司产品;CD45FITC/CD4PE/CD8ECD/CD3PC5 和 CD45FITC/ CD56PE/CD19ECD/CD3PC5 淋巴细胞亚群检测试剂盒以及 Flow Count 微球为美国 Beckman Coulter 公司产品;ACEA 的 4 色检测试剂 CD3/CD8/CD45/CD4 和 CD3/ CD16+56/CD45/CD19 以及 ACEA 的 6 色检测试剂 CD3/CD16+56/CD45/CD4/CD19/CD8 淋巴细胞亚群检测试剂盒为艾森生物公司产品;CD3/CD8/CD45/CD4 和 CD3/CD16+56/CD45/CD19 淋巴细胞亚群检测试剂盒为迈瑞生物医疗电子股份有限公司产品。
1.2 方法
1.2.1 人淋巴细胞国家参考品协作标定实验方案 选择业界认可度和知名度较高的具有良好实验条件的 6 家实验室作为合作单位,本单位负责制定实验方案并汇总统计分析实验数据。6 家实验室分别是贝克曼库尔特商贸(中国)有限公司(Beckman)、碧迪医疗器械(上海)有限公司、北京旷博生物技术股份有限公司、迈瑞生物医疗电子股份有限公司、艾森生物(杭州)有限公司、巴德生物科技有限公司。各实验室均需参照 WS/T 360-2011《流式细胞术检测外周血淋巴细胞亚群指南》要求,使用国家药品监督管理局已批准上市的淋巴细胞亚群检测试剂(流式细胞法)和绝对计数微球/管(流式细胞法),在不同的流式细胞仪平台上进行实验操作和数据分析。
每家分发 3 ~ 5 支人淋巴细胞国家参考品候选品、1 支 CD4+细胞国际质控品以及足量的用于复溶候选品和国际质控品的纯水,冰袋运输至各家实验地点。企业收到邮寄的样本如当天不能实验,需放置冰箱(2 ~ 8 ℃)并在 5 d 内完成检测。每支候选品重复测试 2 次。
1.2.2 人淋巴细胞国家参考品的协作标定实验操作 参考品为白色冻干粉,使用时应先拧开黑色外瓶盖,小心打开瓶口内的胶塞(瓶塞),避免损失内容物。加 1 ml 纯水,将瓶塞盖回,上下轻轻颠倒 3 ~ 5 次,室温静置 5 min 使所有内容物完全复溶。复溶后立即使用。在绝对计数管底部加入 10 ~ 20 μl 荧光抗体试剂(按照各家试剂说明书用量),再加入 100 ~ 300 μl 充分混匀的复溶细胞悬液,在涡旋仪上轻轻混匀,置于室温,避光反应 20 ~ 30 min(按照试剂说明书建议)。每管补加 PBS 溶液至总体积 500 μl,混匀后,在各家流式细胞仪上进行检测,细胞获取数至少 1 万个,以 CD45 阳性细胞群进行设门,分析 T/B/NK 淋巴细胞亚群的百分比和绝对计数。
同时,在不同的流式细胞仪平台上检测时,均需使用商品化全血质控品或者 CD4+细胞国际质控品进行实验质量控制[8-10]。
2 结果
2.1 协作标定实验结果
参考品共在 6 家合作单位的 7 个流式检测平台上进行了检测,使用了 6 种 T/B/NK 淋巴细胞亚群流式试剂。各家检测时在每个实验条件下,均使用了商品化全血质控品或者 CD4+细胞国际质控品进行质量控制,质控品淋巴细胞测得的绝对数和百分比均在其靶值范围内,表明各家实验操作成立,参考品的测得结果可信。对协作标定结果进行分析整理汇总,共获得 11 组数据,详见表 1 ~ 11。

表 1 协作标定结果 1
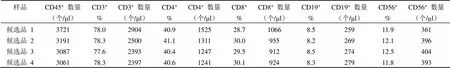
表 2 协作标定结果 2
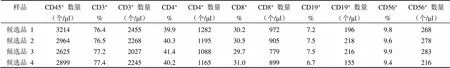
表 3 协作标定结果 3

表 4 协作标定结果 4
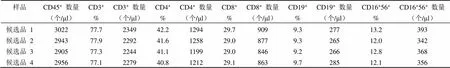
表 5 协作标定结果 5

表 6 协作标定结果 6

表 7 协作标定结果 7

表 8 协作标定结果 8
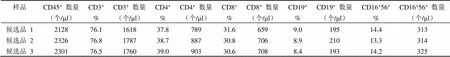
表 9 协作标定结果 9
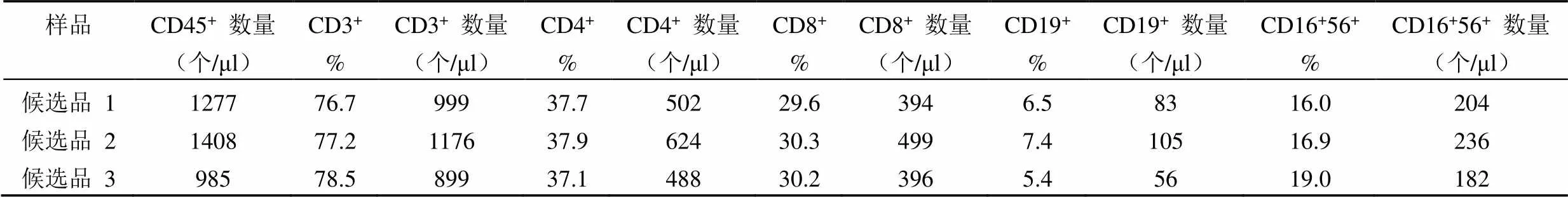
表 10 协作标定结果 10

表 11 协作标定结果 11
2.2 剔除离群值
将以上 6 家标定的 11 组 40 个平行数据进行比对,各家 T 和 B 淋巴细胞亚群百分比数值基本一致,NK 百分比差别较大,各家亚群细胞绝对计数的数值也比较一致,仅其中一家公司标定的细胞绝对数量整体均偏低约 1 倍。将所有结果进行汇总分析,求得各检测指标(CD45+的绝对数量,CD3+、CD4+、CD8+、CD19+、CD56+或 CD16+CD56+的百分比和绝对数量)的总平均值 M、标准差 SD(表 12)。采用 Grubbs 统计法,以 CD45+细胞绝对数量的 M ± 2SD(1353 ~ 4037 个/μl)和 CD3+细胞绝对数量的 M ± 2SD (1080~ 3112 个/μl)为依据来剔除离群值。该公司测得的 2 组 6 个平行数据中(表 10 和 11)的 4 个均低于 M-2SD,因此作为离群值剔除其所有数据,而其他 5 家9 组数据(表 1 ~ 9)保留,作为协作标定的合理有效数据进行定值。

表 12 11 组原始数据的总平均值 M、标准差 SD

表 13 细胞绝对数量有效数据的总平均值 M、标准差 SD 以及 ±2SD 范围
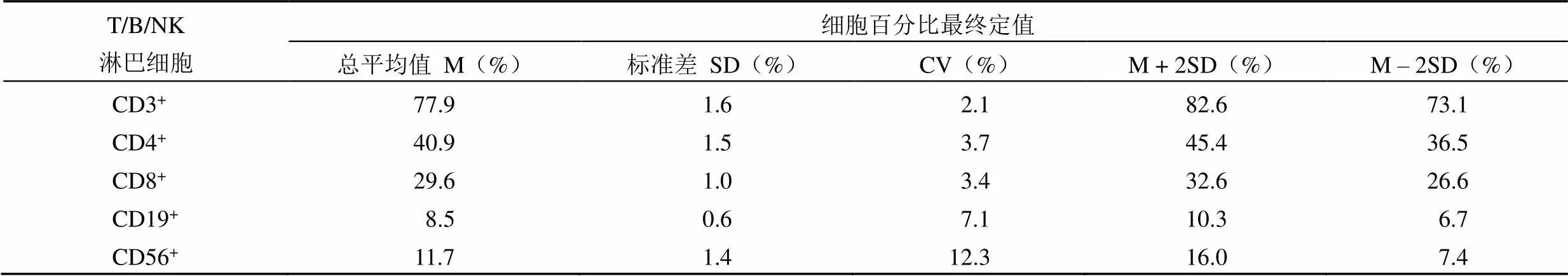
表 14 细胞百分比有效数据的总平均值 M、标准差 SD 以及 ±3SD 范围
2.3 参考品的最终定值
剔除离群值后,有 5 家单位在 6 个流式检测平台上(Navious、FC500、DxFLEX、Canto II、Calibur、Bricyte E7)进行了检测,将此 9 个实验条件下的 34 个有效数据(表 1 ~ 9)进行统计分析,求总平均值 M 和标准差 SD 以及总体变异系数 CV%,如表 13 ~ 14 所示。赋值结果较为理想,各实验条件下对 CD3+细胞百分比(占 CD45+细胞数)、CD3+CD4+细胞百分比(占 CD45+细胞数)、CD3+CD8+细胞百分比(占 CD45+细胞数)的赋值结果总变异系数 CV% 均小于 4.0%;CD3-CD19+细胞百分比(占 CD45+细胞数)的赋值结果总变异系数 CV% 小于 8.0%;对 CD45+细胞绝对数量、CD3+细胞绝对数量、CD3+CD4+细胞绝对数量、CD3+CD8+细胞绝对数量、CD3-CD19+细胞绝对数量的赋值结果总变异系数 CV% 均小于 15.0%;NK 细胞(CD3-CD56+,或者 CD3-CD16+CD56+)百分比(占 CD45+细胞数)和绝对数量的赋值结果总变异系数 CV% 分别为 12.3% 和 18.4%。
故 T/B/NK 淋巴细胞的绝对数量以 34 个有效数据的 M ± 2SD 作为可接受范围,T/B/NK 淋巴细胞的百分比以 34 个有效数据的 M ± 3SD 作为可接受范围,以对人淋巴细胞国家参考品进行定值。该参考品最终定值结果如下:① CD45+白细胞数:2202 ~ 3662 个/μl;② CD3+成熟T 淋巴细胞数:1720 ~ 2831 个/μl,占 CD45+白细胞的百分比为 73.1% ~ 82.6%;③ CD3+CD4+辅助/诱导 T 淋巴细胞数:894 ~ 1501 个/μl,占 CD45+白细胞的百分比为 36.5% ~ 45.4%;④ CD3+CD8+抑制/细胞毒性 T 淋巴细胞数:667 ~ 1062 个/μl,占 CD45+白细胞的百分比为 26.6% ~ 32.6%;⑤ CD3-CD19+B 淋巴细胞数:180 ~ 313 个/μl,占 CD45+白细胞的百分比为 6.7% ~ 10.3%;⑥ CD3-CD16+或者 CD3-CD16+CD56+的 NK 细胞数:214 ~ 463 个/μl,占 CD45+白细胞的百分比为 7.4% ~ 16.0%。
3 讨论
本研究中的实验操作和数据分析,均是参照 WS/T 360-2011 《流式细胞术检测外周血淋巴细胞亚群指南》。各亚群细胞绝对计数均采用单平台法[1],即用于流式细胞术测定细胞绝对浓度的一种方法,所有结果均来自流式细胞仪一台仪器的测定。浓度的测定可以直接通过测定体积的方法或间接的通过加入已知浓度的荧光微球来计算。单平台方法消除了两台仪器所产生的系统误差。
本研究中协作标定实验室基本涵盖了所有在流式细胞仪检测淋巴细胞领域有影响力的国内外生产企业,包括贝克曼库尔特商贸(中国)有限公司、碧迪医疗器械(上海)有限公司、北京旷博生物技术股份有限公司、迈瑞生物医疗电子股份有限公司等;使用的淋巴细胞亚群检测试剂也基本涵盖了已取得医疗器械产品注册证的不同厂家产品,同时还包括了 4 色和 6 色试剂;使用的流式细胞仪检测平台也基本涵盖了所有已批准上市的仪器。这些仪器和试剂也是在临床检测中广泛使用的。所以保证了本参考品定值的准确性,能够满足其作为标准物质的要求。
在 6 家协作标定公司中,有一家公司采用流式细胞仪体积计数法,使用 4 色和 6 色 T/B/NK 淋巴细胞亚群检测试剂盒,测得参考品的 T/B/NK 淋巴细胞绝对数的数据整体低于参考品的赋值范围下限,但测得的百分比数据均在参考品的赋值范围内,究其原因可能与该公司的实验操作过程细节控制有关。临床样本一般为全血,检测时需要添加溶血素,溶血素中含有一定的表面活性剂,可以减少细胞抱团和管壁黏附现象;与临床全血样本不同,国家参考品复溶后不需要使用溶血素,且细胞浓度较低,如果参考品加样体积偏小并使用缺乏表面活性剂的流式管上样检测,可能会导致测得细胞数量偏低。
综上所述,该批人淋巴细胞国家参考品可用于人 T/B/NK 淋巴细胞亚群检测试剂和绝对计数试剂(流式细胞法)的准确性评价。
[1] Ministry of Health of the People's Republic of China. WS/T 360-2011 Guidelines for peripheral lymphocyte subsets by flow cytometry. Beijing: Standards Press of China, 2011. (in Chinese)
中华人民共和国卫生部. WS/T 360-2011 流式细胞术检测外周血淋巴细胞亚群指南. 北京: 中国标准出版社, 2011.
[2] Zhou P. Clinical application of flow cytometry immunotyping. Int J Lab Med, 2011, 32(16):1854-1856. (in Chinese)
周萍. 流式细胞免疫分型在临床的应用研究. 国际检验医学杂志, 2011, 32(16):1854-1856.
[3] Chen XH, Bai M, Zhang ZZ, et al. Clinical significance of lymphocyte function determination in common lung diseases. J Pract Med, 2019, 35(20):3204-3207. (in Chinese)
陈向红, 白敏, 张造章, 等. 淋巴细胞功能测定对常见肺部疾病的临床意义. 实用医学杂志, 2019, 35(20):3204-3207.
[4] Wang WW, Xi D, Yuan XL, et al. Comparison of three different flow cytometers in the clinical assessment of lymphocyte subsets. Chin J Lab Med, 2016, 39(5):361-365. (in Chinese)
王维维, 奚迪, 袁向亮, 等. 不同流式细胞分析仪检测淋巴细胞亚群的比较研究. 中华检验医学杂志, 2016, 39(5):361-365.
[5] National Administrative Commission for CRM's. Development, management and application of standard substances. Beijing: China Metrology Press, 2010. (in Chinese)
全国标准物质管理委员会. 标准物质的研制、管理与应用. 北京: 中国计量出版社, 2010.
[6] Quan H, Han YZ. Standard substances and their application techniques. 2nd. Beijing: Standards Press of China, 2003. (in Chinese)
全浩, 韩永志. 标准物质及其应用技术. 2版. 北京: 中国标准出版社, 2003.
[7] National Administrative Commission for CRM's. Certification and statistical principles for standard substances. Beijing: China Quality Inspection press, 2011. (in Chinese)
全国标准物质管理委员会. 标准物质定值原理和统计学原理. 北京: 中国质检出版社, 2011.
[8] Wu LJ, Xu DS. Quality control of flow cytometric immunophenotyping. Chin J Lab Med, 2011, 34(5):389-394. (in Chinese)
吴丽娟, 许东升. 流式细胞术表型分析的质量控制. 中华检验医学杂志, 2011, 34(5):389-394.
[9] Stebbings R, Wang L, Sutherland J, et al. Quantification of cells with specific phenotypes I: determination of CD4+ cell count per microliter in reconstituted lyophilized human PBMC prelabeled with anti-CD4 FITC antibody. Cytometry A, 2015, 87(3):244-253.
[10] Wang L, Stebbings R, Gaigalas AK, et al. Quantification of cells with specific phenotypes II: Determination of CD4 expression level on reconstituted lyophilized human PBMC labelled with anti-CD4 FITC antibody. Cytometry A, 2015, 87(3):254-261.
*同为第一作者
10.3969/j.issn.1673-713X.2020.06.014
国家科技重大专项(2018ZX10732401-003-009)
黄杰,Email:jhuang5522@126.com;杨振,Email:yangzhen@ nifdc.org.cn
2020-07-09
