NDM-1抑制剂研究进展
2020-12-17王倩刘忆霜
王倩,刘忆霜
·综述·
NDM-1抑制剂研究进展
王倩,刘忆霜
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所国家新药(微生物)筛选实验室
抗生素的发现是人类抵御细菌感染性疾病的重大突破。然而随着抗生素的广泛使用和滥用,细菌多药耐药问题日益严峻,对人类健康构成了巨大的威胁。碳青霉烯类抗生素一度被视为革兰氏阴性菌感染的“最后一道防线”,但随着碳青霉烯酶的出现,碳青霉烯耐药的革兰氏阴性菌(如大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌)在全球范围内快速蔓延,为临床治疗带来了新的挑战[1-3]。
新德里金属-β-内酰胺酶-1(New Delhi metallo-β-lactamase-1,NDM-1),属于 B1 类金属β-内酰胺酶(metallo-β-lactamases,MBLs),自 2008 年首次被报道以来,NDM-1 因其广谱耐药作用(可水解除单环 β-内酰胺类以外所有的 β-内酰胺类抗生素)、变异体的多样性(通过不同位置的氨基酸发生突变进化出的新变种已达 24 个)、可转移性(编码基因NDM-1 可通过质粒迅速传播)而备受关注[2, 4-6]。表达 NDM-1 的菌株可引起尿道感染、肺部感染、败血症等多种疾病,但临床治疗结果显示,以表达 NDM-1 为特点的“超级细菌”仅对黏菌素、替加环素、磷霉素等少量抗生素敏感[2, 4, 7]。因此,寻找低毒高效的 NDM-1 抑制剂是研究者们亟待解决的重大科学问题。
1 NDM-1 的结构及催化机制
NDM-1 具有典型的 αβ/βα 夹层结构,其活性中心包含两个由氢氧根桥接的二价锌离子:Zn1(与氨基酸His120、His122、His189配位)和 Zn2(与氨基酸Asp124、Cys208、His250配位)[4]。NDM-1 的催化机制尚无明确定论,部分学者认为其遵循双锌催化机制,主要假说为:底物通过羰基氧原子与 Zn1 配位、内酰胺氮原子与 Zn2 配位来极化内酰胺键,亲核的羟基攻击底物羰基碳,形成过渡态复合体,最终导致 C-N 键的断裂,内酰胺氮原子以阴离子的形式被释放,Zn2 作为超强酸提供质子使其稳定[8]。
2 NDM-1 抑制剂的研究现状
目前文献报道的 NDM-1 抑制剂高达 500 多个[4],根据作用机制可大概分为三类:第一类抑制剂直接作用于 NDM-1 活性部位的锌离子,如金属离子螯合剂三(2-吡啶基甲基)胺[tris(2-pyridylmethyl)amine,TPA]衍生物、真菌代谢产物曲霉明A(aspergillomarasmine A,AMA)等,通过螯合或替换锌离子抑制 NDM-1 的水解活性;第二类抑制剂则通过作用于 NDM-1 的氨基酸残基,阻碍 NDM-1 与底物结合,如紫檀芪、厚朴酚等;第三类抑制剂可同时靶向 NDM-1 活性部位的锌离子及催化关键氨基酸,发挥对NDM-1 的抑制作用,该类抑制剂包括天然植物成分蒽贝素、黄芩苷等。除上述三类抑制剂外,还有部分活性物质可通过其他机制抑制 NDM-1,如肽偶联磷酸二酰胺吗啉低聚物(PPMO);或作用机制尚不明确,如 ANT431。
2.1 与锌离子相互作用的抑制剂
2.1.1 依地酸钙钠 依地酸钙钠是一种ethylene diamine tetraacetic acid,EDTA与钙离子的络合物,在临床上被批准用于铅中毒的解毒治疗。与 EDTA相比,依地酸钙钠的毒性较低[9]。Aoki 等发现依地酸钙钠可降低亚胺培南对产 MBLs(IMP-1/2/7/10 和 VIM-2)的临床分离菌株的minimum inhibitory concentration,MIC。在后续研究中,该团队又证实了依地酸钙钠可以降低亚胺培南和美罗培南对 NDM-1 阳性菌株的 MIC(亚胺培南 MIC ≤ 1 ~ 2 μg/ml;美罗培南MIC ≤1 ~ 4 μg/ml),在 NDM-1 阳性菌株感染的小鼠脓毒症模型中,依地酸钙钠与亚胺培南/西司他丁钠联合使用可降低细菌数量[10]。
2.1.2 TPA 衍生物 以传统的金属螯合剂为骨架设计合成结构修饰物以规避其体内毒性,保留其良好的活性是研究者寻找 NDM-1 抑制剂的重要策略之一。Schnaars等[11]以选择性锌螯合剂TPA为骨架合成了一系列衍生物,其中 6 个衍生物对美罗培南具有较好的增效作用,且对 HepG2 细胞具有相对较低的毒性(IC50> 100 μmol/L)。代表性化合物 15(图 1)可使美罗培南对所检测的产MBL(VIM-1、NDM-1、VIM-29)临床分离株的 MIC降低至原来的1/32 ~ 1/256,但对产丝氨酸 β-内酰胺酶(serine β-lactamases,SBLs)的临床分离株无明显作用。生化分析结果显示,化合物 15 对纯化的 NDM-1 和 VIM-2 均有抑制活性,inact/I分别为 12.5 L/(mmol·min) 和 0.500 L/(mmol·min)。
2.1.3 DPA 衍生物 Chen 等[12]以吡啶-2,6-二甲酸(2,6-dipicolinic acid,DPA)为骨架合成的衍生物 36(图 1)对 NDM-1 有良好的抑制活性(IC50值降低至 DPA 的1/5:80 ± 2 nmol/L),同时对 VIM-2 和 IMP-1 的抑制作用也较 DPA 增强。100 mg/L 化合物 36 与亚胺培南联合使用可使亚胺培南对产 NDM-1 临床分离菌株的 MIC 降低至敏感水平,且在此浓度下,化合物 36 对细菌细胞和人源细胞HEK293 均无明显损伤作用。化合物 36 对体内其他锌离子依赖的金属酶如 HDACs、hCAII 亦无明显抑制作用,说明化合物 36 具备良好的体内安全性。核磁共振氢谱、电子顺磁共振光谱和平衡透析实验等结果表明,化合物 36 可能通过与 NDM-1 活性部位结合形成 NDM-1:Zn(II):抑制剂三元复合体而发挥抑制作用[12]。
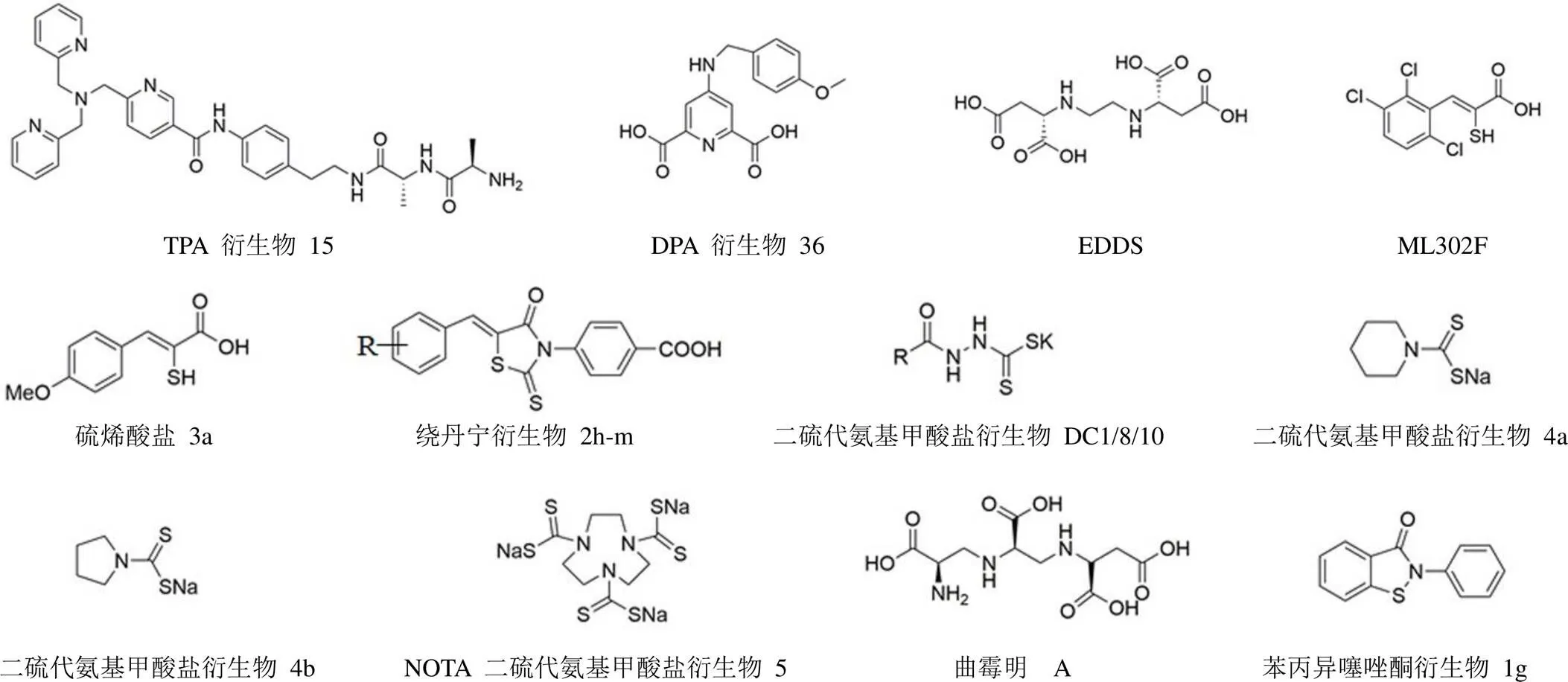
图 1 与锌离子相互作用的抑制剂
2.1.4 (S,S)-乙二胺-N,N'-二琥珀酸 (S,S)-乙二胺-N,N'-二琥珀酸[(S,S)-ethylenediamine-N,N'-disuccinic acid,EDDS,图 1]是由细菌产生的可生物降解的天然金属螯合剂,对多种 MBLs 具有抑制活性,其中对 NDM-1 的作用最佳,IC50值为 0.18 μmol/L,加入外源性锌离子可逆转该抑制作用[13]。EDDS 与 β-内酰胺类抗生素联合使用可显著增强β-内酰胺类抗生素对表达 NDM-1 的大肠杆菌突变株的活性,当 EDDS 浓度为 32 mg/L 时,可分别使美罗培南和亚胺培南对 NDM-1 表达突变株的 MIC 降低至原来的1/8533以下和 1/512。继而检测 EDDS 对多种表达不同碳青霉烯酶的临床分离菌株的活性,结果表明,EDDS 可恢复亚胺培南对所有检测的 MBLs 阳性株的抗菌活性,而对于 MBLs 阴性株,EDDS 的加入并不能改变其耐药性[13]。在产NDM-1 肺炎克雷伯菌感染的体内模型中,EDDS 与亚胺培南联合用药可使实验组动物存活率显著升高[13]。
2.1.5 绕丹宁类化合物 绕丹宁骨架(2-硫代-4-噻唑烷酮)是多种药用天然产物的重要组成部分。在抗菌药物研发中,绕丹宁亦是优越的杂环结构,其衍生物具有很强的抗菌活性[14]。其中,代表性化合物 ML302 被报道为 VIM-2 和 IMP-1 的双重抑制剂,并可增强亚胺培南对产 VIM-2/IMP-1/NDM-1 临床分离菌株的活性[15]。Brem等[16]通过 ML302 与 VIM-2 共结晶分析发现,ML302 可能通过水解产生硫烯酸盐产物 ML302F(图 1),ML302F 螯合 VIM-2 活性部位的两个锌离子从而抑制 VIM-2 的活性。进一步的生物活性检测结果显示,ML302F 对 MBLs(NDM-1、VIM-2 和 BcII 等)具有广谱抑制活性,IC50<(1.76 ± 0.51)μmol/L[16]。
然而在 Xiang 等[17]的研究中,由绕丹宁类衍生物水解得到的硫烯酸盐类化合物 3a(图1)仅能抑制 VIM-2 和 L1 的活性,对 NDM-1 和 ImiS 并无抑制作用。同时发现二芳基取代的绕丹宁衍生物 2h-m(图 1)对 MBLs(NDM-1、VIM-2、ImiS 和 L1)具有广谱抑制活性,IC50< 16 μmol/L,与头孢唑啉或亚胺培南联合使用可增强产 MBLs 重组工程菌对 β-内酰胺类抗生素的敏感性。分子对接结果表明,化合物 2l 通过硝基(NDM-1、CphA 和 L1)或羧基(VIM-2)与酶活性部位的锌离子配位结合,通过N-苯基与酶形成疏水相互作用。
2.1.6 二硫代氨基甲酸盐衍生物 Ge 等[18]以二硫代氨基甲酸盐为骨架设计合成的衍生物 DC1、DC8、DC10(图 1)对进行检测的 5 种 MBLs(NDM-1、VIM-2、IMP-1、ImiS 和 L1)具备广谱抑制活性,其中针对 NDM-1 的 IC50值分别为 0.38、0.53 和 1.52 μmol/L。DC1 与头孢唑啉联合使用可提高重组 NDM-1 表达工程菌株对头孢唑啉的敏感性,当 DC1 的浓度为 64 μg/ml 时,可使头孢唑啉的 MIC 降低至原来的 1/16[18]。分子对接结果显示,DC1 通过羟基和羰基与 NDM-1 活性部位的 Zn2+形成配位键而发挥可逆性抑制作用。
Wang 等[19]合成的二硫代氨基甲酸盐衍生物 4a/4b(图 1)和 Zhang 等[20]合成的 1,4,7-三氮杂环壬烷-1,4,7-三乙酸(1,4,7-triazacyclononane-1,4,7-triacetic acid,NOTA)二硫代氨基甲酸盐衍生物 5(图 1)也可显著提高产 NDM-1 临床分离菌株对美罗培南的敏感性。锌离子回补实验表明,上述化合物对 NDM-1 的抑制作用与对锌离子的影响有关。
2.1.7 AMA AMA(图 1)作为一种真菌来源的天然产物,可以快速不可逆地抑制 NDM-1 的催化活性,IC50值为(4.0 ±1.0)μmol/L,同时对 VIM-2 也有抑制作用,IC50值为(9.6 ± 2.4)μmol/L[21]。AMA 可以恢复 NDM/VIM 阳性临床分离菌株(肠杆菌、不动杆菌和假单胞菌)对美罗培南的敏感性[21]。在产 NDM-1 的肺炎克雷伯菌感染的小鼠模型中,AMA 与美罗培南联合使用可使小鼠肝脏及脾脏的细菌负荷降低,存活率明显升高[21]。锌离子回补实验和质谱分析结果提示,AMA 可能通过去除 NDM-1 活性中心的 Zn2+发挥抑制活性[21]。
2.1.8 铋制剂和铜制剂 抗幽门螺杆菌药物胶体次枸橼酸铋(colloidal bismuth subcitrate,CBS)及相关铋制剂能够不可逆地抑制 B1 类 MBLs(NDM-1、VIM-2 和 IMP-4)的催化活性,X 射线晶体衍射分析表明其机制为 Bi3+替换活性中心的两个 Zn2+,导致锌离子辅因子的释放[22]。在体外活性检测中,CBS 及其他铋制剂(Bi(NAC)3、Bi(NIT)3和Bi(PCM)2)与美罗培南联合使用均可恢复美罗培南对 NDM-1 阳性临床分离菌株的抗菌活性,其中以 Bi(NAC)3的作用最为显著[22]。此外,CBS 与美罗培南联合用药可显著提高 NDM-1 阳性大肠杆菌感染小鼠的存活率,这说明 CBS 在体内也可发挥对 NDM-1 的抑制作用[22]。除 Bi3+以外,Cu2+也被报道具有 NDM-1 抑制活性,并可能影响 NDM-1的合成、成熟或稳定,其与抗真菌剂吡啶硫酮的配位复合物有望成为临床应用碳青霉烯类抗生素的佐剂[23]。
2.1.9 苯并异噻唑酮 苯并异噻唑酮是新近报道的可作为 NDM-1 共价不可逆抑制剂的骨架结构,体内及体外实验表明,基于此结构合成的化合物 1g(图 1)对 NDM-1 有显著的抑制活性(体外 IC50值为 0.16 μmol/L,体内 IC50值为 35.1 μmol/L)[24]。化合物 1g 与头孢唑啉联合给药,可恢复头孢唑啉对重组 NDM-1 表达工程菌的抗菌活性,当化合物 1g 的浓度为 16 μg/ml 时,可使头孢唑啉的 MIC 降低至原来的 1/256。平衡透析实验结果表明,化合物 1g 可能通过移除 NDM-1 活性部位的一个 Zn2+而抑制 NDM-1 的活性。
2.1.10 Thanatin Thanatin 是昆虫经诱导产生的一种抗菌肽,由 21 个氨基酸组成,在Cys11和 Cys18之间形成二硫键[25]。Ma 等[25]报道thanatin 通过竞争性替换 NDM-1 阳性菌外膜的二价阳离子,导致脂多糖释放,从而破坏细菌外膜,发挥抗菌活性,当thanatin 剂量为 6 mg/kg时,可使产NDM-1 的大肠杆菌 XJ141026 感染的脓毒症小鼠存活率达到 100%,并显著降低血液、肝脏、脾脏及肺的细菌负荷。此外,thanatin 还可以通过替换 NDM-1 活性中心的锌离子抑制 NDM-1 的催化活性[IC50值为(3.21 ± 0.78) μmol/L,i 值为(2.84 ± 0.33)μmol/L],逆转 NDM-1 阳性表达菌株对碳青霉烯类抗生素的抗性。在产 NDM-1 的大肠杆菌 XJ141026 感染的小鼠脓毒症模型中,0.1 mg/kg thanatin 与美罗培南联合使用即可显著提高实验组小鼠的存活率,降低肝脏及脾脏的细菌负荷[25]。
2.2 与氨基酸残基相互作用的抑制剂
2.2.1 紫檀芪 紫檀芪(图 2)是一种最初从紫檀中分离出的酚类化合物,在传统医学中被用于糖尿病的治疗[26]。在近期报道中,Liu 等[27]通过体外和体内活性检测揭示了紫檀芪作为 NDM-1 抑制剂的潜能。紫檀芪可以剂量依赖性地抑制 NDM-1 的活性(IC50值为 15.37 μg/ml),并可恢复美罗培南对 NDM-1 阳性表达菌株的抗菌效果。在小鼠大腿感染(NDM-1 阳性菌)实验中,紫檀芪与美罗培南联合给药组小鼠大腿的细菌负荷显著降低;在小鼠肺炎模型(NDM-1 阳性菌感染)实验中,紫檀芪与美罗培南联合给药可使实验小鼠的存活率显著升高[27]。分子动态模拟结果提示,紫檀芪与 NDM-1 的氨基酸残基 Trp93和 Asp124形成较强的相互作用,从而占据 NDM-1 的催化口袋,阻碍 NDM-1 与底物结合,降低 NDM-1 的催化性能。
2.2.2 厚朴酚 厚朴酚(图 2)是从木兰树皮中分离得到的天然产物,可通过与 NDM-1催化口袋的氨基酸残基形成氢键或疏水相互作用阻碍酶与底物的结合,降低 NDM-1 的催化活性(IC50值为 6.47 μg/ml)[28]。厚朴酚可以恢复美罗培南对产 NDM-1 的大肠杆菌 ZC-YN3 的抗菌活性,并在联合用药3 h 时达到完全杀菌的效果。分子对接结果显示,厚朴酚可与 NDM-1 的氨基酸 Ser217形成氢键,并与 Val73、Lys211、Leu218、Gly219和 His250等氨基酸残基相互作用[28]。
2.2.3 3-溴丙酮酸 小分子化合物 3-溴丙酮酸(图 2)对 B1 类和 B2 类 MBLs 有潜在抑制活性,尤其以对NDM-1 的作用最为显著(IC50值为 2.57 μmol/L),并且在三株不同 NDM-1 阳性表达的临床分离菌株中,3-溴丙酮酸可不同程度地降低头孢噻肟、美罗培南等 5 种 β-内酰胺类药物的 MIC[29]。鉴于 3-溴丙酮酸的类似物丙酮酸对 NDM-1 并无抑制活性,且活性测试表明 3-溴丙酮酸可能靶向MBLs 活性中心的半胱氨酸残基,研究者推断,3-溴丙酮酸可能通过亲电性亚甲基与 NDM-1 活性部位的半胱氨酸硫醇形成共价结合以实现对 NDM-1 的可逆性抑制[29]。该推断在接下来的硫醇化合物竞争实验中得到了初步证实,硫醇化合物(如二硫苏糖醇、半胱氨酸)与 3-溴丙酮酸同时使用可以恢复 NDM-1 的催化活性。

图 2 与氨基酸残基相互作用的抑制剂
2.2.4 1,4,7-三氮杂环壬烷 1,4,7-三氮杂环壬烷(1,4,7-triazacyclononane,TACN,图 2)是归属于 NOTA和 1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10- tetraazacyclododecane-1,4,7,10-tetraacetic acid,DOTA)系列的环状化合物。Somboro 等[30]发现,TACN 可恢复美罗培南对产 B1 类 MBLs 的临床分离菌株的抗菌活性,但对产 SBLs 的菌株无明显作用。酶活性实验提示 TACN 对 NDM-1 的抑制作用呈浓度依赖性和时间依赖性,通过计算机模拟技术进一步分析 TACN 与 NDM-1 之间的相互作用,结果表明,TACN 可能通过氢键(His250和 Asp124)和疏水相互作用(His122、Asn220和 Trp93)与 NDM-1 结合从而抑制其催化活性[30]。
2.2.5 对氯汞苯甲酸和硝普盐 对氯汞苯甲酸(p-chloromercuribenzoic acide,p-CMB,图 2)和硝普盐是 Thomas 等[31]基于高通量筛选模型从 LOPAC 化合物库中筛选得到的两个潜在 NDM-1 抑制剂,两者均为硫醇修饰化合物。质谱分析结果显示,p-CMB 与 NDM-1 的共价结合与氨基酸 Cys208相关。然而,当研究者将 Asp 替代 NDM-1 活性部位的 Cys208,突变型 NDM-1 几乎保持了完全的酶活性,但却丧失了对 p-CMB 的反应性,这提示我们针对 NDM-1 中的 Cys 残基进行药物设计的策略可能存在局限性[31]。
2.3 同时作用于锌离子和氨基酸残基的抑制剂
2.3.1 双环硼酸盐 双环硼酸盐作为潜在广谱 β-内酰胺酶抑制剂被多次报道,其作用机制为模拟 β-内酰胺酶催化过程中的阴离子高能四面体中间体,抑制 SBLs/MBLs 的活性,在该过程中,硼酸盐可能优先以 sp2 杂化形式(硼原子)与 SBLs/MBLs 结合,以 sp3 形式(硼原子)形成稳定的酶-抑制剂复合物[32-35]。双环硼酸盐的代表性化合物 VNRX-5133(taniborbactam,图 3)与第四代头孢菌素——头孢吡肟的联合用药方案目前正处于 III 期临床试验阶段[35]。Liu 等[35]在最近的研究中指出,VNRX-5133 对所检测的 SBLs(如 KPC-2、AmpC、OXA-1/48)及 MBLs(NDM-1 和 VIM-2)均有较好的抑制活性。当 VNRX-5133 与头孢吡肟联合用药时,VNRX-5133 可显著提高头孢吡肟对产 SBLs/MBLs 革兰氏阴性耐药株的抗菌活性[35]。在中性粒细胞缺乏的小鼠肺部感染模型(产 CTX-M-14 的肺炎克雷伯菌)和小鼠泌尿道上行感染模型(产 CTX-M-15 的大肠杆菌)中,VNRX-5133 与头孢吡肟联合使用可分别降低肺部组织和肾内的活菌数[35]。
2.3.2 卡托普利及其衍生物 卡托普利作为已上市的降血压药物,可通过巯基与 NDM-1 催化口袋的两个锌离子配位结合,通过羧基与 Asn220形成氢键,抑制 NDM-1 的活性(D-卡托普利,图 3,IC50值为 7.9 μmol/L;L-卡托普利,图 3,IC50值为 202.0 μmol/L)[36-38]。Li 等[39]在卡托普利结构基础上进行设计优化,合成的 3-巯基-2-甲基丙酸的苄酰胺衍生物化合物 22(图 3)展现出对 NDM-1 较好的抑制作用,IC50值为 1.0 μmol/L。Meng 等[40]合成的衍生物 14m(图 3)也可显著抑制 NDM-1 的催化活性,IC50值为 0.12 μmol/L,与美罗培南联合使用可显著增强 NDM-1 阳性临床分离菌株对美罗培南的敏感性。
2.3.3 蒽贝素 蒽贝素(图 3)是从白花酸藤果中分离出的苯醌衍生物,Ning 等[41]首次报道了蒽贝素对 NDM-1 的抑制活性,IC50值为(2.1 ± 0.2)μmol/L,i 值为(0.19 ± 0.02)μmol/L。分子动力学研究表明,蒽贝素以其醌基部分与 NDM-1 结合,脂肪烃链部分则滞留在 NDM-1 催化口袋以外,蒽贝素与氨基酸残基 Cys208和 Asp124形成的两个氢键可能是其与 NDM-1 特异性识别与结合的分子基础,此外,苯醌上的羟基可直接与 NDM-1 活性部位的 Zn2+配位结合[41]。蒽贝素可恢复多种 β-内酰胺类抗生素对产 NDM-1 的肺炎克雷伯菌 BAA-2146 的抗菌活性,当蒽贝素的浓度为 32 μg/ml 时,可分别使美罗培南、比阿培南和亚胺培南的 MIC 降低至原来的 1/512、1/128 和 1/256。
2.3.4 黄芩苷 黄芩苷(图3)是从黄芩中提取的主要活性成分,对 NDM-1 有良好的抑制作用[IC50值为(3.89 ± 1.1)μmol/L][42]。分子对接结果显示,黄芩苷可通过羧基直接作用于 NDM-1 活性部位的 Zn2+,并可与酶多处氨基酸残基(Glu152、Gln123、Met67、Trp93和 Phe70)形成氢键[42]。进一步活性测试表明,黄芩苷可恢复 NDM-1 重组工程菌对头孢呋辛及氨苄青霉素的敏感性,当黄芩苷浓度为64 μg/ml 时,可使两者的 MIC 降低至原来的 1/16。

图 3 同时作用于锌离子和氨基酸残基的抑制剂
2.3.5 三唑硫代乙酰胺类化合物 Zhang 等[43]在 2014 年报道二芳基取代的唑基硫代乙酰胺衍生物(图 3)对 NDM-1有抑制作用(i < 7 μmol/L),其三唑基团可与 NDM-1 活性中心的锌离子配位结合。2016 年该团队以三唑硫代乙酰胺为骨架合成的 24 个三唑硫代乙酰胺类化合物均对 NDM-1 有抑制活性,IC50值为 0.15 ~ 1.90 μmol/L[44]。分子对接结果表明,其代表性化合物 4d 和 6c 的三唑环可与 NDM-1 活性部位的 Zn1 和 Zn2 直接作用,酰胺键可与氨基酸 Lys211(Lys224)相互作用,以此形成与 NDM-1 的稳定结合[44]。该团队在 2019 年再次发表研究,揭示了卤代三唑硫代乙酰胺作为 MBLs 抑制剂的潜能,其中氯代化合物 1、2、3 对 NDM-1 有抑制作用,IC50值低于0.96 μmol/L[45]。
2.3.6 ZINC84525623 ZINC84525623(图 3)是 Rehman 等[46]利用高通量虚拟筛选技术在 ZINC 库中发现的潜在 NDM-1 抑制剂,其通过与氨基酸Gln123、Asp124、Lys211和 Asn220形成氢键,与 Zn2 和 Asp124形成静电作用,与 His250等氨基酸残基形成疏水相互作用而与 NDM-1 酶活性中心稳定结合。在 IC50检测实验中,ZINC84525623 展现出略低于 D-卡托普利的抑制活性,可使 NDM-1 的催化效能(cat/m)降低至原来的 1/3.13 ~ 1/7.37[46]。
2.4 抑制 NDM-1 表达的抑制剂
不同于以往 NDM-1 抑制剂的筛选和设计理念,Sully 等[47]构建靶向 NDM-1 mRNA 的肽偶联磷酸二酰胺吗啉低聚物(peptide-conjugated phosphorodiamidate morpholino oligomer,PPMO),从基因水平干预 NDM-1 的表达。体外活性检测结果表明,NDM-1 PPMO 可抑制NDM-1 的表达,继而恢复 NDM-1 阳性菌株对碳青霉烯类药物的敏感性。在表达NDM-1 的大肠杆菌 CVB-1 感染的小鼠脓毒症模型中,PPMO 与美罗培南联合使用可显著提高感染小鼠的生存率,降低血液和脾脏中的细菌负荷,缓解炎症反应[47]。
2.5 机制尚不明确的抑制剂
2.5.1 植物叶片提取物 Chandar 等[48]通过对 240 种药用植物叶片的乙醇提取物进行筛选,得到来自石榴、大麻槿、酸角等 6 种植物的提取物对 NDM-1 具有体外抑制活性,IC50值在 0.50 ~ 1.2 ng/µl 之间。除对 NDM-1 有抑制活性外,这 6 种化合物还可通过破坏细菌细胞壁的完整性来发挥抗菌作用。当分别与黏菌素、美罗培南和四环素联合给药时,6 种化合物均发挥协同抗菌作用,(fractional inhibitory concentration index,为 0.09 ~ 0.375[48]。然而,上述提取物的抗菌活性是否为多种化合物的组合或源于某单个高效化合物仍需进一步确证。
2.5.2 ANT431 ANT431(图4)是基于苗头化合物吡啶-2-羧酸进行设计修饰所得到的MBLs 特异性抑制剂[49]。ANT431 可竞争性抑制 NDM-1 和 VIM-2 的活性,i 值分别为0.29 和 0.195 μmol/L[49]。当 ANT431 浓度为 30 μg/ml 时,可显著提高美罗培南对重组 NDM-1/VIM-2 表达工程菌的活性,并可使美罗培南对 79% 所检测的 NDM-1 阳性临床分离菌株的 MIC 降低至药敏水平:2 μg/ml。在产 NDM-1 的临床分离大肠杆菌IR3 感染的小鼠大腿感染模型中,ANT431 与美罗培南联合用药可显著降低感染大腿的细菌负荷。与体内其他金属酶如 ACE 相比,ANT431 对 MBLs 具有良好的选择性,且药代动力学参数良好,显示出较高的成药潜能[49]。遗憾的是,研究者并未详细阐述 ANT431 发挥 NDM-1 抑制活性的分子机制,其具体作用方式有待进一步探讨。

ANT431
3 展望
近年来,NDM-1 及其变异体在包括中国在内的众多国家迅速扩散,这不仅归因于其在不同菌种间的高频转移,也与旅行、卫生等人为因素息息相关[50]。尽管在过去的几年中,研究者围绕 NDM-1 的结构特征、生物学功能和作用机制展开了一系列研究,但至今没有可用于临床的 NDM-1 特效抑制剂,携带 NDM-1 的临床相关细菌俨然已成为治疗感染性疾病的巨大威胁[4]。
随着由 NDM-1 导致的细菌耐药问题日益严峻,积极寻找高效抑制剂辅助 β-内酰胺类抗生素治疗成为对抗产 NDM-1 耐药细菌的重要策略[50]。然而,纵观 NDM-1 抑制剂的研发历程,研究者频频受挫,其中,催化机制不清是阻碍抑制剂研发的重要因素。NDM-1 的活性位点位于一个由柔性环(L3 和 L10)限定的宽而浅的槽中,促使酶具备与广泛底物结合的特征,然而,NDM-1 与不同底物的具体结合模式不甚相同,结合位点具有可塑性,为抑制剂靶向目标的确立增加了难度[4, 51]。
目前,既能螯合 NDM-1 活性部位的锌离子,又能与结合位点的氨基酸残基形成氢键和(或)盐桥的分子被认为是最具潜力的 NDM-1 抑制剂[4]。尽管螯合 NDM-1 活性部位的锌离子常常被作为筛选和设计 NDM-1 抑制剂的重要策略,但由于依赖锌离子的酶在人体内广泛存在,基于此策略得到的化合物的“脱靶效应”仍需慎重考量和规避;同时,NDM-1 的突变正趋向于增强体内锌离子亲和力,提高对锌离子缺乏的耐受,为未来抑制剂的研发掷出了新的难题[52]。双环硼酸盐类化合物 VNRX-5133 与头孢吡肟的联合用药方案已进入 III 期临床试验阶段,这为科研工作者们提供了新的思路,即通过模拟 β-内酰胺类抗生素水解过程中的四面体中间体有望实现对 SBLs 和 MBLs 的双重抑制。
随着生物学、药物化学等多学科知识与技术的发展,NDM-1 与底物的作用模式及规律有望得到更精确、更完善的阐述,从而助力 NDM-1 抑制剂的研发,缓解“超级细菌”的耐药现状。
[1] Fritzenwanker M, Imirzalioglu C, Herold S, et al. Treatment options for carbapenem-resistant gram-negative infections. Dtsch Arztebl Int, 2018, 115(20-21):345-352.
[2] Khan AU, Maryam L, Zarrilli R. Structure, genetics and worldwide spread of New Delhi metallo-β-lactamase (NDM): a threat to public health. BMC Microbiol, 2017, 17(1):101.
[3] Pal A, Tripathi A. Quercetin inhibits carbapenemase and efflux pump activity among carbapenem-resistant Gram-negative bacteria. APMIS, 2020, 128(3):251-259.
[4] Linciano P, Cendron L, Gianquinto E, et al. Ten years with New Delhi metallo-β-lactamase 1 (NDM-1): from structural insights to inhibitor design. ACS Infect Dis, 2019, 5(1):9-34.
[5] King D, Strynadka N. Crystal structure of New Delhi metallo-β-lactamase reveals molecular basis for antibiotic resistance. Protein Sci, 2011, 20(9):1484-1491.
[6] Wu W, Feng Y, Tang G, et al. NDM metallo-β-lactamases and their bacterial producers in health care settings. Clin Microbiol Rev, 2019, 32(2):e00115-18.
[7] Rolain JM, Parola P, Cornaglia G. New Delhi metallo-beta-lactamase (NDM-1): towards a new pandemia? Clin Microbiol Infect, 2010, 16(12):1699-1701.
[8] Wang Z, Fast W, Valentine AM, et al. Metallo-beta-lactamase: structure and mechanism. Curr Opin Chem Biol, 1999, 3(5):614-622.
[9] Aoki N, Ishii Y, Tateda K, et al. Efficacy of calcium-EDTA as an inhibitor for metallo-β-lactamase in a mouse model of pseudomonas aeruginosa pneumonia. Antimicrob Agents Chemother, 2010, 54(11): 4582-4588.
[10] Yoshizumi A, Ishii Y, Livermore DM, et al. Efficacies of calcium-EDTA in combination with imipenem in a murine model of sepsis caused by Escherichia coli with NDM-1 β-lactamase. J Infect Chemother, 2013, 19(5):992-995.
[11] Schnaars C, Kildahl-Andersen G, Prandina A, et al. Synthesis and preclinical evaluation of TPA-based zinc chelators as metallo-β- lactamase inhibitors. ACS Infect Dis, 2018, 4(9):1407-1422.
[12] Chen AY, Thomas PW, Stewart AC, et al. Dipicolinic acid derivatives as inhibitors of New Delhi metallo-β-lactamase-1. J Med Chem, 2017, 60(17):7267-7283.
[13] Proschak A, Kramer J, Proschak E, et al. Bacterial zincophore [S,S]-ethylenediamine-N,N’-disuccinic acid is an effective inhibitor of MBLs. J Antimicrob Chemother, 2018, 73(2):425-430.
[14] Maddila S, Gorle S, Jonnalagadda SB. Drug screening of rhodanine derivatives for antibacterial activity. Expert Opin Drug Discov, 2020, 15(2):203-229.
[15] Spicer T, Minond D, Enogieru I, et al. ML302, a novel beta-lactamase (BLA) inhibitor.//Probe Reports from the NIH Molecular Libraries Program. Bethesda (MD): National Center for Biotechnology Information (US), 2010.
[16] Brem J, van Berkel SS, Aik W, et al. Rhodanine hydrolysis leads to potent thioenolate mediated metallo-β-lactamase inhibition. Nat Chem, 2014, 6(12):1084-1090.
[17] Xiang Y, Chen C, Wang WM, et al. Rhodanine as a potent scaffold for the development of broad spectrum metallo-β-lactamase inhibitors. ACS Med Chem Lett, 2018, 9(4):359-364.
[18] Ge Y, Xu LW, Liu Y, et al. Dithiocarbamate as a valuable scaffffold for the inhibition of metallo-β-lactmases. Biomolecules, 2019, 9(11):699.
[19] Wang MM, Chu WC, Yang Y, et al. Dithiocarbamates: Efficient metallo-β-lactamase inhibitors with good antibacterial activity when combined with meropenem. Bioorg Med Chem Lett, 2018, 28(21): 3436-3440.
[20] Zhang E, Wang MM, Huang SC, et al. NOTA analogue: a first dithiocarbamate inhibitor of metallo-β-lactamases. Bioorg Med Chem Lett, 2017, 28(2):214-221.
[21] King AM, Reid-Yu SA, Wang W, et al. AMA overcomes antibiotic resistance by NDM and VIM metallo-β-lactamases. Nature, 2014, 510(7506):503-506.
[22] Wang R, Lai TP, Gao P, et al. Bismuth antimicrobial drugs serve as broad-spectrum metallo-β-lactamase inhibitors. Nat Commun, 2018, 9(1):439.
[23] Djoko KY, Achard MES, Phan MD, et al. Copper ions and coordination complexes as novel carbapenem adjuvants. Antimicrob Agents Chemother, 2018, 62(2):e02280-17.
[24] Su J, Liu J, Chen C, et al. Ebsulfur as a potent scaffold for inhibition and labelling of New Delhi metallo-β-lactamase-1 in vitro and in vivo. Bioorg Chem, 2019, 84:192-201.
[25] Ma B, Fang C, Lu L, et al. The antimicrobial peptide thanatin disrupts the bacterial outer membrane and inactivates the NDM-1 metallo-β-lactamase. Nat Commun, 2019, 10(1):3517.
[26] Schmidlin L, Poutaraud A, Claudel P, et al. A stress-inducible resveratrol O-methyltransferase involved in the biosynthesis of pterostilbene in grapevine. Plant Physiol, 2008, 148(3):1630-1639.
[27] Liu S, Zhang J, Zhou Y, et al. Pterostilbene restores carbapenem susceptibility in New Delhi metallo-β-lactamase-producing isolates by inhibiting the activity of New Delhi metallo-β-lactamases. Br J Pharmacol, 2019, 176(23):4548-4557.
[28] Liu S, Zhou Y, Niu X, et al. Magnolol restores the activity of meropenem against NDM-1-producing Escherichia coli by inhibiting the activity of metallo-beta-lactamase. Cell Death Discov, 2018, 4:28.
[29] Kang PW, Su JP, Sun LY, et al. 3-Bromopyruvate as a potent covalently reversible inhibitor of New Delhi metallo-β-lactamase-1 (NDM-1). Eur J Pharm Sci, 2019, 18:105161.
[30] Somboro AM, Amoako DG, Osei Sekyere J, et al. 1,4,7- triazacyclononane restores the activity of β-lactam antibiotics against metallo-β-lactamase-producing enterobacteriaceae: exploration of potential metallo-β-lactamase inhibitors. Appl Environ Microbiol, 2019, 85(3):e02077-18.
[31] Thomas PW, Spicer T, Cammarata M, et al. An altered zinc-binding site confers resistance to a covalent inactivator of New Delhi metallo-beta-lactamase-1 (NDM-1) discovered by high-throughput screening. Bioorg Med Chem, 2013, 21(11):3138-3146.
[32] Cahill ST, Cain R, Wang DY, et al. Cyclic boronates inhibit all classes of β-lactamases. Antimicrob Agents Chemother, 2017, 61(4):e02260-16.
[33] Krajnc A, Lang PA, Panduwawala TD, et al. Will morphing boron-based inhibitors beat the β-lactamases? Curr Opin Chem Biol, 2019, 50:101-110.
[34] Krajnc A, Brem J, Hinchliffe P, et al. Bicyclic boronate VNRX-5133 inhibits metallo- and serine-β-lactamases. J Med Chem, 2019, 62(18): 8544-8556.
[35] Liu B, Trout REL, Chu GH, et al. Discovery of taniborbactam (VNRX-5133): a broad spectrum serine-and metallo-β-lactamase inhibitor for carbapenem-resistant bacterial infections. J Med Chem, 2019, 63(6):2789-2801.
[36] Guo Y, Wang J, Niu G, et al. A structural view of the antibiotic degradation enzyme NDM-1 from a superbug. Protein Cell, 2011, 2(5):384-394.
[37] King DT, Worrall LJ, Gruninger R, et al. New Delhi metallo-β- lactamase: structural insights into β-lactam recognition and inhibition. J Am Chem Soc, 2012, 134(28):11362-11365.
[38] Yusof Y, Tan DTC, Arjomandi OK, et al. Captopril analogues as metallo-β-lactamase inhibitors. Bioorg Med Chem Lett, 2016, 26(6): 1589-1593.
[39] Li N, Xu Y, Xia Q, et al. Simplified captopril analogues as NDM-1 inhibitors. Bioorg Med Chem Lett, 2014, 24(1):386-389.
[40] Meng Z, Tang ML, Yu L, et al. Novel mercapto propionamide derivatives with potent New Delhi metallo-β-lactamase‑1 inhibitory activity and low toxicity. ACS Infect Dis, 2019, 5(6):903-916.
[41] Ning NZ, Liu X, Chen F, et al. Embelin restores carbapenem efficacy against NDM-1-positive pathogens. Front Microbiol, 2018, 9:71.
[42] Shi C, Bao J, Sun Y, et al. Discovery of baicalin as NDM-1 inhibitor: virtual screening, biological evaluation and molecular simulation. Bioorg Chem, 2019, 88:102953.
[43] Zhang YL, Yang KW, Zhou YJ, et al. Diaryl-substituted azolylthioacetamides: inhibitor discovery of New Delhi metallo-β- lactamase-1 (NDM-1). ChemMedChem, 2014, 9(11):2445-2448.
[44] Zhai L, Zhang YL, Kang JS, et al. Triazolylthioacetamide: a valid scaffold for the development of New Delhi metallo-β-lactmase-1 (NDM-1) inhibitors. ACS Med Chem Lett, 2016, 7(4):413-417.
[45] Zhang Y, Yan Y, Liang L, et al. Halogen-substituted triazolethioacetamides as a potent skeleton for the development of metallo-β-lactamase inhibitors. Molecules, 2019, 24(6):1174.
[46] Rehman MT, AlAjmi MF, Hussain A, et al. High-throughput virtual screening, molecular dynamics simulation, and enzyme kinetics identified ZINC84525623 as a potential inhibitor of NDM-1. Int J Mol Sci, 2019, 20(4):819.
[47] Sully EK, Geller BL, Li L, et al. Peptide-conjugated phosphorodiamidate morpholino oligomer (PPMO) restores carbapenem susceptibility to NDM-1-positive pathogens in vitro and in vivo. J Antimicrob Chemother, 2017, 72(3):782-790.
[48] Chandar B, Poovitha S, Ilango K, et al. Inhibition of New Delhi metallo-β-lactamase 1 (NDM-1) producing escherichia coli IR-6 by selected plant extracts and their synergistic actions with antibiotics. Front Microbiol, 2017, 8:1580.
[49] Everett M, Sprynski N, Coelho A, et al. Discovery of a novel metallo-β-lactamase inhibitor that potentiate meropenem activity against carbapenem-resistant enterobacteriaceae. Antimicrob Agents Chemother, 2018, 62(5):e00074-18.
[50] Wei WJ, Yang HF, Ye Y, et al. New Delhi metallo-β-lactamase- mediated carbapenem resistance: origin, diagnosis, treatment and public health concern. Chin Med J (Engl), 2015, 128(14):1969-1976.
[51] Groundwater PW, Xu S, Lai F, et al. New Delhi metallo-β-lactamase-1: structure, inhibitors and detection of producers. Future Med Chem, 2016, 8(9):993-1012.
[52] Bahr G, Vitor-Horen L, Bethel CR, et al. Clinical evolution of New Delhi metallo-β-lactamase (NDM) optimizes resistance under Zn(II) deprivation. Antimicrob Agents Chemother, 2017, 62(1):e01849-17.
国家自然科学基金面上项目(81872913);国家高技术研究发展计划(863 计划)(2015AA 020911)
刘忆霜,Email:liuys@imb.pumc.edu.cn
2020-04-03
10.3969/j.issn.1673-713X.2020.06.009
