辛硫磷降解菌D39 的分离鉴定及评价
2020-12-16赵晓燕周方园吴晓青史亚微周红姿张广志范素素谢雪迎潘美霖张新建
赵晓燕,周方园,吴晓青,史亚微,周红姿,张广志,范素素,谢雪迎,潘美霖,张新建*
(1. 齐鲁工业大学(山东省科学院)生态研究所,山东省应用微生物重点实验室,山东 济南 250103;2. 北京航天威科环保科技有限公司,北京 丰台 100071)
0 引言
【研究意义】随着高毒农药的禁用,低毒农药逐渐占领市场。2015~2016 在工信部农药审批新发证的辛硫磷药企有455 家,辛硫磷目前已是世界上生产和销售量最大的有机磷农药之一[1]。辛硫磷是一种低毒有机磷杀虫剂,在农业、渔业和畜牧业中均有使用[2],长期过量使用导致辛硫磷残留超标。据报道辛硫磷能使成年雄鼠的生殖系统发生异常,长期接触辛硫磷会危害人们的心脏、肝脏等器官及生殖系统[3−5]。辛硫磷等有机磷杀虫剂在粮仓、蘑菇拌料、土壤及根茎类作物比在果蔬上残留时间长[6−7]。在粮食加工中,辛硫磷等有机磷杀虫剂残留主要在农作物的外表皮部分,因此用作饲料的麦麸、米糠等农副产品均存在辛硫磷严重超标的问题。【前人研究进展】目前对辛硫磷降解菌的报道主要有戴尔福特菌属(Delftiasp.)[8]、淡紫拟青霉(Paecilamyces lilaciuns)[9]和邻单胞菌属(Plesiomonassp.)[10]、芽胞杆菌属(Bacillussp.)[11]等,主要探讨降解菌对辛硫磷的降解和降解特性。【本研究切入点】前人研究大多集中在降解菌对辛硫磷的降解率和降解特性的研究方面,而未见对辛硫磷降解活性的追踪及应用方面的研究。本课题组筛选到1 株兼具防病作用的辛硫磷降解菌D39,该菌株为戴尔福特菌属(Delftiasp.)的新菌株。本研究对D39 降解活性进行定位,并提取胞内粗酶液在含辛硫磷的麸皮上进行降解活性检测。【拟解决的关键问题】辛硫磷降解菌D39 及其降解酶系能高效降解辛硫磷残留,是安全降解粮食和农副产品中辛硫磷残留的有效途径,该研究的高效降解菌及其胞内降解酶为粮食和农副产品中辛硫磷污染的降解提供技术支撑和理论基础。
1 材料与方法
1.1 供试菌株
白 菜 黑 腐 病 菌Xanthomonas campestrispv.campestris、玉米弯孢叶斑病菌Curvularia Lunata、黄瓜枯萎病菌Fusarium oxysporum f.sp. cucumerinum、苹果轮纹病菌Botryosphaeria dothidea和小麦纹枯病菌Rhizotonia cerealis均为山东省应用微生物重点实验室分离保存菌种。
1.2 供试培养基
基 础 无 机 盐 培 养 基(SMM g·L−1):NaCl 0.5、NH4NO31.00、 K2HPO41.50、 KH2PO40.50、MgSO4·7H2O 0.20,pH 7.0,以辛硫磷作为碳源(固体加琼脂15 g)。
PDA 培养基:马铃薯200 g、葡萄糖20 g、琼脂粉15 g、蒸馏水1 000 mL。
LB 培养基:胰蛋白胨10 g、酵母粉5 g、NaCl 10 g、蒸馏水1 000 mL(固体加琼脂15 g)。
1.3 仪器与试剂
仪器设备: DNP-9082 型电热恒温培养箱(上海精宏);HZQ-Q 全温振荡器(哈东联);Q10 超纯水仪(Millipore)Universal Hood;核 酸 凝 胶 成 像 仪(Bio-Rad)flexlid;PCR 仪(Eppendorf);Centrifuge5418台式离心机(Eppendorf);CR22G 低温高速离心机(HITACHI)XMTD-8222 电热恒温水浴锅(上海精宏);Sub-Cell GT 琼脂糖凝胶电泳系统(Bio-Rad);Mini Vortex 涡旋震荡仪(北京东林昌盛);HPLC 高效液相色谱仪UltiMate 3000(美国赛默飞公司)。
试剂: DNA MarkerTaq聚合酶,宝生物工程(大连)有限公司;2XTaqPCR Green Mix,北京鼎国昌盛生物技术有限公司;细菌基因组DNA 提取试剂盒(EasyPure Genomic DNA Kit),北京全式金生物技术有限公司;其他试剂均为国产分析纯。辛硫磷原药购自济南嘉禾化工有限公司。
1.4 辛硫磷降解菌的分离
采用富集培养法[10]分离辛硫磷降解菌。2016 年2 月从菏泽巨野后屯村不同的麦地和棉花地取样10 个样品。(通过调查发现辛硫磷高用药量的地块为10 块地,每块地五点取样法混合在一起为一个样品)在实验室内取样品土壤10 g,置于100 mL 的SMM 培养基中,加入100 mg·L−1的辛硫磷,30 ℃,150 r·min−1培养1 周,以10%的接种量接入新鲜的SMM 培养基中,并逐步提高(100、200、300、400、500)至辛硫磷的质量浓度达500 mg·L−1。摇瓶五周结束后,取0.1 mL 的富集液涂布于含300 mg·L−1辛硫磷原液的基础培养基SMM 平板中,放置恒温培养箱中30 ℃培养3 d 后挑取透明圈最大的3 株降解菌,分离纯化后挑取单菌落转接于含5 mL 液体LB 的灭菌试管中摇床30 ℃、150 r·min−1培养6 h 生长至对数生长期做为种子培养液,备用。取上述各种子培养液1 mL 转接于含300 mg·L−1辛硫磷原液的液体SMM 培养基中,摇床30 ℃、150 r·min−1液体摇培5 d 后选取降解效果最好的菌株,以只接300 mg·L−1辛硫磷原液的液体SMM 培养基为CK,每处理3 个重复。取降解效果最好的菌株再次在含300 mg·L−1辛硫磷原液的基础培养基SMM 平板上分离纯化后保存备用。
1.5 菌株的鉴定
菌株D39 形态及生理生化特征鉴定: 以划线分离法在LB 平板上划出菌株D39 单菌落,在显微镜下观察D39 采用结晶紫染色后的菌体细胞形态特征,生化活性测定参照常见细菌鉴定手册[12]进行。
菌株16S rDNA 基因的克隆及序列比对:提取D39 的基因组DNA 作为模板,进行16S rDNA 基因的扩增。一对引物分别为,正向引物:5′-AGAGT TTGATCCTGGCTCAG-3′,反向引物:5′-TACGGCTA CCTTGTTACGACTT-3′;25 μL 体系为:模板1 μL,引物(1 mmol·L−1)各1 μL,Mix 12.5 μL,超纯水9.5 μL。聚 合 酶 链 式 反 应 条 件:94 ℃,5 min;94 ℃,30 s;52.3 ℃,45 s;72 ℃,1.5 min;循 环30 次,72 ℃延伸10 min。采用PCR 回收试剂盒回收16S rDNA的基因片段,琼脂糖凝胶电泳检测扩增产物的大小(1.5 kb 左右)后,将其TA 克隆后进行测序(由上海生工测序公司完成)。测序结果通过在线分析(http//:www.ncbi.nlm.nih.gov),与GenBank 中的16S rDNA 基因序列进行相似性比较。
1.6 D39 降解活性的定位
D39 接入LB 液体培养基中过夜培养后5 000 r·min−1离心10 min,分别收集离心得到的菌体和上清。用无菌牙签分别蘸取菌体和上清于含有300 mg·L−1辛硫磷的SMM 平板上,置于恒温培养箱30 ℃培养,每天观察平板有无透明圈出现。
将培养好的菌株用低温冷冻离心机在15 ℃、8 000 r·min−1离心10 min,收集离心得到的菌体。将菌体用20 mL、pH 为9.0 的0.05 mol·L−1磷 酸 盐 缓 冲 液(Na2HPO4-NaH2PO4)洗涤,然后再以8 000 r·min−1离心10 min 收集菌体,按菌体∶缓冲液=3∶1 的量加入少量缓冲液置于冰浴中用超声波细胞粉碎机处理10 次,每次1 min,以8 000 r·min−1离心10 min,除去细胞碎片,得胞内粗酶液。
将胞内粗酶液和上清中的胞外粗酶液分别接入含有300 mg· L−1辛硫磷的SMM 平板上,放于恒温培养箱30 ℃培养,每天观察平板有无透明圈出现。
1.7 HPLC 检测D39 胞内酶对麸皮上辛硫磷的降解作用
(1)样品制备
室内先将辛硫磷均匀拌入麸皮,使辛硫磷在麸皮中的含量为300 mg·kg−1,等麸皮阴干后再将胞内粗酶液喷雾加入含辛硫磷的麸皮,麸皮中酶液浓度为0.1 mg·kg−1,在温度为25 ℃的条件下,反应11 h。在胞内粗酶液喷雾加入麸皮后的2、4、6、8、10、11 h 分别取样用HPLC 法测辛硫磷的降解率。以不喷酶液的含药麸皮为对照,试验设3 次重复。辛硫磷原药用乙腈稀释成0.25、0.50、1.00、2.00、4.00 μg·mL−1五个质量浓度,进样量10 μL,用于制作辛硫磷标准曲线。
(2)样品提取和净化
取上述制备好的麦麸样品2 g 于50 mL 离心管中经无水硫酸钠脱水后,加入乙腈20 mL,于200 r·min−1下摇床高速振荡1 h,再于6 000 r·min−1下离心5 min,移取上层乙腈相10 mL,经氮吹至近干,待净化。待净化样品中加入5 mL 二氯甲烷,剧烈振荡后静置分层,弃去上层乙腈相,下层二氯甲烷经无水硫酸钠脱水后,取1 mL 于微量离心管中,氮气吹干后加入1 mL 甲醇溶解(色谱纯),用0.45 μm 有机滤膜过滤后,待测。
(3)色谱分析条件
高效液相色谱法[13−14]测定条件如下,流动相为甲醇∶水 = 80∶20,流速为1 mL·min−1,进样量为 10 μL,色谱柱:TC-C18 色谱柱,5 μm,250 mm × 4.6 mm,可变波长检测器的工作波长为230 nm,采用外标法定量,试验设3 次重复。
1.8 菌株D39 对供试菌株的拮抗性能测定
采用对峙培养法[15]分别测定降解菌D39 发酵液对白菜黑腐病菌Xanthomonas campestrispv. campestris、玉米弯孢叶斑病菌Curvularia lunata、黄瓜枯萎病菌Fusarium oxysporumf.sp. cucumerinum、苹果轮纹病菌Botryosphaeria dothidea和小麦纹枯病菌Rhizotonia cerealis的抑制作用。D39 发酵液为LB 液体摇培至活菌数为108CFU·mL−1,试验设3 次重复。
2 结果与分析
2.1 菌株的分离
含300 mg.L−1辛硫磷原液的基础培养基SMM 平板30 ℃培养3 d 后,从图1 可以看出透明圈较大的3 株降解菌为25、26 和39。上述3 株菌培养至对数生 长 期 后 转 接 于 含300 mg·L−1辛 硫 磷 原 液 的 液 体SMM 培养基中,摇床30 ℃、150 r·min−1液体摇培5 d后的效果见图2。从图2 中明显能看出来含39、25和26 三株菌的三角瓶内的培养液和对照CK 相比乳白色明显变浅,其中含39 的培养液已经完全澄清透明,说明菌株39 的降解效果最好。

图 1 各菌株在基础盐培养基上产生的水解圈Fig. 1 Hydrolytic halos generated by bacteria on mineral salt medium with phoxim as sole carbon source

图 2 3 株菌(39、25、26)对液体SMM 中辛硫磷的降解Fig. 2 Degradation of phoxim in liquid SMM by bacterialstrains 39, 25 and 26
最终选取39 号菌为高效降解菌进行后述试验,将其命名为D39。将D39 在含辛硫磷的基础盐培养基SMM 平板上分离纯化(图3)后4 ℃和−80 ℃分别保存备用。

图 3 菌株D39 在基础盐培养基上产生的水解圈Fig. 3 Hydrolytic halos generated by D39 on mineral salt medium with phoxim as sole carbon source
D39 结晶紫染色后,显微镜检表明该细菌菌株为革兰氏阴性,菌落呈圆形,乳白色,有凸起,边缘平整,形态饱满,光滑湿润,细胞呈短杆状(图4),无芽胞。

图 4 D39 的显微形态Fig. 4 Microscopic morphology of D39
2.2 菌株的鉴定
菌株D39 的生理生化特性为: 接触酶反应为阳性,V~P 反应、甲基红反应、硝酸盐还原反应、吲哚试验、柠檬酸盐利用试验均为阴性,革兰氏染色显阴性。
以菌株D39 的基因组DNA 为模板,用细菌16S rDNA 通用引物进行PCR 扩增,琼脂糖电泳结果显示有1 条特异性目的片段,大小1 500 bp 左右(图5)。回收该片段送上海生工测序,测序结果表明菌株D39 的16S rDNA 核苷酸序列全长为1 439 bp,将该序列提交GenBank,序列号为MT912949。测序结果通过在线分析(http : www.ncbi.nlm.nih.gov),与GenBank中的16S rDNA 基因序列进行相似性比较,发现菌株D39 的 序 列 与Delftiasp.的16S rDNA 序 列 同 源 性 为99%。结合生理生化特征鉴定该菌株D39为戴尔福特菌属(Delftiasp.)。

图 5 16S rDNA PCR 产物电泳图Fig. 5 16S rDNA PCR product of D39
2.3 D39 降解活性的定位
D39 液体摇培离心后的上清和菌体分别进行降解活性检测,从图6-A 中可以看出菌株D39 的降解活性部位在菌体部分。点接菌体部位原本白色的培养基,因培养基中的辛硫磷已经被菌体降解掉而变为透明。而接种上清液的部位,培养基依然为白色,即上清液对辛硫磷没有降解作用,说明起降解作用的是菌体的胞内酶,而不是上清液中的胞外酶。进一步提取D39 的胞内粗酶液,将胞内粗酶液和上清中的胞外酶再次接入含药平板内检测降解活性(图6-B)。从图6-B 中可以看出有降解活性的是胞内酶,而胞外酶没有降解活性。
2.4 D39 胞内酶对麸皮上辛硫磷的降解作用
辛硫磷标准曲线见图7。从图7 中可以看出以辛硫磷的浓度为横坐标,紫外吸收峰面积为纵坐标绘制的标准曲线,在相对应的质量浓度范围内,呈现出良好的线性关系。辛硫磷的标准曲线和相关系数分别为y=911.05x−3.0448,R2=1,呈极显著相关。

注:A 为D39 降解活性定位,B 为酶活部位检测Note: A: activities of bacteria and supernatant; B: activities of endoenzymes and extracellular enzyme
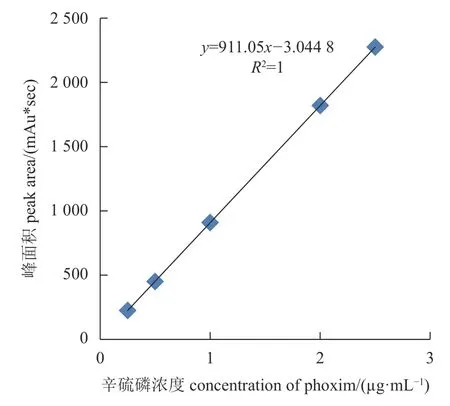
图 7 辛硫磷标准曲线Fig. 7 Standard curve of phoxim
胞内粗酶液喷雾加入麸皮后在2 、4 、6 、8 、10 、11 h 分别取样测辛硫磷的降解率。从图8 中可以看出随着时间的增加,辛硫磷的降解率越来越高,11 h 后胞内酶液对麸皮上辛硫磷的降解率最高,为100%。为了进一步确认11 h 后胞内酶液对麸皮上辛硫磷的降解率,进行了HPLC 检测(HPLC 图谱见图9),从图9 中的对照CK 图谱中能看出辛硫磷的出峰时间为4.361 min,而胞内酶降解辛硫磷11 h 后的HPLC 图谱在4.361 min 没有任何物质峰出现,辛硫磷已经被完全降解掉,降解率100%。

图 8 D39 的胞内酶对麸皮上辛硫磷的降解作用Fig. 8 Phoxim degradation on wheat bran by endoenzyme from D39
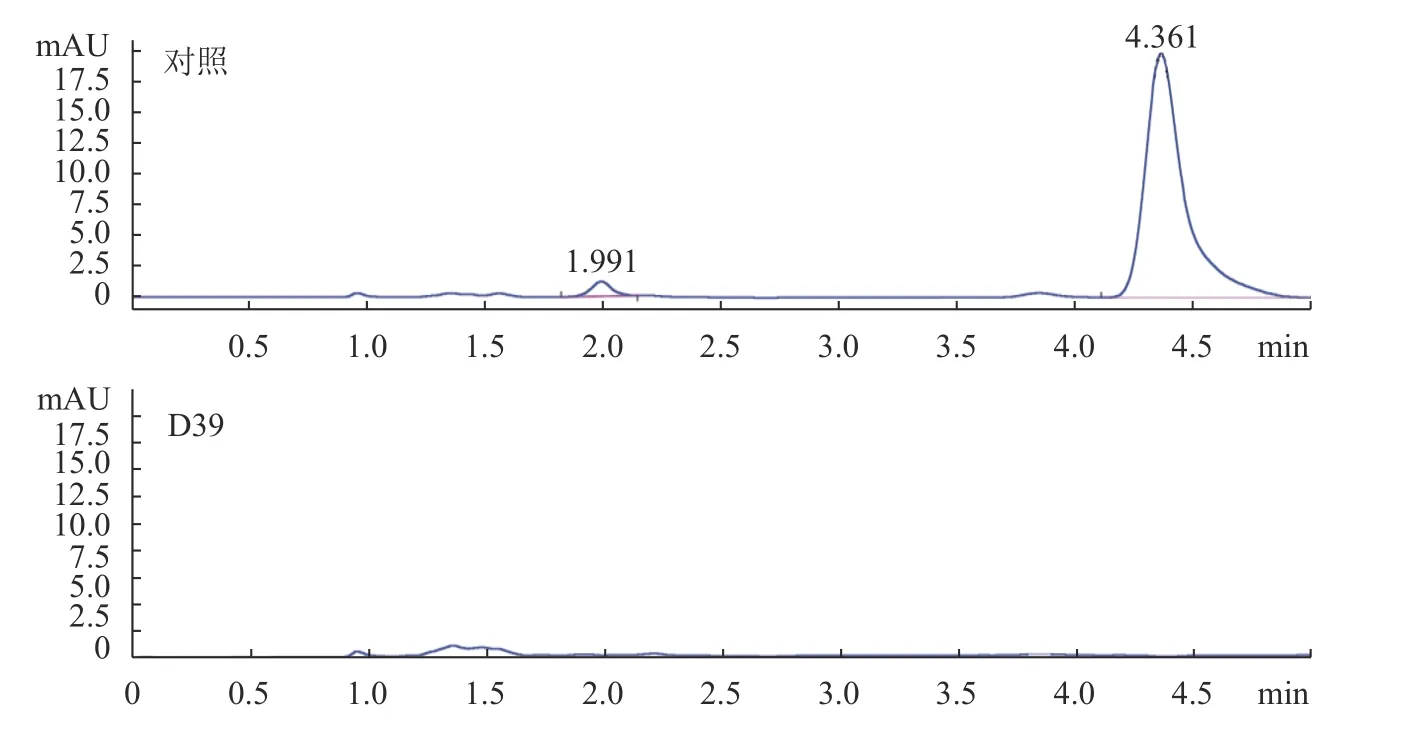
图 9 胞内酶及对照11 h 对麸皮上辛硫磷降解的HPLC 图谱Fig. 9 HPLC chromatograms of phoxim degradations on wheat bran by endoenzyme from D39 and by CK
2.5 降解菌D39 对病害的拮抗作用
菌株D39 对5 种病原菌的抑制作用结果见表1。从平板对峙培养5 d 后的结果中可以看出菌株D39 对各个病原菌均有一定的拮抗作用,各处理之间的差异性显著。其中菌株D39 对小麦纹枯病菌的抑制效果最好,平均抑菌率为50.00%;对玉米弯孢叶斑病菌的平均抑制率最低,为21.05%。

表 1 菌株D39 对植物病原菌的抑菌作用Table 1 Inhibition activities of D39 on phytopathogens
3 讨论与结论
通过富集培养法从山东菏泽农田土壤中分离到一株辛硫磷降解菌,采用传统的生理生化鉴定方法结合现代分子生物学技术,进行D39 的16S rDNA序列分析与属种间的生理生化测定,最终确定D39 为戴尔福特菌属Delftiasp.的1 个新菌株。2007年沈雨佳[8]也报道了1 株辛硫磷降解菌XSP-1 为戴尔福特菌属,该菌株中没有质粒,推测降解基因可能定位在染色体上。本研究中的D39 菌株全基因组完成图中表明,D39 存在两个质粒,其辛硫磷降解基因存在于其中一个质粒上(另文报道)。迄今为止,戴尔福特菌属已发现了2 株辛硫磷降解菌。
采用对峙培养法分别测定降解菌D39 发酵液对白菜黑腐病菌、玉米弯孢叶斑病菌、黄瓜枯萎病菌、苹果轮纹病菌和小麦纹枯病菌的抑制作用,结果表明降解菌D39 发酵液对4 种病原菌均具有一定的抑制作用,其中对小麦纹枯病抑菌效果最好,对峙培养5 d 后平均抑菌率为50.00%。单一功能的降解菌在农业生产上不易推广,兼具防病作用的降解菌不但拓宽了降解菌D39 的应用范围,也更加实用。
考虑到辛硫磷残留在粮仓、饲料等农副产品中无法直接用菌液的问题,对降解菌的降解活性进行定位,并进行胞内粗酶液的提取和粗酶液对麸皮辛硫磷残留的降解试验。试验结果表明,胞内粗酶液在作用了11 h 后,经HPLC 法检测对麸皮上300 mg·kg−1辛硫磷的降解率为100%。目前我国食品中农药最大残留限量(GB2763—2016)的标准中辛硫磷的最大残留限量:水果、稻类、麦类中均为0.05 mg·kg−1,蔬菜中除大蒜、结球甘蓝、普通白菜为0.1 mg·kg−1外,其余均为0.05 mg·kg−1。D39 的胞内酶能快速降解食品和蔬菜中的各种辛硫磷残留,未来采用酶降解粮食和农副产品中的辛硫磷残留也更加安全,本研究为降解菌D39 以后进一步的实际应用奠定理论基础。
