药用植物根际细菌群落多样性驱动因素分析
2020-12-16李毳刘怡刘晋仙
李毳,刘怡,刘晋仙
1.山西财经大学资源环境学院,山西 太原 030006;2.山西大学黄土高原研究所,山西 太原 030006
植物根际是土壤-植物生态系统物质交换的活跃界面,生物种类和数量繁多,被认为是地球上最复杂的生态系统之一。植物与其根际微生物群落的关系是近年来生态学领域研究的一个热点问题(尹华军等,2018)。活跃的根际微生物被喻为植物的第二套基因组,在植物的生长发育过程中发挥着关键作用。植物-土壤微生物的相互作用对植物的生长、种间和种内的竞争优势产生一定的影响(王茜等,2015),植物根际微生物群落具有高度的物种特异性(Pendergast et al.,2013)。那么,是植物决定了其特定的根际微生物群落,还是土壤微生物决定地上植物群落特征?是近年来群落生态学领域期待回答的科学问题。植物与土壤微生物的相互作用改变植物根际和叶际的化学特征,通过叶际和根系分泌物影响植物与植物之间的竞争关系。植物作为微生物碳源的提供者,对土壤微生物群落具有重要的影响(Badri et al.,2009)。另一方面,土壤微生物通过养分循环,为根系提供有效养分,影响根系的生长、代谢和化学特征,提高植物的抗性和生长活力(Eisenhauer et al.,2012)。药用植物根茎叶中的各类代谢物或次生代谢物是中药药理的主要成分,植物的根际和叶际微生物可能对这些代谢物的产生有一定的促进或抑制作用,而这些物质也可能对微生物群落产生影响。因此,研究中药材植物根际微生物群落的特征和形成机制,以及植物与微生物群落的特异性关系,有助于揭示药用植物药理和道地性的形成机制。
本研究选取山西省广泛分布的党参(Codonopsis pilosula)、柴胡(Bupleurum chinense)和远志(Polygala tenuifolia)3种野生道地药材为研究对象,探讨其根际土壤细菌群落的结构与多样性及其驱动因子。
1 材料和方法
1.1 研究区域和采样点的设置
山西是全国道地药材重要产区之一,有着丰富的中药材资源。在查阅资料和实地调查的基础上,选取太行山腹地的长治市武乡县石圪垤村为研究样地,地理坐标为 113°60′E,36°44′N。2018 年 5 月12日,在地表植被基本均匀的沟坡草丛或灌草丛中,选择5年左右株龄、长势基本一致的野生党参、柴胡和远志,每种采集3株,间距大于100 m,共9株。根据 Courchesne根际区土壤取样方法(Courchesne et al.,1997),沿药材基部挖取健康根系,抖落根部附着的疏松土壤,留下与根系结合紧密的、大约附着根系1 mm左右的土壤,密封于无菌塑料袋,置车载冰箱保存。带回实验室后,将每个物种的3个根际土混合均匀,将土样中可见的土壤动物及植物残体过0.2 mm筛去除。样品一部分风干处理,用于测定土壤理化性质,一部分提取土壤微生物基因组DNA,用于高通量测序。
1.2 土壤理化性质测定
用vario MACRO cube(Germany)元素分析仪测定土壤全碳(TC)、全氮(TN)、全硫(TS);用CleverChem 380间断化学分析仪测定土壤硝态氮(NO3-N)、亚硝态氮(NO2--N)、铵态氮(NH4+-N);用2.5∶1的水土比电极法测定土壤pH值,用烘干法测定土壤含水率。脲酶活性的测定采用苯酚钠-次氯酸钠比色法,其活性以37 ℃下培养24 h后1 g土壤产生的NH3+-N的mg数表示;蔗糖酶活性测定采用3, 5-二硝基水杨酸比色法,其活性以37 ℃培养24 h后1 g土壤产生的葡萄糖的mg数表示;过氧化氢酶活性采用KMnO4滴定法,其活性以20 min内每g土壤分解的过氧化氢的mg数表示。
1.3 土壤细菌群落分析
每种药材的土壤样品取 3个,每个样品称取 5 g,送至北京百迈客生物科技有限公司进行高通量测序(Illumina MiSeq)。用引物 338F(ACTCCTACGGGAGGCAGCAG)和 806R(GGACTACHVGGGTWTCTAAT)扩增细菌核糖体16S RNA基因的v3—v4高变区,以97%的序列相似性,鉴定细菌的操作分类单元(operational taxonomic units,OTUs),用于细菌群落结构和多样性分析。
1.4 数据分析
利用单因素方差分析(SPSS 23.0 One-way analysis)和多重比较,分析样地间土壤理化变量间的显著性差异(P<0.05)。利用 Mothur(version v.1.30)软件,计算样品的Alpha多样性指数,包括Shannon多样性指数、Simpson优势度指数、ACE指数、Chao1指数、Coverage指数。利用 R语言 V 3.5.1进行相关性分析、冗余分析、方差分解及零模型分析。
2 结果与分析
2.1 土壤理化性质分析
远志、柴胡、党参3种植物根际土壤理化性质的分析结果如图1所示,土壤酸碱度、总碳、总硫、土壤粒度、脲酶和蔗糖酶活性在不同植物的根际土间差异显著,而土壤含水率、总氮、铵态氮、硝态氮、过氧化氢酶活性的差异不显著。所有土壤样品均呈弱碱性(pH>7),党参根际土的 pH 值最大(7.80)。柴胡根际土中总氮、总硫和总碳均为最大,分别为 0.13、0.051、2.91 mg·kg-1。土壤脲酶和蔗糖酶在3个土壤样品间差异显著,柴胡根际土中的脲酶活性最高,为6.54 mg·(g·24 h)-1,而蔗糖酶活性最低,为8.64 mg·(g·24 h)-1;党参根际土中脲酶活性最低,为0.55 mg·(g·24 h)-1,蔗糖酶活性最高为11.40 mg·(g·24 h)-1。
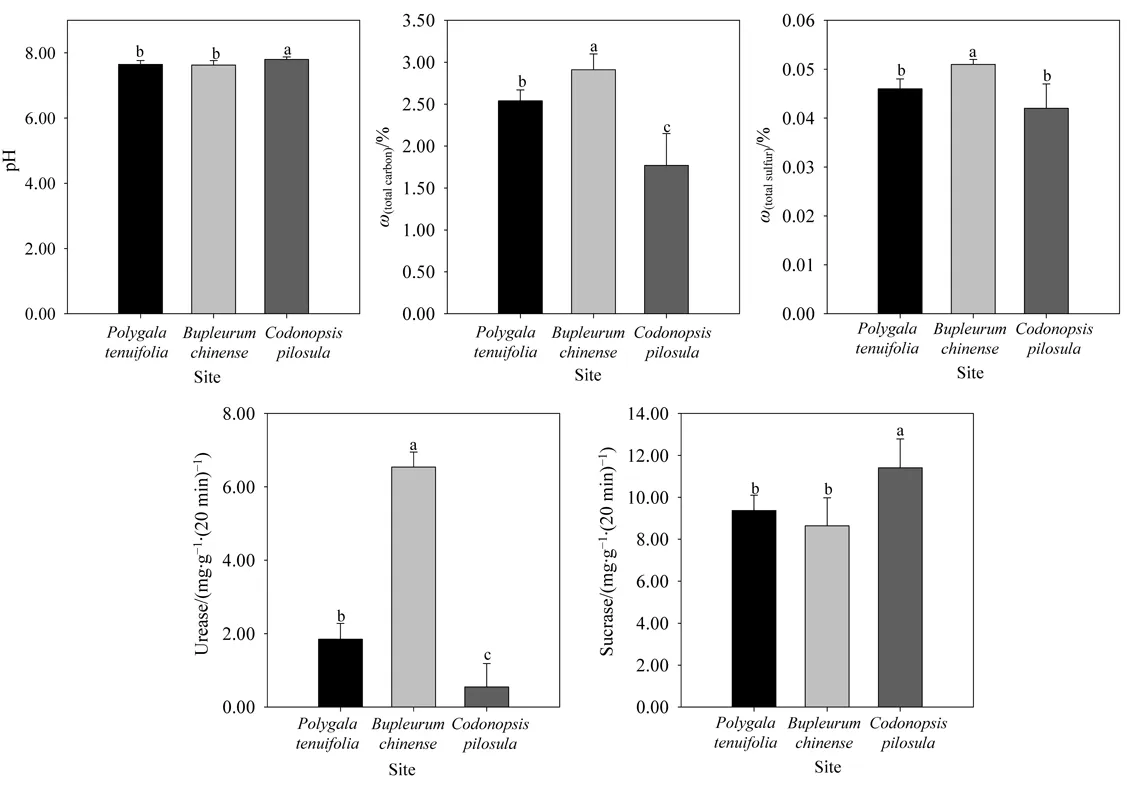
图1 远志、柴胡、党参植物根际土壤环境因子Fig. 1 Edaphic factors of rhizosphere of P. tenuifolia, B. Chinense and C. pilosula
2.2 细菌群落组成及多样性
在97%的相似度水平下,鉴定得到了3种植物土壤样品中细菌的OTU个数,对OTU代表序列进行聚类和物种注释,共检测出细菌有 27个门、80个纲、127个目、215个科、296个属和223个种,可见,该区植物根际细菌群落具有较高的多样性。其中,土壤优势细菌门组成如图2所示,包括变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)和Saccharibacteria门。在3种植物根际土中,变形菌门均为第一优势类群,其相对丰度在远志、党参、柴胡根际土中分别达到32.37%、37.61%和30.64%。酸杆菌门在柴胡根际相对丰度最大,为26.43%。放线菌门在远志根际相对丰度最大,为27.17%;在党参根际相对丰度最小10.67%。硝化螺旋菌在党参根际较多,而酸杆菌门、绿弯菌门、浮霉菌门等在 3种植物根际差异不大。

图2 门水平上的细菌组成Fig. 2 Classification of bacterial sequencing at level of phylum
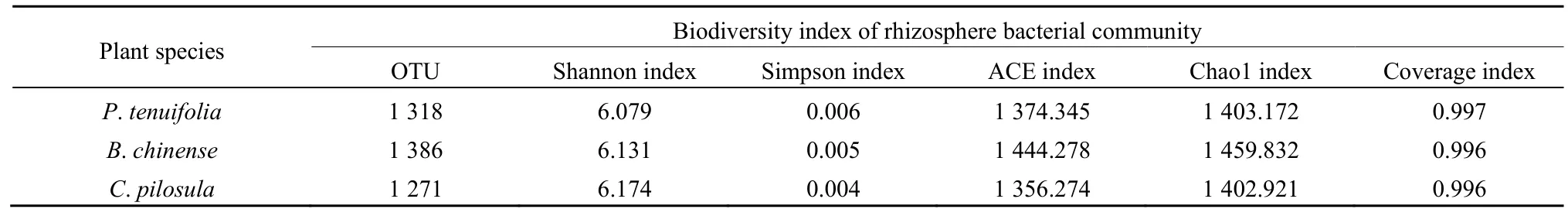
表1 3种药材根际土壤细菌群落多样性Table 1 Diversity of bacteria communities of three species rhizosphere
3种药材植物根际土壤细菌群落α多样性分析结果见表1。其中党参根际细菌群落 Shannon指数最大(6.174),Simpson指数最小(0.004),可见党参根际细菌群落多样性最高,而均匀度较低。远志的 Shannon指数最小(6.079),Simpson指数最大(0.006),说明远志根际细菌群落的多样性较低,而均匀度较高。柴胡的ACE指数和Chao1指数最大,表明其根际细菌群落中种类数目最多;党参根际细菌群落的ACE和Chao1指数最低。
2.3 环境因子对土壤细菌群落的影响
在不同的生境中,影响微生物群落结构和多样性的环境因子有一定的差异。本研究利用Spearman方法分析了土壤环境因子和根际细菌α多样性指数的相关性(表2),结果表明根际土壤含水率与细菌群落Shannon指数呈显著正相关,pH与Simpson指数呈显著负相关,TN与ACE指数呈正相关,脲酶活性与ACE指数呈显著正相关、与Coverage指数呈正相关,蔗糖酶活性与Coverage指数呈负相关,过氧化氢酶活性与Chao1指数、Simpson指数呈正相关。
运用Spearman分析和RDA进一步筛选细菌群落构建的主要驱动因子,由图3可见,土壤总氮、脲酶活性与硝化螺旋菌门的丰度呈显著负相关;总碳、过氧化氢酶活性、总氮与绿弯菌门的丰度呈负相关;pH与硝化螺旋菌门、浮霉菌门的丰度呈正相关;过氧化氢酶与芽单胞菌门的丰度呈显著负相关,总硫、亚硝态氮与根际土壤优势菌门的丰度相关性不显著。RDA1和RDA2两轴共解释了59.2%的变异率,通过前选择筛选出影响微生物群落的环境因子是pH、总氮、脲酶活性、过氧化氢酶活性和蔗糖酶活性(图4)。
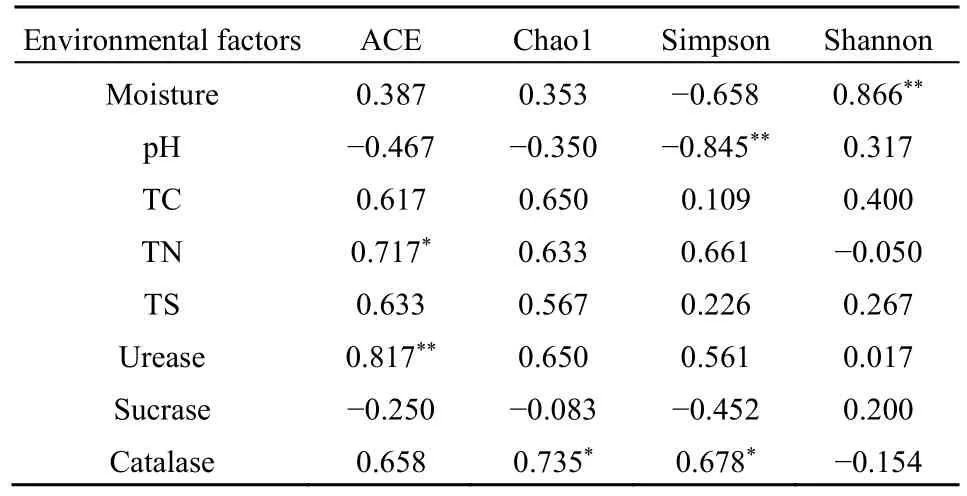
表2 环境因子与多样性指数的Spearman相关分析Table 2 Spearman correlation analysis of environmental factors and diversity index
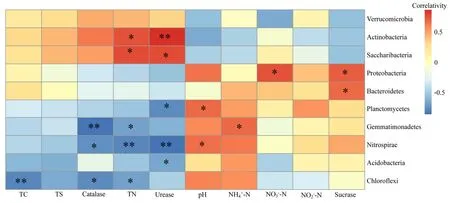
图3 前10门细菌与环境因子相关分析Fig. 3 Correlation analysis between the top 10 bacteria and environmental factors
2.4 细菌群落结构驱动因素分析
利用方差分解分析土壤环境因子与植物对土壤细菌群落结构的影响作用(图5),结果表明,土壤因子、植物单独对细菌群落结构动态影响的解释分别为 0.02、0.08,土壤因子与植被类型共同解释部分为0.60。由此可见,土壤环境因子与植物的交互作用对细菌群落结构动态具有重要作用。
利用Tucker et al.(2016)提出的零模型中零偏差值的大小来区分群落构建过程中受确定性过程和随机性过程的相对大小。零偏差值大,受确定性过程较大;零偏差值小,受随机过程较大。本研究结果中零偏差值均大于0(图6),表明研究区土壤细菌群落构建的驱动因素中确定性过程占主导作用。
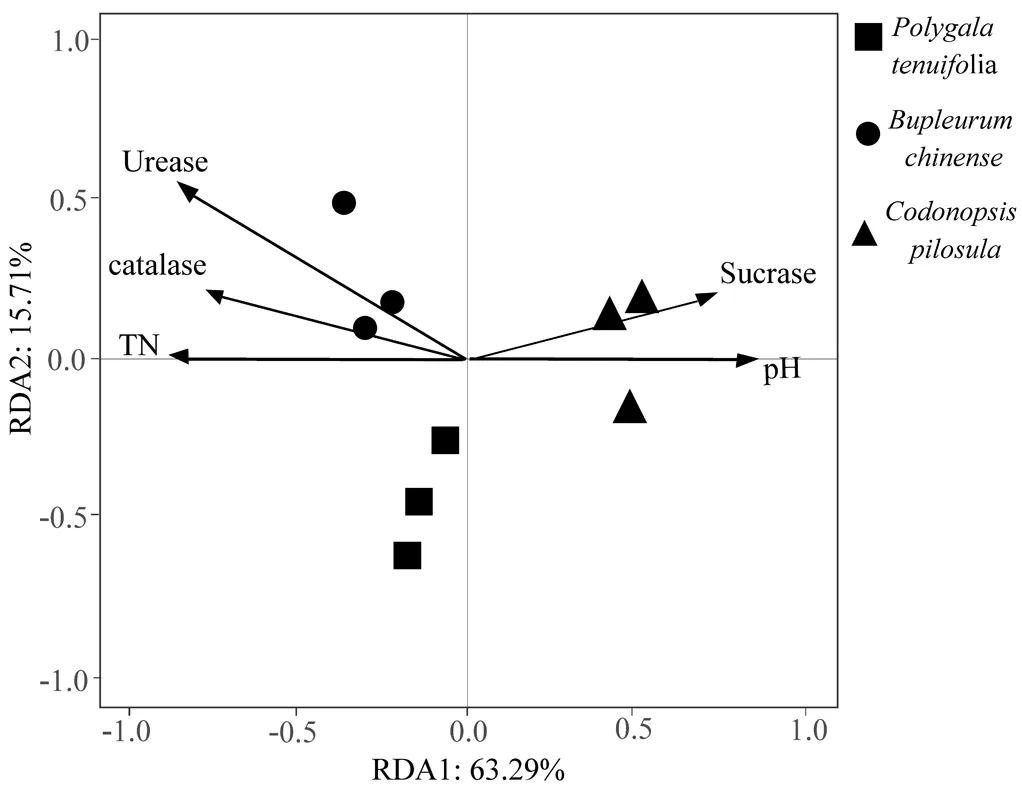
图4 细菌群落(OTU水平)与环境因子的冗余分析Fig. 4 Redundancy analysis(RDA)of bacterial community(OTU level) and environmental factors

图5 方差分解分析土壤环境因子和植物类型对真菌群落影响相对大小Fig. 5 Variation partitioning analysis showing the percentages of variance in bacteria communities explained by soil environmentfactor and medicine plant type

图6 细菌群落在不同样地的零模型Fig. 6 Null model of the bacteria community across the plots
3 讨论
微生物作为地球物质化学循环的主要驱动者,在植物-土壤系统中发挥重要作用。环境因子通过影响微生物群落的结构和多样性,进而影响微生物群落在环境中的功能,反过来,微生物群落对土壤环境因子产生重要影响,二者相互作用,驱动了植物-土壤系统的健康运行。本研究中,3种植物根际土壤理化性质的差异主要表现在土壤酸碱度、脲酶、蔗糖酶、总碳和总硫,主要是由于这些因子受植物根际的影响更为明显,如根系分泌物对土壤酸碱性、土壤酶和总碳具有重要的影响(Bais et al.,2006),导致这些因子在不同植物根际土壤中的差异性。
3种药材根际土壤优势细菌类群主要有变形菌门(30.64%—37.61%)、放线菌门(10.67%—27.17%)、拟杆菌门(4.72%—6.70%),多为参与分解有机质的类群。本研究发现由这些细菌类群为优势类群形成的根际土壤微生物群落结构与土壤的pH、总氮、脲酶、过氧化氢酶、蔗糖酶具有显著的相关性,说明植物根际土壤环境因子对细菌群落结构具有重要的影响(Lauber et al.,2009;乔沙沙等,2017)。这些因子对根际真菌群落的结构也具有重要的影响(李毳等,2019)。Siles et al.(2016)的研究发现,土壤pH与土壤细菌丰富度无显著相关性,但是与细菌群落的物种多样性显著相关。土壤酶是由微生物或植物根系分泌产生的胞外酶,用于水解或氧化降解土壤中相应的有机物,其活性与土壤性质、土壤类型等环境条件密切相关,其中脲酶、过氧化氢酶对环境变化更为敏感(Liang et al.,2003;Nottingham et al.,2016;Liu et al.,2017)。土壤细菌群落的丰富度指数与土壤脲酶活性显著正相关,均匀度指数与土壤蔗糖酶活性显著正相关(马转转等,2018)。土壤含水率对细菌群落组成也具有显著影响(Menezes et al.,2016),本研究土壤含水率与细菌Shannon指数呈显著正相关。氮是微生物代谢必需的元素,对微生物的生长具有重要的影响,但不同的微生物类群对氮的响应有一定的差异。Ramirez et al.(2012)对28个不同生态环境的土壤添加无机氮,发现施氮可以显著增加放线菌的相对丰度,但降低了酸杆菌的相对丰度。本研究中的土壤总氮与放线菌的丰度呈正相关,与酸杆菌的丰度呈负相关,说明不同细菌类群对氮的响应不同。
植物对其根际微生物群落的“选择”主要是通过根系分泌物来实现的(Singh et al.,2004)。根际环境中,细菌群落对各种根分泌物的利用率和敏感性远远超过放线菌、真菌、藻类和原生动物等,它们在根际微生物中最为活跃并占主导地位,与植物根系共生共存。植物根际分泌物中丰富的糖类、氨基酸及维生素等对土壤微生物的种类、数量及分布具有显著的影响(Chaudhary et al.,2016)。本研究认为,植物类型是根际土壤细菌群落结构和多样性的主要驱动因子之一。但是,关于植物种对其根际微生物群落结构驱动作用,尚无一致的观点。Nunan et al.(2005)利用DGGE方法研究草地根际土壤细菌群落与植物种的关系时,发现植物种对于细菌群落的影响远远小于土壤环境因子。也有一些研究表明植物对土壤微生物群落结构的作用大于土壤理化因子(Germida et al.,1998)。植物种和土壤环境因子对土壤微生物群落结构影响程度可能是由于它们作用的相对“强度”不同,同时也与土壤微生物的特性有关,r-型菌易受环境条件的影响,变化较大,k-型菌则变化不明显(王光华等,2006)。
植物-土壤-微生物的相互作用是维持物种多样性的重要驱动力(Reynolds et al.,2003)。本研究中土壤环境因子和植物类型的交互作用共同解释了 3种药用植物根际土壤微生物群落构建的 60%。Tucker et al.(2016)指出,零模型的零偏差值可以代表群落的相似性比期望值更加相似(负值),或更加相异(正值)。由于零模型是分析观测值相似性偏离期望值相似性的程度((βobs-βnull)/βnull)。本研究结果中的零偏差值在各个样地都是正值,进一步说明土壤环境因子是植物根际细菌群落构建的主要驱动因子。
总之,3种药用植物根际土壤理化性质具有显著差异,植物根际分泌物可能是造成这种差异的主要原因。根际土壤酸碱度、脲酶、蔗糖酶、总碳和总硫差异导致根际细菌群落结构和多样性的显著差异,而细菌群落的差异对土壤营养的有效性产生影响,最终,形成特定的植物-土壤-微生物系统,为道地药材植物的生长提供了适宜的生境。
