陆地-海洋生态系统微塑料污染现状研究
2020-12-16邵媛媛张帆梁庆霞
邵媛媛,张帆,梁庆霞
山东建筑大学市政与环境工程学院,山东 济南 250101
塑料制品自发明以来,被人类生产生活广泛利用,带来便利的同时,因其自身难降解、分布广等特点,在环境中连续污染的问题日益突出。目前,在海洋(Cózar et al.,2014),偏远湖泊(Eriksson et al.,2003;Imhof et al.,2013;Free et al.,2014)甚至是一些人烟稀少的地方,如北极(Barnes et al.,2009;Barneset al.,2010)都发现存在高浓度的塑料垃圾。微塑料(粒径<5 mm)的直接排泄和塑料垃圾的降解产生的微小塑料颗粒,都成为环境中MPS(microplastics,MPS)的主要来源。MPS在自然环境下,可进一步降解为纳米级的纳米塑料(Jambeck et al.,2015)。MPS尺寸较小,极易被各种生物吞食进入食物网,近年来报道显示,MPS会沿着食物链层层积累,最终在高等生物(如鱼类、贝类和海鸟等)内富集,甚至存在于海盐中(Yang et al.,2015)。因此,MPS很可能已经出现在人类食物中,随着饮食进入到人体内。由于食物链中MPS的研究资料较为有限,目前对MPS的毒理学研究主要集中在以模式生物体为主的毒理学研究。本文综述了近年来 MPS来源、生物毒性效应研究进展以及监测方法,旨在为生物安全性评价及潜在毒性研究提供有价值的参考。
1 微塑料颗粒的来源及迁移
1.1 微塑料的来源及分类
环境中微塑料的来源比较复杂,可分为初生微塑料和次生微塑料两大类。初生微塑料的来源主要包括塑料/树脂颗粒的工业原料、含有微塑料颗粒或清洁微珠的工业化产品,例如药物、抛光料、个人护理品(化妆品、洗面奶、牙膏和沐浴露)等(Napper et al.,2015)。由于其粒径小、密度低等原因不易从污水中分离去除,而随尾水排放进入到水环境中。Rochman et al.(2015)的研究发现,在美国每日有8万亿个塑料微珠进入到水体中。城镇、旅游、农业及工业区塑料垃圾的不当处置、船舶运输、水产养殖、捕鱼等过程会对水环境造成一定程度的塑料污染(Mcdevitt et al.,2017)。塑料进入水体后,经过物理(磨损、水体扰动、波浪击打、风力)、化学(紫外光辐射、冻融循环)和生物过程(降解)发生破裂、分解或体积减小而形成微小的塑料碎片,称为次生微塑料此外,人工合成纤维纺织品洗涤过程中产生的塑料微粒纤维也是次生微塑料的重要来源(Hernandez et al.,2017)。
近年来,塑料制品在全世界人类生产生活活动中的比重不断提高,产量逐年增加。作为一种人造产品,MPS主要来源于生活垃圾的降解和生活污水的排放,其主要组成成分为聚乙烯(High Density Polyethylene)、聚丙烯(polypropylene)、聚苯乙烯(Polystyrene)、聚氯乙烯(Polyvinyl chloride)、聚乳酸(polylactide,polylactic acid)及聚对苯二甲酸乙二酯(polyethylene glycol terephthalate)等聚合物(图 1)。中国塑料制品产值逐年增长,在全球塑料制品总产值中占有较大比重(图1)。2018年中国塑料制品行业在工业结构调整、转型中不断发展,保持快速开展势态,产销量均为全球首位,占比24.8%。
1.2 陆地-海洋环境中微塑料的迁移
陆地环境中MPS的主要来源包括污泥利用、农业生产所用的塑料制品、MPS污染的灌溉用水以及大气降沉等(Esperanza et al., 2016;Rodriguez-Seijo et al.,2016;Steinmetz et al.,2016)。日化制品中(面部清洁剂、磨砂膏、牙膏和洗涤剂)添加的MPS颗粒、工业生产中(塑料制品的制备、空气爆破产生的塑料树脂粉末或颗粒)释放的塑料以及纤维织物在清洗过程中脱落下来的微小塑料纤维是也其重要来源(Thompson et al.,2004;Fendall et al.,2009;Eriksen et al.,2013)。这些塑料在污水处理厂处理时,部分会进入污泥中,这些污泥被用作肥料或者修复材料时,会导致大量塑料进入陆地环境中。有研究报道,由于污泥的使用,一些欧洲农业土壤中 MPS含量高达 1000—4000 pieces·kg-1土(Zubris et al.,2005)。塑料薄膜在农业(特别是设施农业)中的广泛应用也是陆地环境中塑料污染的一个重要来源(Ramos et al.,2015)。Dris et al.(2016)发现巴黎市区的大气降沉中含有人造纤维,这也证明了大气降沉也是陆地环境中MPS污染的一个来源。
海洋环境中 MPS的来源主要有陆源的输入、滨海旅游业、航运业、海洋养殖业、渔业以及大气沉降等(Browne et al.,2011;Cole et al.,2011;Sun et al.,2016)。陆源的输入是海洋环境中MPS最主要的来源,目前,据估计,全球海洋中塑料垃圾陆源约占80%(Zhang et al.,2016)。由于MPS颗粒尺寸较小,进入污水处理系统不同来源的 MPS(日常使用的护肤品和化妆品、工业废物和纺织纤维脱落)很难有效将其过滤去除,最终导致大量的MPS颗粒被排放到海洋环境中(Vance et al.,2015)。陆源的另外一个输入途径是含有 MPS的土壤通过侵蚀或流失进入海洋环境(Horton et al.,2017)。沿海旅游业和航运业导致大量的塑料产品和废弃物进入海滩或海洋中,这也是海洋塑料污染增加的另一重要原因。根据联合国环境规划署(UNEP)2005年估算,全球航运中约有5000×104t塑料废物流入海洋环境当中。
与陆地环境相比,高分子聚合物在海洋环境高盐度、光热及微生物的作用下,非常容易降解成细小的塑料碎片,已成为MPS的重要来源(Lambert et al.,2014)。MPS在环境中的迁移,主要来源包括污水处理厂的尾水排放、水环境中塑料垃圾的风化降解以及水土流失或地表径流形成的陆源输入;其他输入包括个人护理品、合成纺织品、工业原料以及城镇、农业、旅游、工业区塑料垃圾的不当处置(图 2)。另外,MPS会对生物造成物理性损伤和生化水平胁迫,并有可能与其他污染物形成复合污染,产生交互效应。
2 海洋生态系统污染现状
2.1 海洋微塑料分布规律

图1 塑料制品的主要组成分布及2018年全球各地区塑料制品产值比重Fig. 1 The main composition and distribution of plastic products and each area plastic products output value proportion in 2018
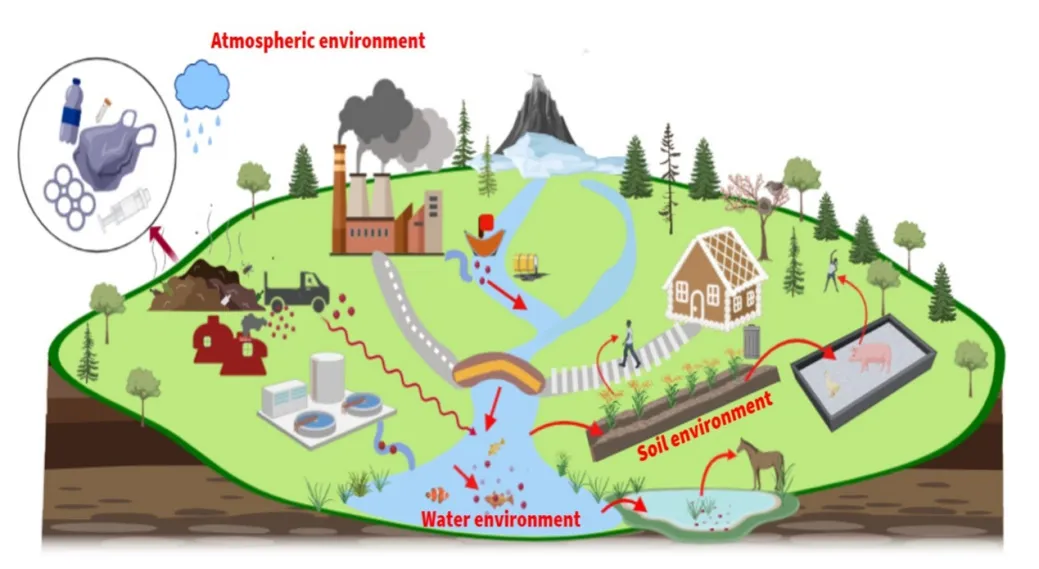
图2 微塑料在陆地海洋环境中的迁移转化Fig. 2 Migration and transformation of MPS in terrestrial and marine environments
目前,全球有关微塑性污染分布的报告主要集中在河口和沿海水域,由于这些地域受到人类活动的频繁干扰和受污染陆源河流的输送,MPS污染状况较为严重(表 1)。可见,在亚洲、欧洲其污染状况最为严重,如韩国洛东江河口雨季前后沉积物中的 MPS丰度分别达 8205 pieces·m-2和 27606 pieces·m-2(Lee et al.,2013),欧洲地中海沉积物中的 MPS 丰度达 350 pieces·L-1(Woodall et al.,2014),这可能与此区域高人口密度、塑料垃圾产量较大有关。
中国 MPS污染的特点在丰度上表现为沿海滩涂、潮坪沉积物中MPS丰度和河口水体中MPS丰度较高。中国南海万宁沙滩MPS丰度最高达8714 pieces·kg-1(Qiu et al.,2015);长江口水体 MPS丰度达 (4.137±2.462) pieces·L-1,而远离长江口的MPS丰度要小若干个数量级,如中国东海与渤海水体 MPS 丰 度 分 别 为 (0.000167±0.000138)pieces·L-1(Zhao et al.,2014)和 (0.00033±0.00034)pieces·L-1(Zhang et al.,2017a),与北大西洋离岸水域MPS丰度0.00043—0.00223 pieces·L-1处于同级(Moore et al.,2005)。从粒径大小看,0.5—1 mm的微塑料较为常见(Zhou et al.,2015),如闽江口、椒江口和瓯江口0.5—2 mm的MPS即占70%以上(Zhao et al.,2015b)。
2.2 微塑料对海洋生物的毒性效应
MPS的生物毒性效应与其材料类型、粒径和暴露剂量等密切相关,本文将从 MPS对生物体的存活率、生长发育、行为活动、生殖状况、基因表达等方面的影响分析。
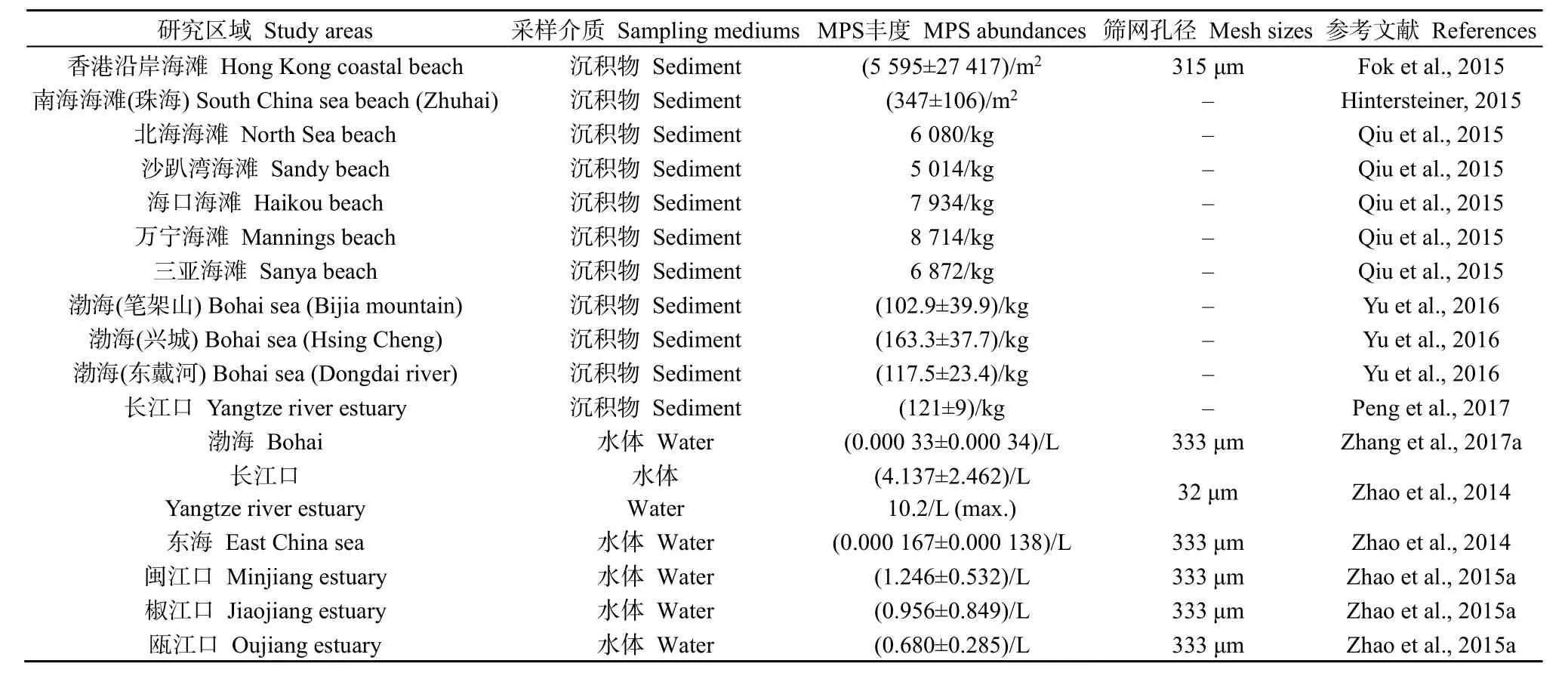
表1 中国海洋微塑料污染状况Table 1 Distribution of MPS in the investigated areas in China
2.2.1 海洋动物
目前,国内外已开展了 MPS对少量海洋动物毒理作用研究,包括对精卵发生、存活率、生长发育、行为、组织损伤、炎症反应、代谢、生殖和基因表达等的影响。
(1)MPS影响海洋动物精卵发生过程。研究发现,青鳉雄鱼(Oryzias latipes)暴露于 8 μg·L-1PE(<1 mm)微粒中两个月,雄鱼Chg H基因、雌鱼Vtg I、Chg H和ERα基因(鱼类生殖基因)的表达均显著下调(Lu et al.,2016)。这表明,塑料碎片形成的复合物具有雌激素抵抗性,此外,精母细胞和精原细胞异常增殖并发现少量卵细胞。尽管存在随机变异的可能性,但由于青鳉是雌雄异体鱼种,自然逆转概率极低,因此极有可能是 MPS暴露引起的(Rochman et al.,2014)。
(2)MPS暴露导致海洋动物存活率降低。Mazurais et al.(2015)研究发现,挪威舌齿鲈仔鱼随PE暴露剂量(10—100 pieces·mg-1)增加,其死亡率显著增加,认为死亡与 MPS导致幼鱼排泄受限有关。
MPS摄入会影响海洋动物的生长发育。如斑马鱼仔鱼(zebrafish)受精后 5 d暴露在 1.5×1013 pieces·L-1PS后其体长显著减少了 6.1%(Chen et al.,2017)。Critchell et al.(2018)发现在急性暴露1周后,多刺棘光鳃鲷稚鱼(3.5 cm)的生长随PET暴露浓度(0—0.86 mg·L-1)的增加而下降。
(3)MPS引起组织损伤与炎症反应。Pedà et al.(2016)发现挪威舌齿鲈健康成鱼暴露在0.1% PVC后30 d,与对照组相比,67%的个体肠道组织出现中度损伤,表现为固有层增宽、绒毛缩短肿胀、肠细胞空泡化、绒毛顶端杯状细胞增多等,暴露90 d后,约 50%的单个肠道组织严重损伤,浆膜层和黏膜肌层呈水肿状,血管扩张显著,白细胞浸润,表明慢性MPS暴露会引起肠道组织损伤和炎症反应。健康成年斑马鱼暴露在1.0 mg·L-1PA、PE、PP和PVC 10 d后,73.3%—86.7%的个体出现明显的肠道损伤,具体表现为绒毛破裂和肠细胞分裂(Lei et al.,2018)。健康成年斑马鱼暴露在2000 μg·L-1PS荧光微球(5 μm,70 nm)3周后,肝细胞切片与对照组相比,出现明显坏死、空泡化和脂滴,表明5 μm和纳米级MPS会引起肝脏炎症与脂质积聚。
(4)影响海洋生物功能代谢。健康成年斑马鱼暴露在 2000 μg·L-1PS 荧光微球(5 μm,70 nm)3周后,代谢组分析表明,随着PS荧光微球暴露剂量的增加,肝脏脂肪酸含量显著增加,氨基酸含量明显下降,结果显示,MPS暴露可能影响海洋动物的脂质与能量代谢(Lu et al.,2016)。
(5)影响海洋动物的基因表达,潜在内分泌干扰物。挪威舌齿鲈仔鱼暴露在 10—100 pieces·mg-1PE(10—45 μm)45 d 后,其 Cyp1a1基因(硬骨鱼类生物毒性转化的关键基因)表达水平明显上升(Mazurais et al.,2015)。
2.2.2 海洋植物
海洋植物主要包括单细胞微藻和大型海藻、海带(Saccharina japonica)、龙须菜(Gracilaria lemaneiformis)、孔石莼(Ulva pertusa)等,它们是海洋环境的初级生产者,利用叶绿素进行光合作用产生有机质,在海洋生态系统中物质循环和能量流动中起重要作用。这些处于海洋食物链最底层的生物受到干扰,会导致营养、食物和捕食平衡的变化,对高等物种间接产生“自下而上”的影响。研究显示,海洋微藻个体微小(5—50 mm),MPS难以直接进入藻细胞内,在目前的环境浓度水平(约0.5 mg·L-1)下,MPS不会影响到海洋微藻的生长和光合作用,只有在非常高的质量浓度(10—250 mg·L-1)下才会有明显的毒性效应(Zhang et al.,2017b),表现为光合色素含量及光合效率下降,其毒性机制包括机械损伤(细胞壁损伤、细胞完整性受损等)和氧化损伤(由 MPS中的单体、添加剂及其吸附的污染物释放而产生的毒性)等(Xia et al.,2015)。
3 陆地生态系统微塑料污染现状
与海洋相比,陆地土壤中的微塑料污染更加严重,甚至已经危及到我们所赖以生存的大气。
3.1 对土壤生物的影响
目前,关于MPS对土壤动物影响的研究较少,现用于研究的土壤动物包括蚯蚓(Pheretima)(Rillig et al.,2017;Rodriguez-Seijo et al.,2017)、线虫(Scottnema)(Kiyama et al.,2012)及弹尾虫(Maa et al.,2017)。在研究其对土壤动物影响时,可借鉴对海洋生态系统动物影响的相关研究。来源于水域生态系统的土壤动物,如滤食性动物生活在土壤表面的薄层水膜中,环节动物门、软体动物、节肢动物及线虫等动物发现既存在于淡水和海洋生态系统中,也生存于土壤中,这些存在于不同生态系统但属于同一门类的土壤动物有相似的食性(Browne et al.,2011),因此,MPS对海洋生物的影响部分可适用于土壤动物(Yang et al.,2015)。
MPS对生物体的影响取决于其浓度。蚯蚓分布广泛,对土壤污染胁迫比较敏感,常作为土壤质量的指示者,被推荐为国际生态毒理学标准中的受试物种之一。研究发现不同浓度MPS(PE<150 μm)对蚯蚓的生长率及丰度的影响,当PE浓度达到60%时,死亡率最高,生长率为负值,与对照及低浓度相比,高浓度PE(28%和45%)均对其死亡率及生长率产生不利影响(Esperanza et al.,2016;Rodriguez-Seijo et al.,2016)。Cao et al.(2017)研究了不同浓度MPS(PS,58 μm)对蚯蚓的影响,发现低浓度 MPS[<0.5% (m·m-1)]对其丰度影响不大,而高浓度(1%和2%)显著抑制其生长并增加其死亡率。Rodriguez-Seijo et al.(2017)研究不同浓度MPS对蚯蚓的毒性效应,MPS采用PE颗粒,粒径范围为250—1000 μm,每100 mg MPS平均颗粒数为 (396±52)(STDEV),虽然不同浓度 MPS颗粒对E. Andrei的毒性作用不同,存活、数量以及28 d实验周期后其质量的影响并不明显,但对其肠道病理检测结果显示,在 MPS浓度>125 mg·kg-1时,会引起明显的组织损伤,不同浓度的 MPS也会刺激不同程度的免疫应答。
MPS对动物的影响也与动物自身的生理、行为特性有关,这种影响在海洋生态系统的研究中已得到了广泛证明(Auta et al.,2017a;Vendel et al.,2017)。以 MPS为食的海洋生物分布于广泛的营养级层次,具有不同的取食策略,包括食碎屑动物、滤食性动物和捕食者(Browne et al.,2011)。滤食性动物容易积累毒性,在水生生态系统中作为营养模式的典型范例。MPS在低营养水平生物中积累(Browne et al.,2008;Farrell et al.,2013),直接影响土壤关键动物物种,从而影响食物网。中小型区系土壤动物,如弹尾类动物或蚯蚓食入MPS,将其积累在土壤碎屑食物网中。蚯蚓将土壤圈与大气圈联系起来,沟通了土壤生物同陆地生物之间的联系,獾、鸟类等以蚯蚓为食,因此积累在蚯蚓体内的 MPS通过食物链在不同物种间传递,从而影响其他土壤动物(Van et al.,2014;Watts et al.,2014)。线虫在自然状态下以微生物为食,实验室条件下以大肠杆菌为食。Kiyama et al.(2012)研究表明,在食物稀缺的状态下,0.5 μm和1 μm的PS颗粒更易于积累于线虫(Caenorhab-ditis elegans)体内,当细菌与线虫的比例为 1∶100或 1∶10时,粒径为 0.5 μm的PS颗粒的积累量明显减少,这可能与线虫的取食策略有关。
MPS能吸附土壤溶液及其周围土壤环境中的重金属、有机污染物和病原菌。动物以作为污染物载体的 MPS为食后,污染物的毒性效应会对动物生理产生影响,从而通过食物链(网)的积累对土壤生态系统构成威胁。MPS的停留时间也对其毒性有一定影响,停留越长,其致毒作用越明显。随着时间的增加,受气候(如风化、光照等)作用影响,其表面性质会发生改变,对污染物的吸附能力增强,从而增加其毒性。环境因子对 MPS的作用还包括将其自身有毒物质淋溶至土壤中(Schultz et al.,2015;Syberg et al.,2015),淋溶至土壤内部的有毒污染物,会对土壤动物产生直接影响。
3.2 对土壤微生物群落的影响
在海洋塑料污染方面,Jin et al.(2018)长期定位研究表明,塑料覆膜显著提高玉米秸秆的降解,提高土壤有机碳的积累。Sun et al.(2017)研究设施栽培土壤中表面活性剂和微塑料污染对土壤细菌和噬菌体相关的抗生素抗性基因的影响,发现这种影响还没有明确的规律性。塑料污染是如何驱动抗性基因的传播也缺乏机理性的研究,需要深入的探讨。Qian et al.(2018)近期的研究显示,覆膜塑料的残留可以显著降低土壤中碳氮循环相关基因的表达,从而降低土壤碳氮含量,影响土壤肥力。
塑料的化学成分在塑料降解过程中释放,从而造成土壤污染,其中比较典型的是邻苯二甲酸酯。Kong et al.(2018)研究表明,随着土壤中二丁基邻苯二甲酸酯含量的提高,土壤微生物多样性下降。Wang et al.(2018)研究了土壤中二甲基邻苯二甲酸酯污染对黑土中微生物功能的影响,他们发现这类污染物增加了土壤中一些功能基因,包括信号传导基因和与二甲基邻苯二甲酸酯降解有关的一些基因的表达,并认为这些基因表达的增加可能导致土壤中碳氮循环的加快,可能不利于黑土肥力的维持。
3.3 对土壤物质循环的影响
由于 MPS难降解,可以长久留存于土壤中,一旦积累至一定浓度,对土壤乃至陆地生态系统功能及生物多样性会产生影响(Rillig,2012)。Liu et al.(2017)研究两种浓度梯度 MPS(PP<180 μm)对土壤中 DOC、DON、DOP及 PO3-浓度和 FDA水解酶、酚氧化酶活性的影响,在加入 MPS的第30天,低浓度的MPS对DOM中的有机碳、无机氮、总磷、高分子量的腐殖质类物质及富里酸的影响很小,而高浓度 MPS显著增加了 DOM 中的DOC、DON、DOP、PO3-、NO-、高分子量的腐殖质类物质及富里酸。MPS可以吸附土壤溶液中有害物质,改变土壤物理性质,如增加孔隙度、改变团粒结构或成为土壤团聚体的一部分等而起作用(Rillig,2012;Huerta et al.,2017;Huerta et al.,2016),而这些变化可以改变微生物活性(Arthur et al.,2012;Naveed et al.,2016)。酶活性作为微生物活性及营养物质可利用性的代表,在土壤物质循环中起到重要作用,微生物活动的增强,使得胞外酶分泌增加,对土壤 C、N、P等营养元素的释放起到推动作用,从而促进营养元素在植物-土壤间的迁移(Liu et al.,2017;Burns et al.,2013)。
土壤动物对土壤生态系统的物质循环有极其重要的作用(Barnes et al.,2009),MPS也可能通过对土壤物种多样性的作用,影响土壤物质循环。在土壤动物对微塑料的食入排出过程中,随排泄物排入土壤的MPS,既可以为其他生物所摄食,也可能被降解(Roy et al.,2011),从而对土壤初级和次级生产力、有机质降解以及养分循环产生影响。
4 微塑料对饮用水体的污染
MPS污染在河流、湖泊等淡水水体中普遍存在,比海洋生态系统污染更加严重。淡水水体中检测到的MPS丰度可达107pieces·km-1量级,比海洋环境中检测到的丰度更高(Zhang et al.,2015)。淡水环境中检出的MPS呈现出不同的形状、大小、颜色特征,同时具有多样的化学组成并可能携带其他污染物。
2017年,Orb Media发布了一项饮用水中MPS的研究报告,研究者采集分析了全球14个国家159个饮用水样品,发现83%的样品中含有MPS。其中,美国有 94%的饮用水样品中其平均丰度为 9.6 pieces·L-1;欧洲有 72%的样品中其平均丰度为 3.8 pieces·L-1。另一项关于瓶装水中 MPS的研究则是对全球9个国家19个地区11种不同品牌的259瓶瓶装水中的MPS进行了检测,发现其中242瓶瓶装水中存在MPS,其平均丰度为325 pieces·L-1,最大丰度达到10000 pieces·L-1,其中95%的MPS尺寸分布在 6.5—100 μm(Masons et al.,2018)。这两项报告虽然没有经过同行评议,但仍引起了公众的广泛关注。世界卫生组织(WHO)、美国环保署(USEPA)及欧洲国家都启动了对饮用水中MPS的相关研究。Obmann et al.(2018)调查了德国21种品牌矿泉水中的MPS分布,在32个矿泉水样品中都检出了 MPS。其中,次性 PET瓶装矿泉水中其个数为 (2649±2857) pieces·L-1;可重复使用的 PET瓶装矿泉水中其个数约 (4889±5432) pieces·L-1;玻璃瓶装矿泉水中其个数为 (3074±2531) pieces·L-1。PET瓶中检出的MPS约95%小于5 μm 50%小于1.5 μm;玻璃瓶中检出的其约15%为5—10 μm,约7%大于 10 μm。
5 微塑料检测方法
目前,用于检测 MPS的分析方法主要有显微计数法、拉曼光谱、傅里叶红外光谱扫描电子显微镜法(ATR-FTIR)、裂解气相色谱—质谱法、液相色谱法(表2)。
5.1 显微计数法
显微计数法在显微镜下直接对样品中的 MPS进行计数(Derraik,2002;Noren,2007),其操作简便、分析成本低,但不能识别 MPS种类。ATR-FTIR利用塑料的特异性红外光谱对其进行识别(Kaiser et al.,2014;Song et al.,2014),可有效分析大于500 μm的微塑料,FTIR红外光谱可对20 μm以上的小颗粒微塑料进行分析,其方法可靠、可快速有效识别不同的 MPS种类,配合新的自动图像分析系统可在短时间内对大量样品进行快速分析。但FTIR法只适用于分析有红外光谱的MPS,不适用于分析不透明和粒径<20 μm的MPS。显微拉曼(MLRM)是利用塑料的特征拉曼光谱对其进行识别(Cole et al.,2013;Collard et al.,2015),可分析>1 μm的MPS,是目前唯一能有效分析1—20 μm MPS的技术。MLRM技术可以分析不透明和黑色的MPS颗粒,自动化的MLRM系统可以对大量样品进行快速分析。同时也存在一些不足,有些生物、有机或无机颗粒会对其分析造成干扰,因此,使用MLRM技术时需要对这些杂质加以去除。
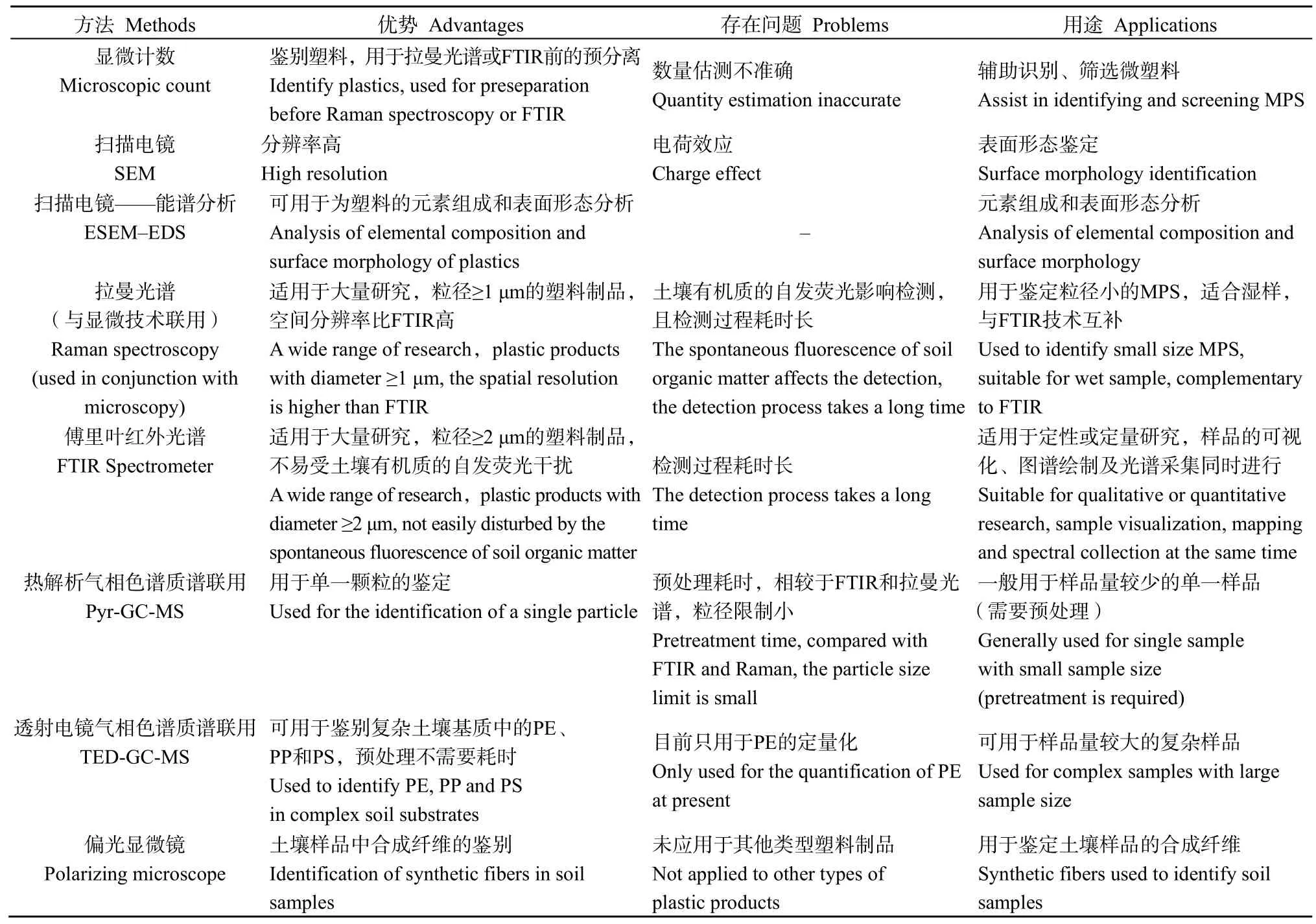
表2 各种微塑料检测技术在微塑料污染检测中的应用现状Table 2 Detection techniques of MPS
5.2 裂解气相色谱-质谱法
裂解气相色谱-质谱法对裂解后微塑料样品进行气相色谱-质谱分析,通过获得的谱图与已知塑料的谱图比对来识别分析 MPS种类并进行定量分析(Fabbri et al.,2000;Fabbri,2001)。该方法适合于分析>500 μm的MPS颗粒,同时还可对一些塑料添加剂进行分析,灵敏度高、可靠性强,但一次只能分析一个塑料颗粒。
5.3 液相色谱法
液相色谱法是将MPS样品溶解于有机溶剂后,利用尺寸排阻色谱对微塑料的分子量分布进行分析,通过与标准品比对来确定其类型(Hintersteiner,2015;Elert et al.,2017)。该方法对某些MPS具有较高选择性,但不适用于分析有机溶剂中难溶解的MPS。
6 微塑料颗粒污染的降解方法
随着MPS数量不断增加,所带来的环境和生态风险日益引起全球关注。2014年首届联合国环境大会将海洋塑料垃圾污染列为近10年最值得关注的十大紧迫环境问题之一。2015年第二届联合国环境大会进一步将以塑料微珠为主的MPS污染列为环境与生态科学研究领域的第二大科学问题,表明其与全球气候变化、臭氧层破坏等全球重大环境问题同等重要。2018年,联合国环境规划署(UNEP)将世界环境日的主题确定为“塑战速决”,呼吁世界各国共同对抗一次性塑料污染问题。这种国际形势为减少或消除微MPS污染创作了有利的外部条件。
主要对策有三方面:一是通过法律手段限制MPS在工业生产(特别是生活用品)中的使用;二是通过教育,使全社会关注 MPS的污染危害,自觉减少塑料和MPS的使用;三是在MPS污染严重的区域实施微生物修复技术加以消除。
6.1 海洋中微塑料的去除
通过生物降解消除海洋中 MPS是一类环境友好且有应用前景的方法。某些微生物(细菌、真菌等)可将有机物作为碳源和能源并将其降解为二氧化碳和水(巢维等,2005)。据报道,土壤中分离出的葡萄球菌(Staphylococcus aureus)、假单胞菌(Pseudomonas aeruginosa)和芽孢杆菌(bacillus)能够降解 PE(Nowak et al.,2011),黑曲霉(Aspergillus niger)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌能够降解PET(Asmita et al.,2015),赤红球菌(Rhodococcus ruber)能够降解PS(Mor et al.,2008);聚氯乙烯能被恶臭假单胞菌降解(Danko et al.,2004);而波茨坦短芽孢杆菌(Brevibacillus brevis)、链霉菌(Streptomyces coelicolor)、施氏假单胞菌(Pseudomonas stutzeri)和粪产碱杆菌(Alcaligenes faecalis)则能产生降解塑料聚合物的胞外酶(Auta et al.,2017b)。需要注意的是,这些微生物大多属于淡水物种,其是否适应高盐海洋环境尚未可知,而且有关微生物对其降解目前只是处于室内研究阶段。为将生物修复技术成功应用于 MPS污染海域,应注重从海洋环境中筛选分离高效降解菌,并对使用条件进行优化,确定其合理高效的海上修复方法。
6.2 土壤中微塑料的去除
通过“筛分-分选-移除有机质及其他土壤成分-提取微塑料”去除土壤中MPS。筛分是利用筛子使土壤中小于筛孔的细粒物料透过筛面,而大于筛孔的粗粒物料留在筛面上,完成粗、细粒物料分离的过程。根据 MPS不同粒径的定义,在分析样品时土壤筛选范围为<5 mm和<1 mm。筛分后,利用密度分离法可将土壤矿质相移除。聚钨酸钠溶液通常用于土壤不同组分的分离,它不仅可以分离游离态颗粒有机物(fPOM),还可以分选SOM中不同的土壤有机矿质复合体(Christensen,1996)。但此法尚未应用于MPS的分离。由于SOM中有机矿质复合体的分选与 MPS留存于土壤团聚体中的程度有关,因此在使用密度分离法前,可以采用超声处理法先打碎团聚体,对于不同粒径的土壤团聚体,使用不同的超声能量,例如,在分散粒径>250 μm的土壤团聚体时,通常使用的超声能量值为 60 J·mL-1(Kaiser et al.,2014)。
由于密度介于1.0—1.4 g·cm-3的有机质与部分塑料制品如PET密度相似,因此密度分离法不足以去除全部有机质。为了保证 MPS辨识及量化的可靠性,需要采用酸、碱、氧化或酶处理,以去除残留有机质,或使用静电分离法去除有机碎屑(Hidalgo et al.,2012)。Avio et al.(2015)使用浓度为 22.5 mol·L-1的 HNO3对样品进行预处理,Dehaut et al.(2016)对6种预处理方法进行了比较,分别为:浓度为 10% KOH,0.063 mol·L-1HCl,14.4 mol·L-1HNO3,14.4 mol·L-1HNO3和 14.4 mol·L-1HClO3按照体积比 4∶1混合,浓度为 10 mol·L-1NaOH,0.27 mol·L-1K2S2O8和 0.24 mol·L-1NaOH混合液,研究结果表明,10% KOH,60 ℃消解24 h效果最佳。Cole et al.(2015)用不同浓度的酸、碱及酶对样品进行消解,比较了浓度分别为 1、2 mol·L-1及 10 mol·L-1NaOH 和浓度分别为 1、2 mol·L-1HCl以及蛋白酶K的消解效果,研究结果表明,蛋白酶K对有机质的去除率大于97%,且不分解MPS。Mintenig et al.(2017)采用酶消解法对样品进行预处理,在加入十二烷基硫酸钠后,依次加入蛋白酶A-01(1800 U·L-1溶于pH9 PBS)、脂肪酶 FE-01(2320 U·L-1溶于 pH 10.5 PBS)以及纤维素酶 TXL(44 U·L-1溶于 pH5 PBS)。Nuelle et al.(2014)将样品分别放置于30% H2O2和35% H2O2溶液中处理7 d,显示35% H2O2的预处理效果更好。
6.3 饮用水中微塑料的去除
饮用水中 MPS指在进入净水厂进行水处理中出现的微小颗粒,需根据物理化学特性,将其进行分类并判断化学组成和结构。根据 MPS粒径小、难降解等性质确定出相关的处理方法,首先在传统给水处理工艺的基础上对 MPS的去除展开研究,可有两种处理方法(王华成等,2005):(1)以采用光催化氧化类方法与生物法组合工艺;(2)以利用强化混凝与微滤或超滤组合工艺。其次需要检测给水厂进水中的 MPS污染颗粒,其鉴别及成分鉴定可采用FTIR和拉曼光谱法。最后MPS去除的实验方案选定,在传统给水处理工艺的基础上,可采用紫外线高级氧化与生物活性炭(BAC)组合工艺和强化混凝与微滤或超滤组合工艺(表3)。
7 结论与展望
MPS作为一种水域污染和环境污染的一种新型污染物,综述研究显示,中国被认为是世界上最大的海洋塑料废弃物生产国,每年的排放量132×104—353×104t之间。目前,中国对MPS污染的关注较少,对其所引发的生态问题认识不足。未来在监测及生物降解等方面研究应重点关注应着重于以下几个方面,具体包括:

表3 饮用水中微塑料的去除工艺Table 3 MPS removal process of drinking water
(1)研究制定符合国际标准的MPS样品采集、分析和鉴定方法。研究已经确定的塑料垃圾进入陆地海洋交界的主要河流和河口系统中污染源、程度、类型和水平。建立MPS在陆地-海洋源汇的分析方法以及其对陆地-海洋生态系统和人类健康的风险评估方法。
(2)开展微塑料潜在生态风险评估。通过MPS与关键海洋生物的相互作用,开展环境浓度水平下微塑料的毒性效应及其机理研究,从而了解 MPS污染及与有害化学物质的污染对不同阶段生物体的影响。研发污水处理过程中对 MPS的拦截和降解处理工艺,研发陆地、海洋环境中塑料垃圾的收集处理技术。
(3)应重点关注船舶和沿海河流捕捞活动等产生的塑料废物污染。建议启动对现有相关法律法规的修法程序,对中国现行可能涉及陆地、海洋塑料垃圾和微塑料问题的法律法规条文进行修订和增补,使现有相关法律法规条文针对陆地、海洋塑料垃圾和微塑料的管控更为具体,责任更为明确。建议制定与国际上相适应的环保政策、产业发展政策和国际贸易政策和法律措施。
(4)建立完善的塑料垃圾污染公共环境意识教育体系,唤起公众对陆地、海洋中 MPS污染的关注,激发公众的环保意识,进而改变消费行为,自觉养成垃圾分类的习惯,源头上帮助解决 MPS污染问题。
