菘蓝不定芽途径再生植株研究△
2020-12-16张延红何春雨杜弢孔繁娟陈红刚曾翠云
张延红,何春雨,杜弢,孔繁娟,陈红刚,曾翠云
甘肃中医药大学,甘肃 兰州 730000
菘蓝IsatisindigoticaFort.,又名大青根、北板兰等,为十字花科菘蓝属植物,以根、叶入药。其根在中药上称板蓝根,叶称大青叶,鲜叶或茎叶加工制成的深蓝色粉末称青黛,三者均为常用中药,药性类同,性寒,味苦,具有清热解毒、凉血消肿之功效[1]。板蓝根药用价值不仅在于治病,更重要在于防病,为40种常用大宗药材之一,用量很大,在临床上用途较广,除板蓝根注射液外,常与其他中药组成复方,广泛用于治疗多种疾病,是医药界公认的、具有较好抗病毒效果的中药之一[2-4]。植物组织培养技术可在短期内快速繁殖植物离体组织,具有快速、高效及可控的特点,便于大规模工业化生产,在药用植物的快繁及活性成分的高效提取方面具有得天独厚的优势。利用组织培养对菘蓝进行快速繁殖和高产栽培,对节约耕地,提高产量有重要意义[5-6]。有关菘蓝组织培养已有所报道,如通过子叶、幼叶及子房分化芽都获得成功,但对分化条件及影响因素尚缺乏系统研究[7-10]。不定芽的直接发生途径是不经过愈伤组织阶段直接从芽基部诱导产生芽丛,其再生植株遗传稳定性高、繁殖速率快,是离体快繁的常用途径。本试验以菘蓝无菌苗的下胚轴为外植体,探索了不同激素组合与不同浓度配比及不同pH对菘蓝不定芽诱导的影响,不定芽的继代和生根培养,为菘蓝优良品种的快速繁殖和新品种选育提供参考。
1 材料与方法
1.1 材料
SW-CT-IFD型超净工作台(苏州净化设备有限公司);QHX-300BS-Ⅲ型培养箱(上海新苗医疗器械制造有限公司);LDZX-30FB型高压蒸汽灭菌锅(上海申安医疗器械厂)。
MS粉末(青岛高科园海博生物技术);激动素(KT,天津市凯通化学试剂有限公司,批号:201613)、吲哚乙酸(IAA,上海中泰化学试剂有限公司,批号:2016723)、萘乙酸(NAA,Cooler Science & Technology,批号:CN29163010)、6-苄基腺嘌呤(6-BA,Cooler Science & Technology,批号:CB29152450)、吲哚丁酸(IBA,上海中泰化学试剂有限公司,批号:2016723)、2,4-二氯苯氧乙酸(2,4-D,上海中泰化学试剂有限公司,批号:2013125)、蔗糖(天津大茂化学试剂厂,批号:20190618)、乙醇(天津市大茂化学试剂厂,批号:20190705),氯化汞(HgCl2,天津市大茂化学试剂厂,批号:2018610)、次氯酸钠(NaClO,天津市大茂化学试剂厂,批号:20190601),以上药品试剂均为分析纯。
菘蓝种子采自甘肃中医药大学和政药用植物园,由甘肃中医药大学杜弢教授鉴定为I.indigoticaFort.的种子。
1.2 方法
1.2.1种子灭菌方法选择 挑选生长饱满、无病斑的菘蓝种子,将剥去果皮的菘蓝种子用自来水冲洗,再以蒸馏水冲洗后,用不同的灭菌剂对剥去果皮的菘蓝种子于超净工作台上进行灭菌处理,接种于 1/2 MS+3%蔗糖+0.75%琼脂,pH 5.8的培养基上进行培养,每个处理5瓶,每瓶6~8粒种子,20 ℃光照培养,选取最佳灭菌处理组合。
1.2.2外植体的获得 采用最佳灭菌方法给种子灭菌,待种子发芽长出幼苗(约6 d后),挑选长势良好的无菌苗,以下胚轴为外植体。
1.2.3不同激素种类和浓度配比诱导产生不定芽 以 MS为基本培养基,其中添加3%蔗糖,0.7%琼脂,培养基pH 5.8,研究不同激素浓度配比的KT和IAA、KT和NAA、KT和IBA、BA和IAA、BA和NAA或单独添加2,4-D对不定芽诱导或愈伤组织的影响。
1.2.4不同pH对不定芽诱导的影响 以下胚轴为外植体,以MS+6-BA 1.0 mg·L-1+IAA 0.5 mg·L-1+3%蔗糖+0.7%琼脂为培养基,研究不同pH(5.0、5.4、5.8、6.2、6.6)对菘蓝不定芽诱导的影响。
1.2.5不同激素配比和浓度对不定芽生根的影响 将诱导获得的菘蓝不定芽接种于1/2 MS培养基,附加不同浓度IBA或IBA和IAA配比使用,观察统计生根情况。
1.2.6培养条件和统计指标 每个处理4瓶,每瓶接种3个外植体,培养箱温度25 ℃,光照条件1500~2000 Lux。培养30 d后观察统计不定芽诱导率、叶形、芽高、芽颜色、芽数量、芽增殖系数等指标。
2 结果与分析
2.1 外植体不同灭菌方法比较
由表1可知,HgCl2灭菌效果显著好于NaClO。2%NaClO灭菌 5 min污染率高达 88.40%,灭菌10 min后污染率降至67.52%。0.1%HgCl2灭菌3 min污染率达55.0%,随着灭菌时间的延长污染率降低,灭菌 5 min污染率降低至7.2%。因此,选择0.1%HgCl2灭菌5 min为菘蓝种子最佳灭菌处理。

表1 不同灭菌剂和灭菌时间对菘蓝种子污染率的影响
2.2 不同种类和浓度配比的外源激素对不定芽诱导的影响
2.2.1不同质量浓度 6-BA和IAA配比对不定芽诱导的影响 在不同质量浓度配比的6-BA和IAA培养基中(见表2),6-BA的质量浓度过低(0.5 mg·L-1)时,芽高和芽的诱导率均不高,不定芽的生长势细弱。当6-BA的质量浓度为1.0 mg·L-1时,不定芽增高,生长势健壮,芽的诱导率显著增加。随着6-BA质量浓度的增加(2.0 mg·L-1),芽的诱导率显著降低,芽短小,生长势一般。在1.0 mg·L-16-BA和0.5 mg·L-1IAA的激素配比中芽的诱导率最高为75%,不定芽数量多,芽高1.5 cm,生长势健壮,是适宜的不定芽诱导培养基(见图1)。该培养基可作为继代培养基,进一步考察芽的增殖和生长情况。

表2 不同质量浓度6-BA和IAA配比对菘蓝下胚轴诱导不定芽的影响

图1 胚轴诱导产生少量丛生芽
2.2.2不同质量浓度6-BA和NAA配比对不定芽诱导的影响 由表3可知,在添加不同质量浓度6-BA 和NAA的培养基中,当6-BA质量浓度从0.5 mg·L-1增大到2.0 mg·L-1时,芽的诱导率先增大后减小,表明6-BA质量浓度过高或过低都不利于芽的诱导。当6-BA 1.0 mg ·L-1和NAA 0.5 mg·L-1配比时,诱导出的不定芽显著好于其他处理,芽高1.0 cm,芽诱导率为77.7%,且生长势健壮。因此,该激素处理可作为适宜的不定芽诱导培养基。

表3 不同质量浓度6-BA和NAA配比对菘蓝下胚轴诱导不定芽的影响
2.2.3不同质量浓度KT与IAA配比对菘蓝不定芽诱导的影响 由表4可知,以胚轴为外植体,以MS为基本培养基,添加不同质量浓度KT、IAA,菘蓝下胚轴两端和表面可直接诱导产生不定芽。在IAA质量浓度一定时,高浓度KT不定芽的诱导率与芽数量普遍高于低浓度KT。KT一定时,高浓度IAA不定芽的诱导率普遍高于低浓度IAA的诱导率。高浓度KT处理中不定芽颜色大多呈绿色,芽较高,生长势较好。低浓度KT处理下,不定芽大多呈黄褐色,芽较短,生长势较差。此外,在0.5 mg·L-1KT与0.2 mg·L-1IAA培养基中不定芽有枯死现象。因此,采用高浓度KT与IAA配比更有利于不定芽的诱导和生长,最适质量浓度配比为2.0 mg·L-1KT与0.8 mg·L-1IAA,诱导率达100%。

表4 不同质量浓度KT与IAA配比对菘蓝下胚轴诱导不定芽的影响
2.2.4不同质量浓度KT与NAA配比对菘蓝不定芽诱导的影响 由表5可知,以胚轴为外植体,菘蓝下胚轴切口和表面可直接诱导产生不定芽,高浓度NAA培养基中不定芽的诱导率较低浓度高。高浓度KT培养基中芽较高,多呈淡绿色。低浓度KT,芽较矮,多呈黄绿色。KT 1.0 mg·L-1与NAA 0.8 mg·L-1培养基中虽然芽的诱导率达100%,但芽的生长势一般。总体而言,以胚轴作外植体,KT和NAA不同浓度配比使用,诱导不定芽效果不良。
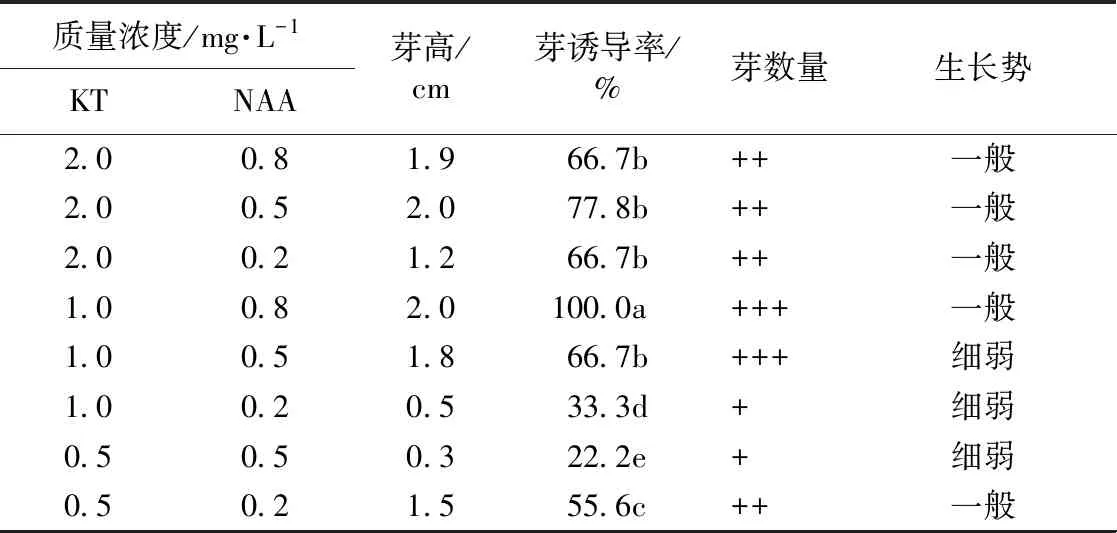
表5 不同质量浓度KT与NAA配比对菘蓝下胚轴不定芽诱导的影响
2.2.5不同质量浓度2,4-D对菘蓝下胚轴愈伤组织诱导的影响 由表6可知,2,4-D对愈伤组织诱导效果比较好,低浓度2,4-D的诱导率比高浓度2,4-D高,且最适诱导质量浓度为1.5 mg·L-1,诱导率最高可达100%。从愈伤组织颜色来看,低浓度2,4-D下呈黄绿色致密状,高浓度2,4-D下呈淡黄色致密状,愈伤部位均在下胚轴切口端(见图2)。

表6 不同质量浓度2,4-D对菘蓝下胚轴愈伤组织的诱导情况

图2 2,4-D诱导胚轴产生愈伤组织
2.3不同pH对诱导菘蓝不定芽诱导的影响
将菘蓝下胚轴培养在不同pH的培养基上,30 d后观察统计(见表7)。pH为5.4时丛生芽生长良好,芽诱导率高,并且叶片舒展,叶缘光滑,pH为6.2和6.6时叶皱缩、叶缘有锯齿、有玻璃化现象,叶片呈水浸状,叶片淡绿色。

表7 不同pH对菘蓝下胚轴不定芽诱导的影响
2.4 不定芽的继代培养
将MS+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1培养基中诱导获得的不定芽,在原培养基中进行继代培养,不定芽增殖系数为5,生长势良好(见图3)。

图3 丛生芽的增殖培养
2.5 生根培养
由表8可知,在培养基中加入不同质量浓度IBA诱导生根,IBA质量浓度高或低均不利于生根,根诱导率显著降低,根和芽的生长势一般或细弱。当IBA的质量浓度为1.0 mg·L-1时,生根率达100%,且平均根长为6.0 cm,根和芽生长势健壮。当IAA质量浓度为2.0 mg·L-1时,随着IBA浓度增加,生根率先增大后减小,其中IAA 2.0 mg·L-1和IBA 1.0 mg·L-1配比使用,生根率达到85.4%,根的生长势健壮,但芽的长势一般。其他处理生根率较低,根和芽的生长势一般。由此可见,1/2 MS+IBA 1.0 mg·L-1是最佳生根培养基(见图4)。
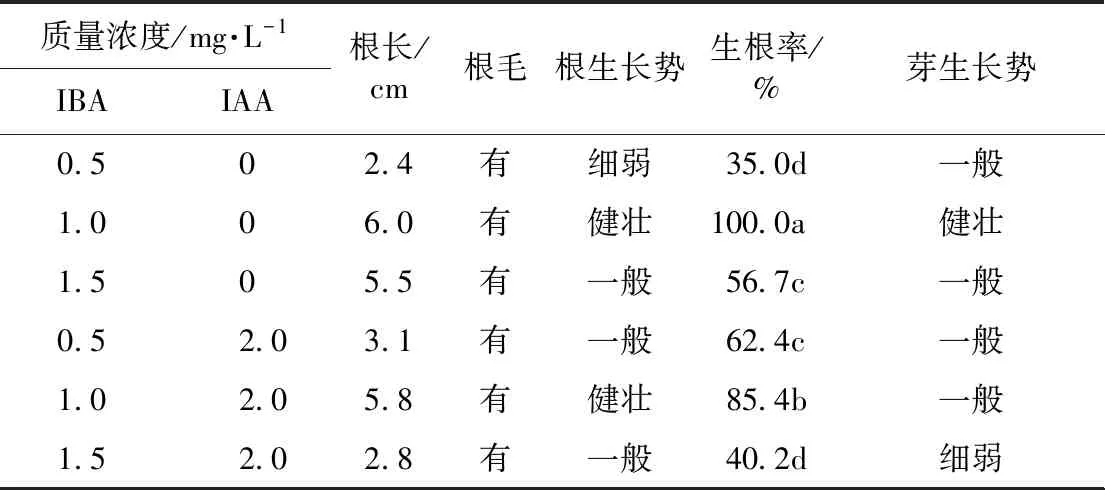
表8 不同种类和质量浓度生长素对菘蓝不定芽生根的影响

图4 生根的试管苗
3 讨论
本研究以胚轴为外植体,通过添加不同种类和浓度的激素组合的培养基,得到了很高的芽诱导率和生根率。胚轴产生不定芽能力很强,可以从胚轴两端切口和胚轴表面直接产生不定芽,该植株再生途径遗传稳定性较高,是一种较理想的离体快繁途径。陈薇等[9]的研究结果也表明,胚轴的不定芽分化较早,培养6~7 d 即可发生。在此过程中,没有愈伤组织的产生,直接产生不定芽。
植物生长调节剂是调控植物形态发生的关键性因素,其不同的种类和浓度对器官发生的影响不同。从培养过程中的观察和统计结果来看,菘蓝下胚轴切口甚至表面容易诱导产生不定芽,但外源激素种类和浓度不同,不定芽诱导率、芽高、芽数量和生长势有所不同。胡冬南等[10]研究了不同激素组合(6-BA、NAA、IAA)对菘蓝叶片组织培养的诱导影响,其结果表明,6-BA 1.5 mg·L-1+ NAA 0.6 mg·L-1和6-BA2.0 mg·L-1+NAA 0.2 mg·L-1的不定芽分化率较高,可达90%。本研究以胚轴为外植体,结果表明,6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1诱导率仅为13.3%,但6-BA 1.0 mg·L-1+ NAA 0.5 mg·L-1配比取得了良好的诱导效果,芽诱导率为77.7%,芽生长健壮,其原因可能是不同外植体其体内的内源激素含量不同,培养时对外源激素的需求量不同。本研究结果还表明,6-BA 1.0 mg·L-1+IAA 0.5 mg·L-1和KT 2.0 mg·L-1+IAA 0.8 mg·L-1也是适宜的激素组合。但KT与NAA配比诱导效果普遍不好。
有研究报道表明,单独使用0.1 mg·L-1NAA的生根率达90%以上且生根效果较佳,而过高浓度则抑制生根[10]。本研究使用1.0 mg·L-1IBA的生根率达100%,高浓度IBA对生根会表现出抑制作用。由此可见,在使用不同生长素进行菘蓝不定芽生根时,采用NAA时所需浓度比较低,采用IBA时所需浓度较高,且可以诱导获得更高的生根率。但生长素浓度过高时均会抑制根的发生。
