氧化铝表面碱性与钼金属负载研究
2020-12-16凌凤香王少军谷明镝杨春雁
范 峰,凌凤香,王少军,谷明镝,杨春雁,金 鑫
(中国石化 大连石油化工研究院,辽宁 大连 116045)
氧化铝作为重要的催化剂载体被广泛地应用于石化行业,目前,对氧化铝酸性的研究比较深入,而对氧化铝碱性的研究则较少[1-3]。徐景士等[4]用氧化钾修饰氧化铝,使氧化铝产生强碱性。Takashi等[5]认为氧化钾并非氧化铝所有强碱性的来源,认为配位不饱和的F-是产生强碱性的重要因素。Gao等[6]通过计算发现镍铜等金属氧化物在氧化锡载体上的分布阈值与实际测量值相吻合,证明它们符合密置单层模型。但董林等[7]研究发现虽然可以按照密置模型原理计算分散容量值,但载体表面的空位并未完全利用,存在一些缺陷,使用嵌入模型可解决这一问题。Chen等[8]也通过实验支持了嵌入模型的说法。Bourikas等[9-11]提出金属是孤立点状或者单分子层岛状或者二者同时存在,影响活性金属分散的主要因素是催化剂的制备条件。此外还有表面层分布理论,Yao等[12]采用液相接枝方法,使金属烷氧化物与氧化铝载体表面羟基作用,认为金属分布符合表面层分布。Guan等[13]利用溶胶-凝胶法在氧化钛膜的表面得到40 nm厚的氧化硅表面层,研究了Ti4+还原为Ti3+的原因。张长拴等[14]利用表面层分布理论改进了催化剂的制备方法,认为氧化钛分布在氧化铝的表面层,随氧化钛含量的增加,氧化钛的特征吸收峰发生变化。此外还有人认为当超过单分子层最大负载量后,活性金属呈现微粒状态分布[15-16]。
本工作制备了氧化铝负载的钼金属催化剂,考察了氧化铝负载钼金属后碱性质的变化情况,采用FTIR,CO2-TPD,NH3-TPD,TEM,H2-TPR 等分析方法对钼金属催化剂试样进行表征,研究了钼金属在氧化铝上的负载机理。
1 实验部分
1.1 原料
钼酸铵:99%(w),沈阳昂润化工有限公司;氨水:98%(w),泰兴市易初化工有限公司;氧化铝:自制;蒸馏水:自制。
1.2 催化剂的制备
分别将0.82,4.94,9.88,19.76 g的钼酸铵放入约20 mL蒸馏水中,向其中加入20 mL 28%(w)的氨水,置于40 ℃的水浴中搅拌溶解;然后定容于50 mL的容量瓶中,用蒸馏水补足,得到钼溶液;再分别取9.5 mL的钼溶液,加10 g γ-氧化铝载体,搅拌均匀,置于烘箱中120 ℃处理12 h,最后置于高温炉中,以2 ℃/min的升温速率从室温升温至500 ℃,在500 ℃下恒温300 min,再自然冷却至室温,即得Mox/Al2O3催化剂(x%为钼金属的质量分数,x=1.2,6,12,24)。
1.3 催化剂的表征
采用美国热电公司Nicolet 6700型傅里叶变换红外光谱仪对催化剂试样进行FTIR表征;采用美国麦克公司的AutoChem 2920型化学吸附仪进行NH3-TPD表征、H2-TPR表征和CO2-TPD表征;采用日本JEOL公司JEM-2200 FS型场发射高分辨透射电子显微镜进行TEM表征,照片采用STEM模式,电压为200 kV。
2 结果与讨论
2.1 FTIR表征结果
图1为催化剂试样羟基的FTIR谱图。由图1可知,氧化铝具有4个羟基峰,分别位于3 781,3 756,3 712,3 677 cm-1附近,其中,3 781 cm-1处的峰信号很弱,几乎隐藏在3 756 cm-1处的羟基峰中。在氧化铝负载钼金属后,氧化铝的羟基峰仍然存在,但发生了较大的变化:1)Mo6/A12O3和Mo12/A12O3羟基峰的位置都向低频方向偏移,且钼金属含量越高向低频方向偏移越多;2)由于受到钼金属的影响,氧化铝的4个羟基峰趋向于合并为一个大包峰,羟基峰之间的界限变得模糊,且随着金属含量的增加,界限变得更加模糊;3)氧化铝中羟基最高峰在3 712 cm-1处,次高峰在3 677 cm-1处,负载钼金属后,原次高峰强度增大,原最高峰强度相对降低;在钼金属含量为12%(w)时,最高峰在3 677 cm-1处,次高峰在3 712 cm-1处。说明氧化铝的羟基受到钼金属的影响,钼金属可能更多地负载到3 712 cm-1处的羟基附近,引起该羟基数量的减少。

图1 试样羟基的FTIR谱图Fig.1 FTIR spectra of hydroxyl groups in samples.
图2为催化剂试样的CO2-FTIR谱图。由图2可知,氧化铝吸附酸性的CO2后出现4个明显的吸收峰,分别在1 634,1 578,1 450,1 372 cm-1附近,其中,1 634 cm-1处的吸收峰归属于碳酸氢盐,1 578 cm-1处的吸收峰归属于单齿碳酸盐,1 450 cm-1和1 372 cm-1处的吸收峰归属于双齿碳酸盐[17]。当氧化铝负载钼金属后,各吸收峰的位置发生偏移。且峰强度也发生了变化,主要是1 578 cm-1和1 372 cm-1处吸收峰的强度减弱。这表明随钼金属负载量的增加,氧化铝上部分碱性位被钼金属占据,从而影响了CO2在氧化铝上的吸附行为。
2.2 CO2-TPD和NH3-TPD表征结果
由于氧化铝的碱性较弱,因此CO2-TPD技术是比较适合的碱性质表征方法[17-18]。图3是不同热处理条件下氧化铝的CO2-TPD谱图。从图3可知,氧化铝具有3个CO2的脱附峰,说明氧化铝具有3个CO2的吸附碱性位。其中,弱碱性位在123 ℃附近,中强碱性位在366 ℃附近,强碱性位在605 ℃附近,且以弱碱性位为主。随处理温度的提高,各碱性位的峰顶温度发生不同程度偏移,且当处理温度达到400 ℃时,中强碱性位消失;当处理温度达到600 ℃时,强碱性位消失。只有弱碱性位在任何处理温度下均存在。氧化铝的酸碱中心是氧化铝前体水合物在脱水后形成的,Al+为L酸中心,O2-或AlO-为碱中心。因此,氧化铝上的O2-或AlO-为氧化铝的弱碱中心,部分O2-或AlO-受吸附水和羟基的影响形成中强碱中心和强碱中心,因此脱除水和羟基后,中强碱中心和强碱中心消失。
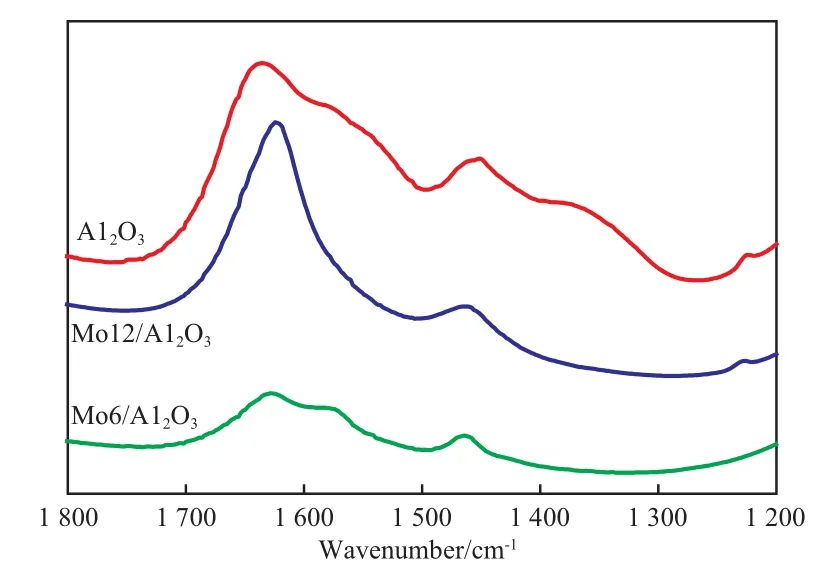
图2 试样的CO2-FTIR谱图Fig.2 CO2-FTIR spectra of the samples.

图3 不同热处理温度下氧化铝的CO2-TPD谱图Fig.3 CO2-TPD spectra of alumina under different heat treatment temperatures.
图4是催化剂试样的CO2-TPD谱图。由图4可知,随氧化铝上钼负载量的增加,弱碱性位的碱量呈现出规律的下降趋势。当钼金属负载量为6%(w)时,催化剂保留了原始氧化铝30%的弱碱性碱量;当钼金属负载量为12%(w)时,催化剂保留了原始氧化铝5%的弱碱性碱量;当钼金属负载量为24%时,催化剂上的弱碱性碱量几乎为0。因此,钼金属的负载位点是氧化铝弱碱性位为中心的微小区域,且该区域氧化铝上的羟基的波数为3 712 cm-1。随钼金属负载量的增加,该区域逐渐被钼金属占据,弱碱性逐渐消失,该区域羟基的数量也随着减少。

图4 催化剂试样的CO2-TPD谱图Fig.4 CO2-TPD spectra of the catalyst samples.
表1为催化剂试样的NH3-TPD表征结果。从表1可看出,氧化铝的酸量为0.82 mmol/g,负载钼金属后酸量呈现增加的趋势。酸量的增加应该是钼金属引起的,不是氧化铝自身酸性质的变化。本工作所用钼金属的前体为钼酸铵,钼酸铵为酸性物质,由于钼酸铵与氧化铝的酸性位同为酸性,因此,二者发生互斥,钼金属应当无法负载到氧化铝的酸性位上。当钼酸铵负载到氧化铝表面时,由于钼酸铵具有酸性,与氧化铝的酸性位发生排斥作用,而与氧化铝的弱碱性位发生吸引作用,所以钼金属优先负载到氧化铝的弱碱性区域上。随钼负载量的上升,氧化铝上的弱碱性位逐渐被钼金属所覆盖,从而造成弱碱性位的碱量逐渐降低。

表1 催化剂试样的酸量Table 1 The acidity of the catalyst samples
2.3 TEM表征结果
图5是催化剂的TEM照片,表2是催化剂上氧化钼的平均直径。由图5可知,钼酸铵负载到氧化铝表面后,经过高温热处理后转化为氧化钼纳米簇,在TEM照片中显示为亮点,形状近似椭圆形,在氧化铝表面呈孤岛形态均匀分散。由表2可知,随钼负载量的增加,氧化钼纳米簇的数量增加,且单一纳米簇的直径和面积也增加,Mo6/Al2O3的氧化钼纳米簇平均直径为0.63 nm,Mo12/Al2O3的氧化钼纳米簇平均直径为0.78 nm,Mo24/Al2O3的氧化钼纳米簇平均直径为0.99 nm。密置单层理论模型认为金属氧化物在载体表面高度分散,以密置单层形式排列。但通过TEM照片还可清晰的看到氧化钼是以原子簇形式孤岛状分散在氧化铝表面,而非密置单层模型理论认为的以二维单层形式分散。结合其他表征结果推测,钼酸铵优先负载到氧化铝表面的弱碱性区域,在该区域形成三维孤岛状态,热处理后转变为氧化钼纳米簇,且随着钼金属负载量的增加,氧化钼纳米簇孤岛逐渐增大。

图5 试样的TEM照片Fig.5 TEM images of samples.

表2 氧化钼的平均直径Table 2 Average diameter of molybdenum oxide
2.4 H2-TPR表征结果
图6是催化剂试样的H2-TPR谱图。由图6可知,试样主要有2个还原峰,低温峰的温度范围是200~600 ℃,高温峰的范围是600~1 050 ℃。说明氧化铝上氧化钼的还原分为两种类型:一类是与氧化铝表面直接接触的数层氧化钼的还原;另一类是与氧化铝表面未接触的体相氧化钼的还原。Mo1.2/Al2O3的金属含量最低,仅为1.2%(w),它的高温峰顶温度为1 026 ℃,且几乎没有低温还原峰。说明该氧化钼纳米簇中的金属原子层数很少,几乎没有形成体相钼金属。这些氧化钼与氧化铝表面的作用力极强,因此极难还原。当钼金属负载量增加后,高温峰面积与低温峰面积的比值逐渐减小。说明逐渐形成较厚的氧化钼纳米簇,即形成了更多的体相钼金属。氧化钼纳米簇厚度的增加,反过来又促进了钼金属的还原,所以可以看到低温峰顶温度与高温峰顶温度都向低温方向移动。一般情况下,低温峰所占比例越高,催化剂的活性就越高。因此体相中的钼金属是有效的活性金属,而氧化钼纳米簇中与氧化铝表面相连接的数层钼金属由于被氧化铝强力束缚而失去催化功能。

图6 试样的H2-TPR谱图Fig.6 The H2-TPR spectra of the samples.
2.5 钼金属在氧化铝上的负载机理
通过对氧化铝碱性和钼金属负载过程的研究,推测氧化铝的表面碱性位可以分为3类,分别为弱碱性位、中强碱性位、强碱性位,且是以弱碱性位为主;中强碱性位和强碱性位是由部分O2-或AlO-受到吸附水和羟基的影响而形成的,所以脱除水和羟基后中强碱中心和强碱中心消失。由于具有一定的酸性,因此钼酸铵分散到氧化铝表面时,优先分散到氧化铝的弱碱性位为中心的微小区域,并影响了该区域羟基的数量,再经高温热处理分解成为氧化钼纳米簇。随钼金属负载量的增加,氧化钼纳米簇的面积相应增加,且簇的厚度也增加。当氧化钼还原时,与氧化铝表面未接触的体相氧化钼优先还原,这部分氧化钼还原难度低,在H2-TPR谱图中体现为低温还原峰;而与氧化铝表面直接接触的数层氧化钼,由于与氧化铝的作用力相对较强,因而较难还原,在H2-TPR谱图中体现为高温还原峰。
3 结论
1)表征结果显示,负载钼金属后,氧化铝不同羟基FTIR的峰强度发生较大改变;吸附CO2后,1 578 cm-1和1 372 cm-1处的峰强度逐渐减弱至消失;氧化铝表面碱性以弱碱性为主,钼金属主要负载到氧化铝的弱碱性位区域,随钼负载量的增加,弱碱性逐渐消失;钼金属是以氧化钼纳米簇形式负载到氧化铝上的,且氧化钼纳米簇的面积和厚度也增加;与氧化铝表面未接触的体相氧化钼优先还原,还原难度低;而与氧化铝表面直接接触的数层氧化钼,由于与氧化铝的作用力相对较强,较难还原。
2)钼酸铵在氧化铝表面负载分散时,优先分散到氧化铝的弱碱性位区域,经高温热分解为氧化钼纳米簇;随着钼金属负载量的增加,氧化钼纳米簇的面积和厚度相应增加;当氧化钼催化剂还原时,与氧化铝表面未接触的体相氧化钼优先还原,还原难度低;与氧化铝表面直接接触的数层氧化钼,由于与氧化铝的作用力相对较强,较难还原。
