探究ADAMTS1对非小细胞肺癌血管生成及预后的影响*
2020-12-15陈大明项保利黄攀登赵建清
陈大明,王 布,项保利,黄攀登,苑 程,赵建清△
(河北北方学院附属第一医院:1.输血科;2.呼吸内科,河北张家口 075000)
非小细胞肺癌(NSCLC)是我国十分常见的恶性肿瘤,具有进展快、易转移、病死率高等特点[1]。肿瘤血管生成是肿瘤生长和转移的基础,有效抑制肿瘤组织的血管生成对控制其复发和转移具有积极意义[2]。血小板结合蛋白基序的解聚蛋白样金属蛋白酶(ADAMTS)家族属于分泌型蛋白酶,有19个亚型,参与机体多种生理及病理过程,包括止血、关节炎和肿瘤发生等[3]。Ⅰ型ADAMTS(ADAMTS1)是ADAMTS家族中的一种亚型[4]。近年来有研究表明,ADAMTS1在结肠癌等多种肿瘤组织中起了重要作用,具有抗血管生成作用[5]。然而目前关于ADAMTS1在NSCLC中的表达情况少有报道。本次笔者就ADAMTS1 mRNA表达水平对NSCLC血管生成及患者预后的影响展开研究,现报道如下。
1 资料与方法
1.1一般资料 随机选择本院2014年1—10月因诊断NSCLC并行外科手术切除的患者68例,其中男性38例,女性30例,年龄37~69岁,平均(53.5±1.5)岁。纳入标准:(1)入组资料完整;(2)均为首发,术前未行放、化疗;(3)均经病理诊断证实。其中鳞状上皮细胞癌25例,腺癌22例,大细胞癌21例;分化类型中,高分化7例,中分化21例,低分化40例;临床分期Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期36例;有淋巴结转移27例,无淋巴结转移41例。所有患者及家属均签署知情同意书,自愿入组。
1.2方法
1.2.1标本处理 每例患者分别取肺癌组织及距肿瘤切缘>5 cm的癌旁正常肺组织(简称癌旁组织)。所有组织均分为2块,一部分加入Trizol试剂(约每1 mm3组织中加入1 mL Trizol),置于-80 ℃冰箱保存,另一部分利用石蜡包埋,制成切片。
1.2.2实时荧光定量聚合酶链反应(qPCR) 参照Trizol试剂说明书和反转录试剂盒说明书,将肺癌组织及癌旁组织中的RNA在低温下提取并反转录成cDNA。ADAMTS1的上游引物为5′-CCTGGTGGTGGTGA AGAT-3′,下游引物为5′-TTCACCACCACCAGGCTAAC-3′;血管内皮生长因子(VEGF) mRNA的上游引物为5′-G GCAGAATCATCACGAAGT-3′,下游引物为5′-CACAGGATGGCTTGAAGAT-3′;选取β -actin作为内参,上游引物为5′-AGATCAAGATCATTGCTCCTC-3′,下游引物为5′-ACTCGTCA TACTCCTGCTT-3′。反应条件:94 ℃预变性10 min,94 ℃变性45 s,退火45 s,72 ℃延伸45 s,经过35个循环扩增后,72 ℃ 7 min。PCR产物进行2%琼脂糖凝胶电泳,采用GelPro Analysizer 3.1软件进行半定量分析,计算得到相对表达量[6-9]。
1.2.3微血管密度(MVD)测定 参照Weidner法[10],首先在低倍镜(10×10)下扫描整张切片,找到“热点区”,即FⅢ Ag明显染为棕褐色的微血管区。然后换为高倍镜(10×40)下观察计数。在肿瘤组织之间及肿瘤组织与周围结缔组织之间每一个被染为棕褐色的细胞或细胞簇计数为1个血管,最终结果以3个视野的平均数表示[11-12]。
1.3术后随访 分别于术后1个月、3个月、6个月进行随访,之后每半年随访一次,并记录患者的术后肿瘤复发、死亡等情况,随访5年。
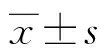
2 结 果
2.1NSCLC原位灶及癌旁组织中ADAMTS1、VEGF mRNA表达水平及MVD检测结果比较 qRT-PCR结果显示,NSCLC组织中ADAMTS1 mRNA表达水平低于癌旁组织, VEGF mRNA表达水平、MVD高于癌旁组织,差异均有统计学意义(P<0.05)。见图1。

注:A为NSCLC原位灶与癌旁组织ADAMTS1 mRNA表达水平比较;B为NSCLC原位灶与癌旁组织VEGF mRNA表达水平比较;C为NSCLC原位灶与癌旁组织MVD比较。NSCLC原位灶与癌旁组织比较,*P<0.05。
2.2NSCLC原位灶中ADAMTS1 mRNA的表达水平与VEGF mRNA表达水平及MVD的相关性 由相关性结果分析可得,NSCLC原位灶中ADAMTS1 mRNA的表达水平与VEGF mRNA表达水平及MVD呈负相关。NSCLC原位灶中ADAMTS1 mRNA的表达水平越低,其VEGF mRNA水平越高,MVD测定越多。见图2。
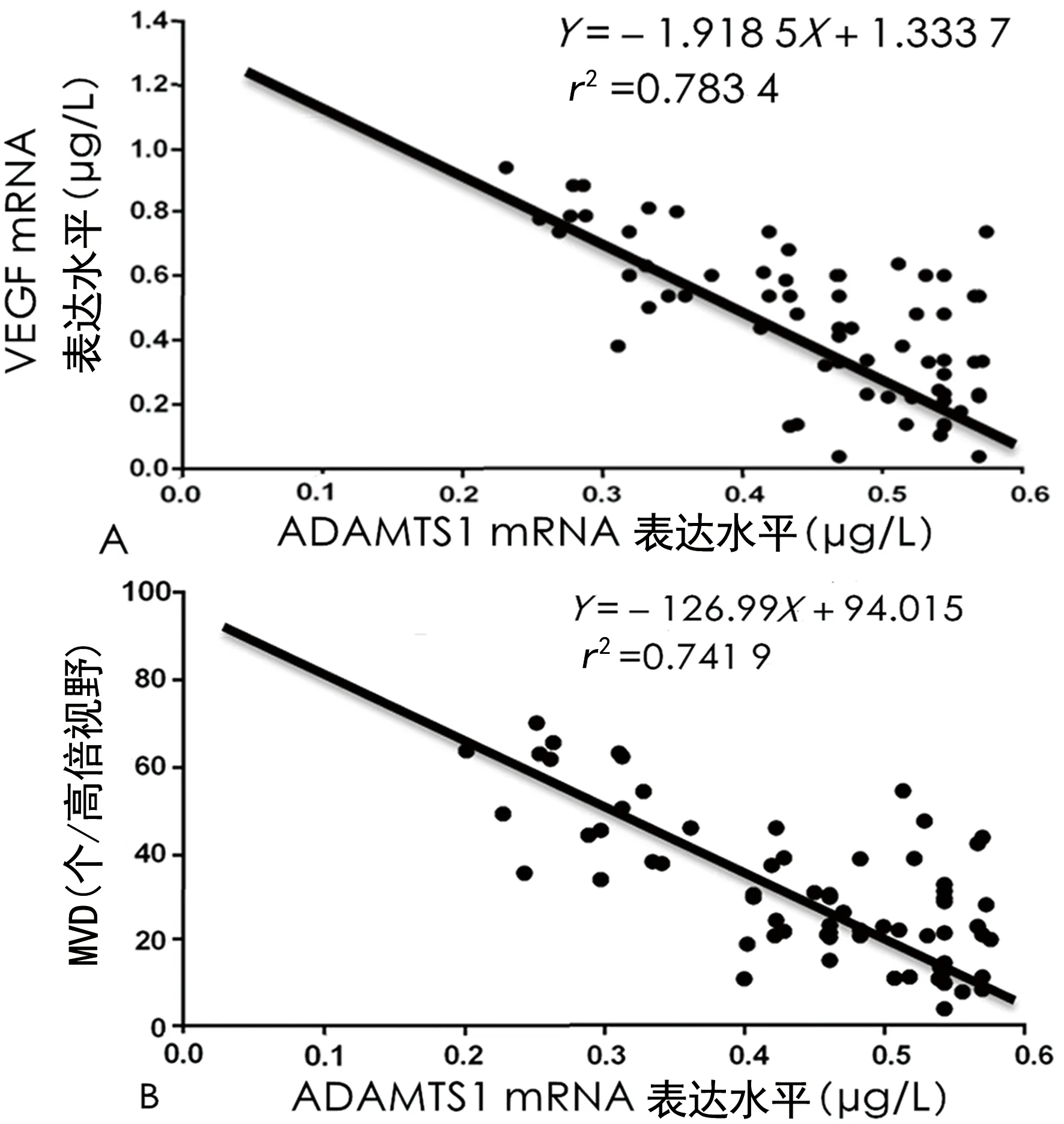
注:A为NSCLC原位灶中ADAMTS1与VEGF mRNA表达水平的相关性;B为NSCLC原位灶中ADAMTS1的表达水平与MVD的相关性。
2.3NSCLC原位灶中ADAMTS1 mRNA的表达水平与NSCLC病理特征的相关性 ADAMTS1 mRNA在NSCLC原位灶中的表达水平与患者性别、年龄、吸烟史、肿瘤位置、病理类型、分化程度无相关性,差异均无统计学意义(P>0.05)。见表1。
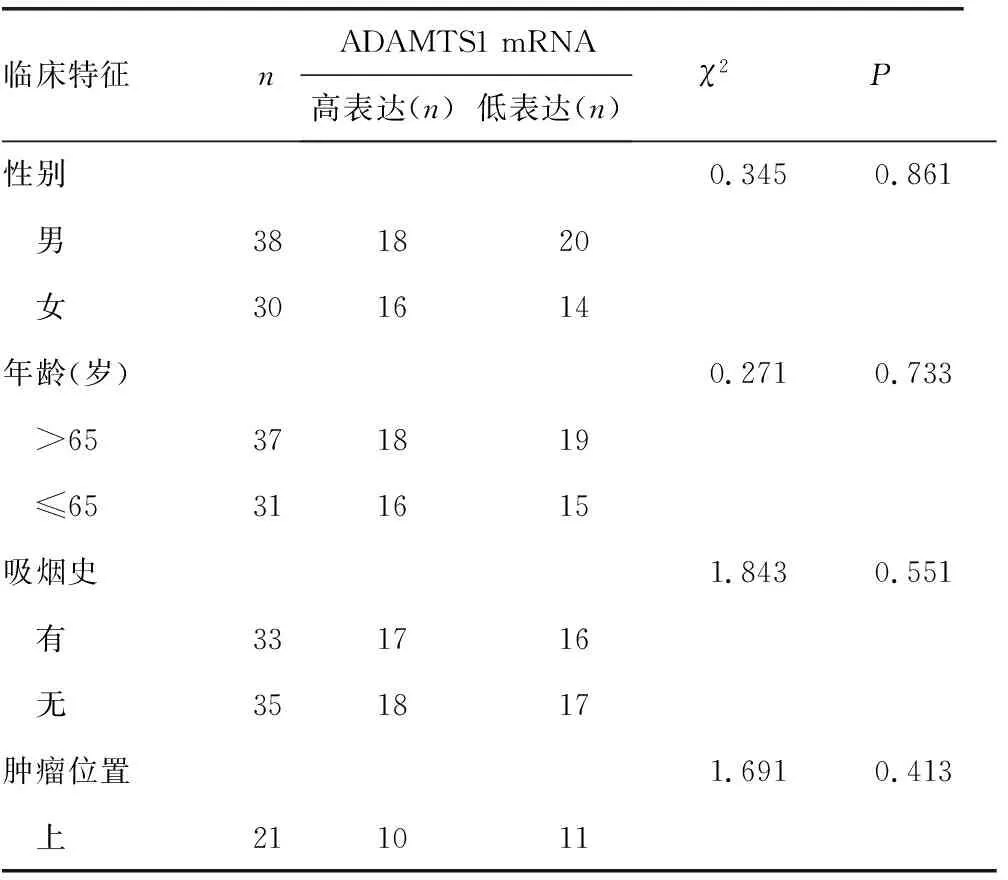
表1 ADAMTS1 mRNA的表达水平与NSCLC病理特征的相关性

续表1 ADAMTS1 mRNA的表达水平与NSCLC病理特征的相关性
2.4ADAMTS1 mRNA的表达水平与TNM分期的相关性 ADAMTS1 mRNA在NSCLC原位灶中的表达水平与TNM分期相关,TNM分期越高,NSCLC患者ADAMTS1低表达的比例越高,差异有统计学意义(P<0.05)。见表2。
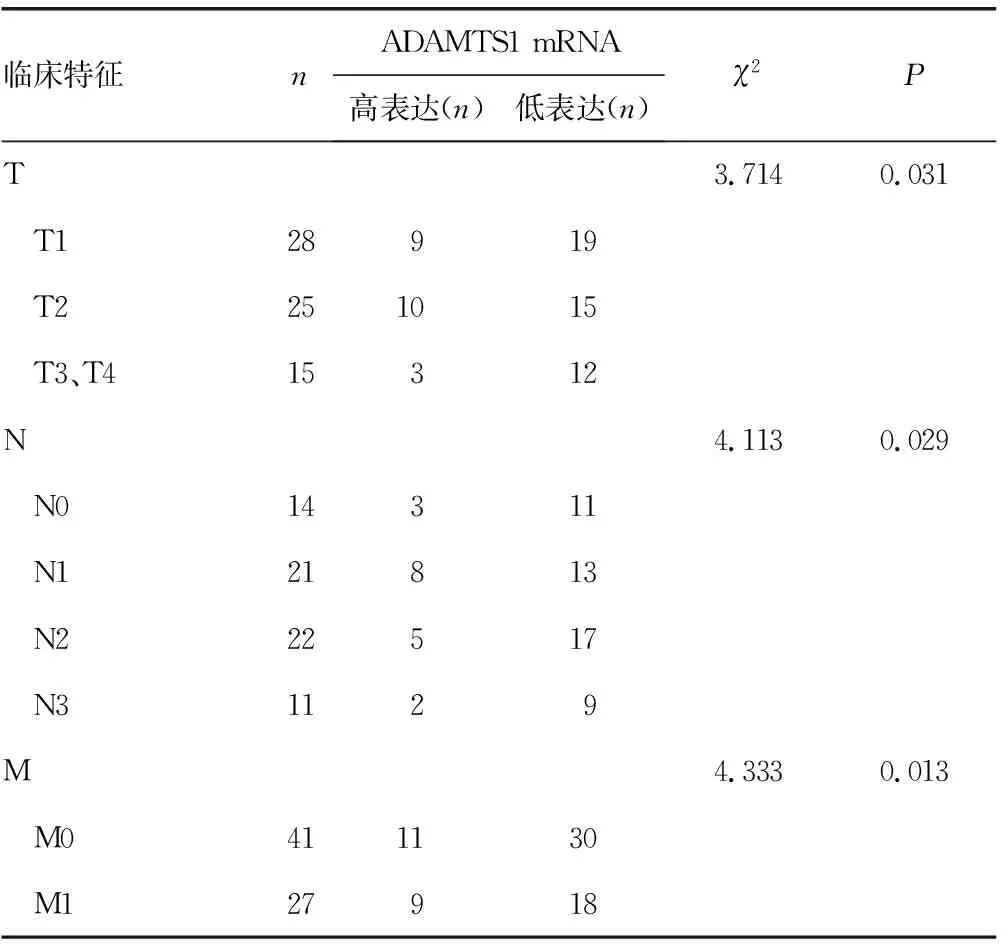
表2 ADAMTS1 mRNA的表达水平与TNM分期的相关性
2.5NSCLC中ADAMTS1 mRNA的表达水平与患者预后的相关性 生存曲线显示,低表达水平的ADAMTS1的NSCLC患者生存率下降;Cox比例风险模型分析显示,NSCLC患者原发灶中ADAMTS1 mRNA的表达水平是影响患者预后的危险因素。ADAMTS1 mRNA的表达水平越低,患者预后越差。见图3、表3。

图3 ADAMTS1 mRNA的表达水平对NSCLC患者生存率的影响
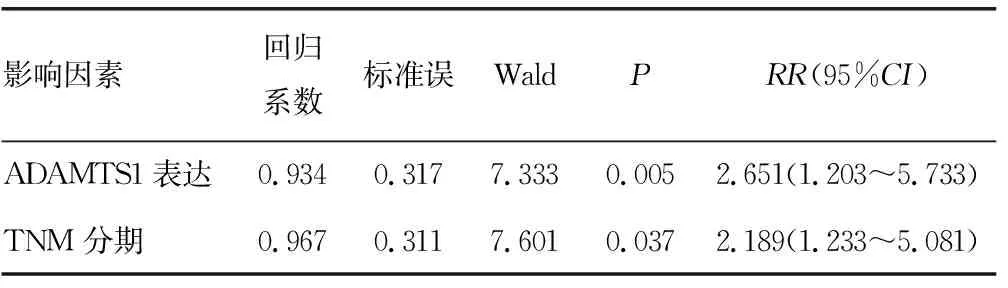
表3 Cox比例风险模型生存分析结果
3 讨 论
ADAMTS家族属于分泌型蛋白酶,有19个亚型,可由多种细胞合成和分泌,参与机体多种生理及病理过程,包括止血过程、器官生成、血管生成、关节炎和癌症等,其与基质金属蛋白酶(MMPs)相同,二者均属于金属蛋白酶,结构非常相似[13-15]。目前对MMPs在生命活动中的功能已有大量研究,但对ADAMTS家族的研究并未深入[16]。对于ADAMTS结构的研究发现,ADAMTS家族含有多个结构域,其主要结构特点是C-端含有凝血酶敏感蛋白(TSP)基序[17]。ADAMTS1是ADAMTS家族中的一种亚型[18]。有研究结果表明,ADAMTS1在多种肿瘤组织中起重要作用,具有抗血管生成作用[19],但关于ADAMTS1在NSCLC中的表达情况少有报道。笔者就ADAMTS1表达水平对NSCLC血管生成及患者预后的影响展开本次研究。
本研究结果显示,ADAMTS1 mRNA在NSCLC原位灶与癌旁组织中存在差异性表达。ADAMTS1 mRNA在NSCLC原位灶中的表达水平远远低于癌旁组织,且VEGF mRNA表达水平及MVD高于癌旁组织。该结果提示ADAMTS1的低表达水平可能与NSCLC的发生有关,表明ADAMTS1是一个肿瘤生长抑制因子。相关性分析指出,NSCLC原位灶中ADAMTS1 mRNA的表达水平与VEGF mRNA表达水平及MVD呈负相关,低表达水平的ADAMTS1可能促进肿瘤组织中血管的生成,高表达水平可能会抑制血管的生成,表明ADAMTS1也是一个肿瘤血管生成抑制因子,这与很多研究报道中结果相一致。有研究报道指出,在体外试验中,ADAMTS1 C-末端TSP1基序能够结合内皮生长因子,从而抑制VEGF 165达到抑制血管内皮细胞增殖的作用; 另外ADAMTS1也可与成纤维细胞生长因子-2(FGF2)共同作用,导致FGF2裂解,产生TSP,释放出具有抗血管生成片段,该片段同样通过抑制血管内皮细胞增殖,达到抑制血管新生的作用[20-21]。本研究推测ADAMTS1是通过抑制血管内皮细胞增殖从而抑制新生血管生成,低表达水平的ADAMTS1对新生血管的抑制作用降低,从而表现出NSCLC原位灶中ADAMTS1 mRNA的表达水平与VEGF mRNA表达水平及MVD呈负相关。
本研究证明了ADAMTS1 mRNA的表达水平与肺癌患者病理特征和TNM分期的相关性。研究结果显示,ADAMTS1 mRNA的表达水平与肺癌患者病理特征无关,而与TNM分期相关。肿瘤血管生成是肿瘤生长和转移的基础,这与上述结果相互印证。目前有研究表明,肿瘤在头颈部癌转移灶中ADAMTS1 mRNA的表达水平高于原发癌灶,且ADAMTS1在经淋巴结转移后的病灶中的表达水平高于无淋巴结转移及原发灶,对于其具体机制目前研究尚不十分清楚,这与本研究中ADAMTS1 mRNA的表达水平与TNM分期相关相吻合[22]。目前研究发现ADAMTS1与多种肿瘤组织预后相关,如:结肠癌等[23]。本研究通过Cox分析显示,NSCLC患者原发灶中ADAMTS1 mRNA的表达水平是影响患者预后的危险因素。 ADAMTS1 mRNA的表达水平越低,患者预后越差。生存曲线显示低表达水平ADAMTS1的NSCLC患者生存率下降。该结果表明ADAMTS1 mRNA表达水平与NSCLC患者预后呈负相关。该结果表明,ADAMTS1是影响NSCLC患者预后的重要因素之一,其主要机制或与ADAMTS1抑制肿瘤中血管内皮细胞增殖,抑制新生血管的生成有关。
4 结 论
ADAMTS1可能是一种NSCLC生长抑制因子,低表达水平的ADAMTS1可能促进NSCLC组织中血管生成,是患者预后不良的重要影响因素,其机制可能与抑制NSCLC组织中血管内皮细胞增殖及新生血管的生成有关。ADAMTS家族在机体生命活动中所产生的作用及其作用机制目前尚不清楚,对于ADAMTS1在NSCLC的病理病程中的作用机制尚需进一步探讨。
