诱骗受体3对内毒素诱导的血管内皮细胞凋亡的影响*
2020-12-15陈洪卫侯彦强
陈洪卫,侯彦强
(上海市松江区中心医院检验科,上海 201600)
脓毒症发生时毛细血管的通透性增加,形成第三间隙液体引起组织水肿(如肺泡水肿),造成组织的氧交换障碍。有研究资料显示,严重脓毒症患者,毛细血管渗漏综合征(CLS)的发生率几乎达100%,并且CLS的持续时间越长,多器官功能障碍综合征发生率和病死率也越高[1]。另有研究表明,CLS的发生同血管内皮细胞凋亡有密切关系[2]。本课题组在前期研究中发现,脓毒症患者其血清诱骗受体3(DcR3)表达会升高。DcR3是20世纪末发现的肿瘤坏死因子受体的新成员,是一类可以和肿瘤坏死因子超家族第14个成员(LIGHT)、死亡因子配体(FasL)及肿瘤坏死因子配体相关分子1A(TL1A)特异性结合的受体蛋白,从而阻断该配体诱导产生的凋亡。DcR3与多种肿瘤性及炎性疾病的发生发展密切相关,但DcR3在脓毒症发病过程中发挥何种作用尚不清楚[3-4]。因此,本研究通过观察过表达或干扰DcR3对内毒素诱导的血管内皮细胞凋亡的影响,探讨CLS的发生机制和防治策略。
1 材料与方法
1.1主要试剂 1640培养液和胎牛血清购于美国GIBCO公司;脂多糖(LPS)购于美国Sigma公司;质粒增强绿色荧光蛋白(pEGFP)-DcR3和DcR3小干扰RNA(siRNA)由上海和元生物技术公司合成,DcR3 siRNA序列为: Sense5′-UCGACUUUGUGGCUUUCCA-3′,Antisense5′-UGGAAAGCCAC AAAGUCGA-3′;胱天蛋白酶(Caspase)3和Cleave PARP抗体均购自美国Cell Signaling公司。
1.2血管内皮细胞的培养及传代 -80 ℃冰箱中取出人脐静脉内皮细胞(HUVEC)冻存管,迅速放入37 ℃水浴中,不停摇动,使其在1 min内融化,无菌条件下吸出细胞,1 000 r/min离心5 min,弃上清液,加入适量培养液重悬细胞接种于培养瓶中,5%CO2、37 ℃培养箱培养。待细胞长满细胞瓶时,进行传代,弃去旧培养液,磷酸盐缓冲液漂洗一次,再加入1.5 mL胰酶消化,镜下观察细胞回缩变圆、间隙增大时,加入新鲜培养基终止反应,反复吹打细胞重悬,1∶3转移入培养瓶,5%CO2、37 ℃培养箱继续培养。
1.3细胞处理 将细胞分成6组:正常对照组、单纯LPS刺激组、LPS+siRNA DcR3组、LPS+siRNA对照组、LPS+pEGFP-DcR3组和LPS+pEGFP对照组,分别置于6孔板中培养,调整并计数,使各孔含有106个细胞,每个处理重复3次。具体处理如下:细胞贴壁后12 h,正常对照组和单纯LPS刺激组先不做任何处理;LPS+siRNA DcR3组和LPS+pEGFP-DcR3组利用Liporin2000转染25 nmol/L DcR3 siRNA和pEGFP-DcR3进行预处理;LPS+siRNA对照组和LPS+pEGFP对照组转染相同剂量的siRNA和pEGFP进行预处理。预处理48 h后,除正常对照组外,其余各组均加入10 μg/mL LPS刺激细胞,24 h后,收集细胞上清液及细胞进行下一步实验。
1.4实时荧光定量 PCR 用总RNA提取试剂(Trizol)裂解细胞抽提总RNA并反转录成cDNA,采用SYBR green法对DcR3 mRNA的表达水平进行检测。DcR3特异性引物由上海生工生物工程有限公司合成。利用ABI 7500实时荧光定量PCR仪进行基因扩增。PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火并延伸34 s,进行40个循环。收集每个PCR延伸期的荧光,反应产物经溶解曲线检测特异性,经SDS2.2软件分析循环阈值(Ct)值。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,采用2-ΔΔCt方法计算mRNA的表达水平,其中ΔΔCt=ΔCt实验组-ΔCt对照组,ΔCt=Ct靶基因-Ct内参基因。
1.5蛋白免疫印迹(Western blot) 使用RIPA裂解细胞,经BCA蛋白定量试剂盒定量后,取50 μg蛋白,水浴煮沸10 min后行10%十二烷基硫酸钠-聚丙烯酰胺蛋白电泳,转移至聚偏二氟乙烯膜上。5%脱脂蛋白室温封闭2 h,加入适量的DcR3、Caspase3和β-actin抗体,4 ℃孵育过夜,0.1%的磷酸盐吐温缓冲液(PBST)漂洗3次,每次5 min。加辣根过氧化物酶标记的二抗,室温孵育1 h后,PBST洗3次,每次5 min。结果用ECL-Plus化学发光试剂盒检测,X光胶片曝光、显影、定影、观察结果。
1.6流式细胞术检测细胞凋亡 各组细胞处理后,用Annexin V-FITC Apoptosis Dection kit (Bection Dickinson 美国)检测细胞凋亡率。
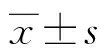
2 结 果
2.1siRNA干扰后细胞内DcR3 mRNA及蛋白的表达水平 实验共设置3组,第1组为48 h正常对照组,第2组为48 h LPS+siRNA对照组,第3组为48 h LPS+siRNA DcR3组。定量PCR和Western blot结果显示,与正常对照组相比,LPS+siRNA对照组细胞内DcR3 mRNA和蛋白表达水平差异无统计学意义(1.003±0.098vs. 0.928±0.096和0.333±0.012vs. 0.375±0.020,P>0.05),而LPS+siRNA DcR3组细胞内DcR3 mRNA和蛋白表达水平下降(1.003±0.098vs. 0.536±0.028和0.333±0.012vs. 0.101±0.016),差异有统计学意义(P<0.05)。见图1。
注:A为细胞内DcR3 mRNA的表达水平,结果以2-ΔΔCt表示;B为细胞内DcR3蛋白的表达水平;C为DcR3与内参actin的灰度比。与正常对照组比较,*P<0.05。
2.2DcR3过表达处理后细胞内DcR3 mRNA及蛋白的表达水平 试验共设置3组,第1组为48 h正常对照组,第2组为48 h LPS+pEGFP对照组,第3组为48 h LPS+pEGFP-DcR3组。定量PCR和Western blot结果显示,与正常对照组相比,LPS+pEGFP对照组细胞内DcR3 mRNA和蛋白表达水平差异无统计学意义(1.005±0.079vs. 0.974±0.086和0.298±0.015vs. 0.299±0.017,P>0.05),而LPS+pEGFP-DcR3组细胞内DcR3 mRNA和蛋白表达水平升高(1.005±0.079vs. 2.178±0.021和0.298±0.015vs. 0.437±0.019),差异有统计学意义(P<0.05)。见图2。
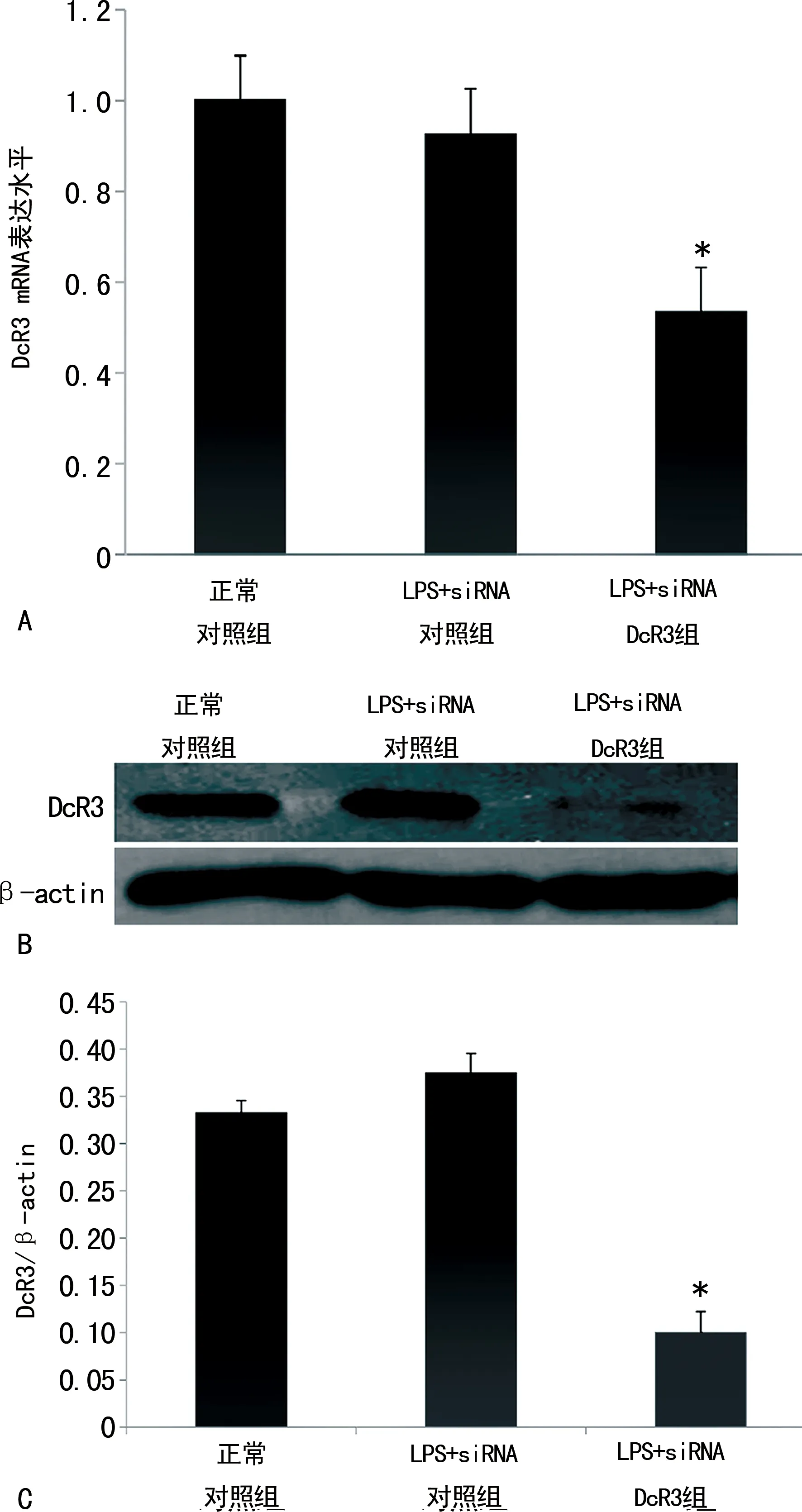
2.3siRNA DcR3对LPS诱导的细胞凋亡的影响 流式细胞术结果显示,LPS可诱导血管内皮细胞凋亡,其凋亡率从诱导前的(10.10±0.09)%增至(31.80±0.15)%,siRNA DcR3表达对此有加强作用,可使LPS诱导的HUVEC凋亡明显增加,凋亡率从(31.80±0.15)%增至(42.70±0.23)%,差异有统计学意义(P<0.05)。Western blot检测细胞内凋亡蛋白同样显示,LPS可诱导血管内皮细胞凋亡,其细胞内Caspase 3和Cleave PARP表达较正常对照组增加(P<0.05),siRNA DcR3表达对此有加强作用,可使细胞内Caspase 3和Cleave PARP表达较单纯LPS刺激组增加(P<0.05)。见图3。

注:A为细胞内DcR3 mRNA的表达水平,结果以2-ΔΔCt表示;B为细胞内DcR3蛋白的表达水平;C为DcR3与内参actin的灰度比。与正常对照组相比,*P<0.05。
2.4DcR3过表达处理对LPS诱导的细胞凋亡的影响 流式细胞术结果显示,LPS可诱导血管内皮细胞凋亡,其凋亡率从诱导(10.10±0.09)%增至(31.80±0.15)%,DcR3过表达对此有明显抑制作用,可使凋亡率从(31.80±0.15)%降至(21.50±0.16)%,差异有统计学意义(P<0.05)。Western blot检测细胞内凋亡蛋白同样显示,LPS可诱导血管内皮细胞凋亡,其细胞内Caspase 3和Cleave PARP表达较正常对照组增加 (P<0.05),DcR3过表达对此有抑制作用,可使细胞内Caspase 3和Cleave PARP表达较单纯LPS刺激组降低 (P<0.05)。见图4。
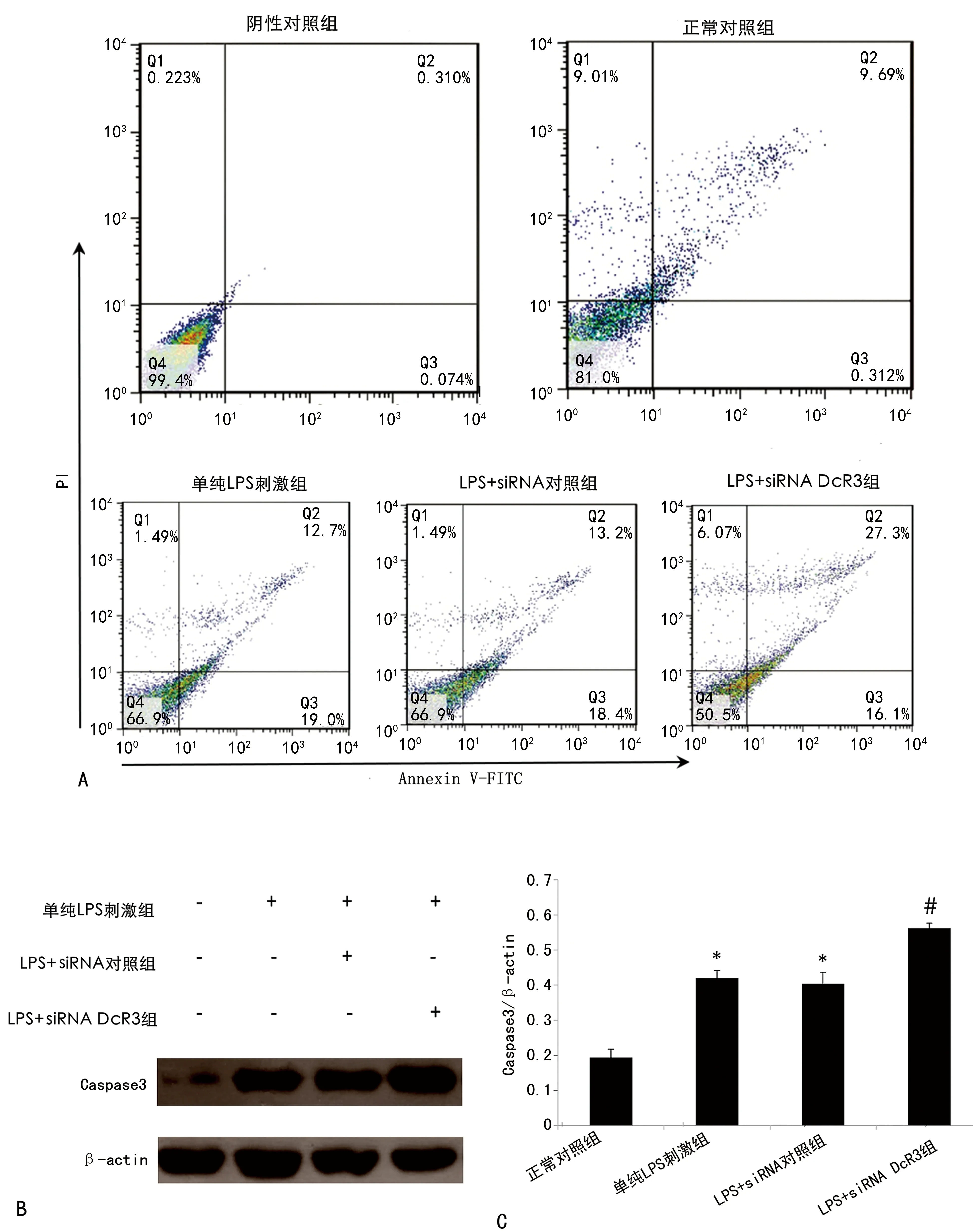
注:A为流式细胞术检测细胞凋亡情况;B为Western blot检测细胞凋亡蛋白的表达水平;C为Western blot结果中蛋白与内参β-actin的灰度比。与正常对照组相比,*P<0.05;与单纯LPS刺激组相比,#P<0.05。
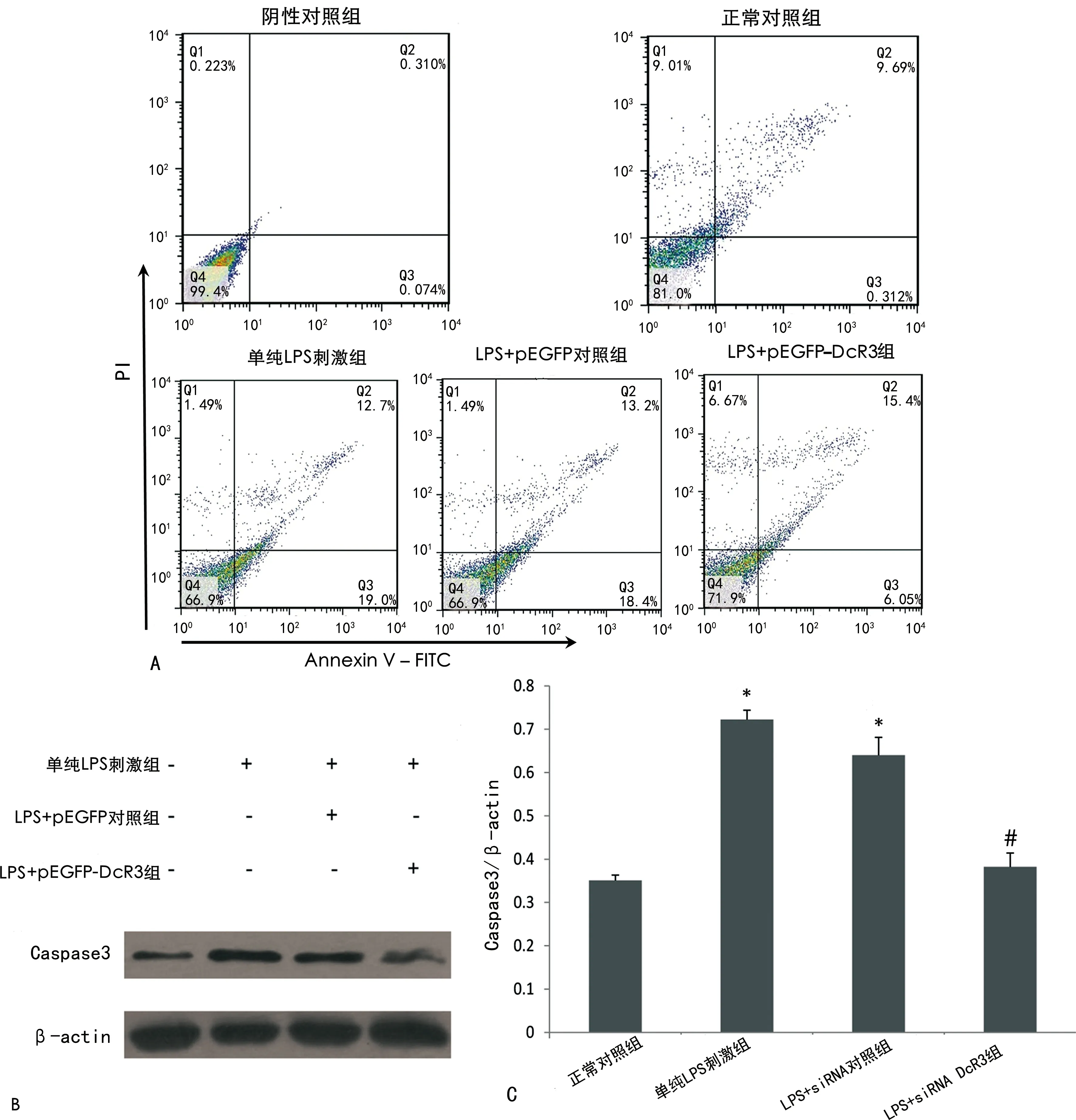
注:A为流式细胞术检测细胞凋亡情况;B为Western blot检测细胞凋亡蛋白的表达水平;C为Western blot结果中蛋白与内参β-actin的灰度比。与正常对照组相比,*P<0.05;与单纯LPS刺激组相比,#P<0.05。
3 讨 论
细胞凋亡在脓毒症发病过程中越来越受到人们的重视,特别是血管内皮细胞凋亡导致的微血管通透性增高,这是器官功能受损的重要特征之一[5]。内皮细胞是脓毒症诱导事件的主要目标且内皮细胞的损伤在脓毒休克病理学中占重要作用,血管内皮细胞是机体首先接触循环中细菌的细胞之一[6-7]。脓毒症时细菌首先通过内皮细胞表面的识别受体启动炎性介质的表达,细胞的高反应可能造成血管内皮细胞损伤、死亡或间隙改变,使得内皮细胞通透性增高,导致组织、器官水肿及发生相应的功能障碍,临床上表现为CLS[8]。血管壁内皮细胞凋亡和脱落是血管损伤的重要标志,也是CLS发生的重要因素之一。因此,降低脓毒症时血管内皮细胞的凋亡可能对改善毛细血管功能有重要意义。
DcR3是新近发现的一种与凋亡密切相关的抗凋亡分子,通过竞争性结合FasL、LIGHT和TL1A 3种肿瘤坏死因子超家族配体,在调控细胞增殖、分化和凋亡中发挥重要作用[9-10]。研究发现,通过过表达DcR3能够保护放线菌酮诱导的单核细胞凋亡[11],而干扰DcR3表达可以促进胰腺癌肿瘤细胞的凋亡[12]。
本课题组前期研究发现脓毒症患者血清中DcR3表达水平升高,DcR3作为一个抗炎、抗凋亡因子,其表达水平升高可能是机体的一个防御机制。为了进一步证实DcR3在脓毒症发病机制中的作用,本研究以体外培养的HUVEC为模型,以内毒素作为刺激物,通过过表达及干扰DcR3观察细胞的凋亡情况。
结果显示,HUVEC内DcR3在正常培养状态下即存在一定的表达率,siRNA DcR3预处理后,细胞内DcR3表达明显被抑制,LPS可以诱导血管内皮细胞凋亡,使细胞凋亡率从诱导前的(10.1±0.09)%增至(31.8±0.15)%,抑制DcR3表达能够加强LPS的诱导作用,LPS+siRNA DcR3组细胞凋亡明显高于单纯LPS刺激组(P<0.05)。而LPS+pEGFP-DcR3组细胞内DcR3表达明显升高,流式和Western blot检测细胞凋亡情况显示,过表达DcR3能够显著抑制LPS诱导的细胞凋亡,可使凋亡率降至(21.5±0.16)%。
4 结 论
脓毒症时存在静脉内皮细胞损伤,且内皮细胞凋亡增加,DcR3在脓毒症引起的内皮细胞凋亡中起重要作用,过表达DcR3能够抑制LPS诱导的细胞凋亡。试验结果在脓毒症的治疗和预后判断中具有潜在研究价值,尚需进一步证实。
