尘螨疫苗免疫治疗对过敏性哮喘小鼠气道抗铜绿假单胞菌感染能力的影响*
2020-12-15陈书恩周明德刘志伟杨小猛张秀明
陈书恩,赵 丹,周明德,陈 相,刘志伟,杨小猛,张秀明
(1.广东省深圳市罗湖医院集团医学检验中心,广东深圳 518000;2.广东省深圳市罗湖区妇幼保健院检验科,广东深圳 518019;3.广东省深圳市罗湖区慢性病防治院检验科,广东深圳 518023;4.广东省深圳市罗湖区妇幼保健院人力资源部,广东深圳 518019;5.广东省深圳市罗湖区人民医院医学检验科,广东深圳 518000)
先天性免疫系统是宿主防御的第一道防线,由固有免疫屏障、固有免疫细胞和固有免疫分子组成[1]。抗菌肽(AMP)是重要的固有免疫分子,具有广谱抗菌活性,包括防御素和cathelicidins两大主要的AMP家族[2-3]。气道上皮细胞是先天性肺部免疫系统的组成部分,能分泌β防御素等多种AMP[4]。以往研究发现采用β防御素治疗严重联合免疫缺陷小鼠,可以降低其皮下组织中的细菌水平[5]。
过敏性哮喘是一种以肺嗜酸性粒细胞浸润和气道高反应性为特征的IgE介导的慢性炎症性疾病[6]。难治性哮喘是气道感染的危险因素,过敏性气道炎症抑制了气道抗菌宿主防御机制[7-8]。过敏原特异性免疫疗法(ASIT)是目前治疗过敏性哮喘的唯一有效方法。然而,尚不清楚采用尘螨疫苗免疫治疗是否影响气道抗菌宿主防御反应。因此,本研究拟建立粉尘螨过敏性哮喘小鼠模型,并采用尘螨疫苗免疫治疗,探讨尘螨疫苗免疫治疗对哮喘小鼠气道上皮细胞β防御素3(MBD-3)表达的调节作用,从而为治疗哮喘提供新思路。
1 材料与方法
1.1材料来源 24只雌性BALB/c小鼠(16~22 g、6~8周龄)购自广东省实验动物中心,饲养于深圳大学医学院无特定病原体(SPF)级动物实验室。所有动物实验都获得了深圳大学动物伦理委员会批准。
1.2试剂与仪器 铜绿假单胞菌由深圳市罗湖区妇幼保健院临床微生物室提供。粉尘螨由深圳大学医学院过敏反应与免疫学研究室提供,于恒湿(相对湿度75%±1%)、恒温(27±0.5)℃培养室中隔离培养。兔抗小鼠MBD-3多克隆抗体购自美国Abcam公司,FTIC标记的羊抗兔IgG二抗购自丹麦Envision公司,RPMI-1640培养液购自美国Sigma公司,SYBR反转录-聚合酶链反应试剂盒购自美国Bio-Rad公司,苏木精-伊红(HE)染液、瑞氏染液和革兰染液购自珠海贝索公司。DM3000LED型荧光显微镜为德国徕卡公司产品,ABI 7500型PCR仪为美国应用生物系统公司产品。MBD-3荧光染色强度分析软件为ImageJ 1.48v。
1.3尘螨疫苗制备 将研钵、匀浆器洗净烘干备用。称取-20 ℃保存的粉尘螨4 g,倒入研钵中,用液氮充分研磨成粉末,转移到匀浆器中,加入5 mL磷酸盐缓冲液(PBS)和适量的蛋白酶抑制剂,冰上操作,充分匀浆2 h,然后4 ℃下搅拌2 h。4 ℃ 12 000 r/min离心5 min,吸取中间层蛋白,避免吸到最上层的脂质和沉淀。再按照上述方法离心2~3次,直到溶液完全澄清。用BCA法测定蛋白浓度,以PBS为稀释液配制成蛋白终浓度为5 g/L的溶液,经0.22 μm的无菌滤膜过滤,以去除杂质和细菌,-80 ℃保存备用。
1.4粉尘螨过敏性哮喘小鼠模型的建立和实验方案 BALB/c小鼠随机分为4组,每组6只,即非哮喘组、非哮喘感染组、哮喘感染组和哮喘感染治疗组。在第0、7和14天,哮喘感染组和哮喘感染治疗组每只小鼠用50 μg尘螨疫苗加2 mg明矾进行腹膜内致敏。从第28天(每2天,总共3次给药)开始,分别用等体积PBS(哮喘感染组)、0.1 g尘螨疫苗(哮喘感染治疗组)对小鼠进行舌下给药。完成最终免疫7 d后,哮喘感染治疗组每天再用50 μg尘螨疫苗对小鼠进行鼻内攻击,持续7 d;采用PBS同样方法处理非哮喘组和非哮喘感染组。用乙醚麻醉非哮喘感染组、哮喘感染组和哮喘感染治疗组小鼠,然后在鼻内感染1×107个菌落的铜绿假单胞菌,非哮喘组小鼠接受等量PBS。24 h后处死小鼠,取支气管肺泡灌洗液(BALF)、肺组织备用。
1.5组织病理学分析和免疫荧光组织化学 室温下将肺组织固定在4%冷甲醛溶液中24 h,石蜡包埋,制备成厚度为5 μm的系列切片。一部分切片用HE染色,光学显微镜检查组织学变化。另一部分切片脱蜡、再水合。用0.3%过氧化氢封闭内源过氧化物酶活性,室温下孵育10 min。用枸橼酸盐(pH=6)在95 ℃水浴中进行抗原回收,持续40 min。将切片与抗MBD-3的兔多克隆抗体(1∶300)在37 ℃孵育45 min,然后再应用FTIC标记的羊抗兔IgG二抗(1∶500)37 ℃孵育45 min。最后,在荧光显微镜下观察荧光强度,采用ImageJ 1.48v软件分析得到相对荧光强度。
1.6瑞氏染色和革兰染色 收集小鼠BALF,4 ℃、400×g离心3 min。除去上清液并加入100 μL PBS以重悬样品。取悬浮液涂片,一部分涂片用瑞氏染液染色,在光学显微镜高倍视野(HP)下计数涂片中炎症细胞的数量。另一部分涂片用革兰染液染色,在光学显微镜油镜视野下计数涂片中革兰阴性杆菌的数量。
1.7细菌的定量 无菌操作将肺组织取出,称重,并在RPMI 1640培养液中匀浆,将悬浮液接种在铜绿假单胞菌选择性平板上,37 ℃孵育24 h后,计数细菌菌落形成单位(CFU)。
1.8MBD-3 mRNA表达水平检测 参照试剂盒说明书,用Trizol试剂从小鼠肺组织中提取总RNA,采用cDNA合成试剂盒制备相应的cDNA。反转录-聚合酶链反应的引物如下:MBD-3,上游引物5′-GCATTTGGCAACTCGTCAG-3′和下游引物5′-TGGAGGCAAAATCTGGTGT-3′;内参照β-肌动蛋白,上游引物5′-CCTGACTGACTACCTCATGAAG-3′和下游引物5′-CGACCATCCTCCTCTCTGATAG-3′。在ABI-7300型PCR仪上采用SYBR绿色聚合酶链反应试剂盒完成反转录聚合酶链反应。反应条件为cDNA合成和变性:45 ℃、40 min, 95 ℃、5 min;PCR扩增:35个循环,94 ℃、30 s,60 ℃、45 s,72 ℃、2 min。熔解曲线法分析验证反应产物,用2-ΔΔCt法计算MBD-3对β-肌动蛋白的相对mRNA水平。
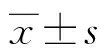
2 结 果
2.14组小鼠肺部炎症比较 4组小鼠肺组织HE染色显示哮喘感染治疗组小鼠肺部中性粒细胞浸润比哮喘感染组小鼠轻,见图1A。BALF沉渣瑞氏染色涂片的中性粒细胞计数比较,哮喘感染组高于哮喘感染治疗组(q=107.334,P<0.05)、非哮喘感染组(q=143.112,P<0.05)和非哮喘组(q=250.447,P<0.05),哮喘感染治疗组高于非哮喘感染组(q=35.778,P<0.05)和非哮喘组(q=143.113,P<0.05),非哮喘感染组高于非哮喘组(q=107.334,P<0.05),见图1B、C。
2.24组小鼠肺组织匀浆及BALF中细菌载量比较 小鼠肺组织匀浆培养,显示哮喘感染组细菌菌落数高于非哮喘感染组(q=1 252.234,P<0.05)和哮喘感染治疗组(q=1 010.732,P<0.05),哮喘感染治疗组高于非哮喘感染组(q=241.502,P<0.05),非哮喘组小鼠肺组织匀浆培养后细菌菌落数为0,见图2A、B。小鼠BALF沉渣涂片进行革兰染色,哮喘感染组细菌菌落数高于非哮喘感染组(q=250.447,P<0.05)和哮喘感染治疗组(q=205.724,P<0.05),哮喘感染治疗组高于非哮喘感染组(q=44.723,P<0.05),非哮喘组BALF沉渣细菌数为0,见图2C、D。

注:A为小鼠气道和肺组织切片HE染色(×200);B为BALF离心沉淀,沉渣涂片,瑞氏染色(×400);C为每HP平均细胞计数(个/高倍视野)。哮喘感染组与非哮喘感染组、哮喘感染组与哮喘感染治疗组、哮喘感染治疗组与非哮喘感染组比较,*#△P<0.05。

注:A为4组小鼠肺组织匀浆在铜绿假单胞菌选择性血琼脂平板上培养后形成的细菌菌落;B为4组小鼠BALF沉渣涂片的革兰染色结果,箭头所示为铜绿假单胞菌;C为4组小鼠肺组织匀浆培养细菌菌落计数结果;D为4组小鼠BALF细菌菌落数计数结果。哮喘感染组与非哮喘感染组、哮喘感染组与哮喘感染治疗组、哮喘感染治疗组与非哮喘感染组比较,*#△P<0.05。
2.34组MBD-3表达水平比较 结果显示,非哮喘感染组和哮喘感染治疗组MBD-3均高表达,两组的MBD-3表达水平差异无统计学意义(q=1.789,P>0.05);哮喘感染组MBD-3的表达水平低于非哮喘感染组(q=60.823,P<0.05)和哮喘感染治疗组(q=59.034,P<0.05),见图3A、B。4组MBD-3的mRNA水平比较,哮喘感染组低于非哮喘感染组(q=28.623,P<0.05)和哮喘感染治疗组(q=26.834,P<0.05),哮喘感染治疗组和非哮喘感染组比较差异无统计学意义(q=1.789,P>0.05),见图3C。
3 讨 论
过敏性哮喘是我国常见的一种复杂的慢性炎症性气道疾病。气道总是暴露在微生物环境中,气道感染是最常见的疾病。以往研究表明,过敏性气道炎症能抑制气道抗菌宿主防御反应,同时,气道感染和细菌定植在难治性哮喘中发挥重要作用[9]。铜绿假单胞菌感染是慢性肺部感染的危险因素,也是患者肺部感染发病率和病死率的主要决定因素[10]。
ASIT是世界卫生组织认可的治疗过敏性哮喘的唯一有效方法[11]。其中调节性T细胞(Treg)是哮喘患者ASIT的重要免疫调节细胞,Treg数量不足和(或)功能低下是发生尘螨过敏性哮喘的重要因素。Treg能够直接抑制Th2反应和肥大细胞、嗜碱性粒细胞、粒细胞和嗜酸性粒细胞的活化。采用尘螨疫苗免疫治疗的ASIT可抑制加重的Th2型免疫反应,并上调Treg的数量和功能,从而减轻或缓解哮喘的严重程度[12]。然而,尘螨疫苗免疫治疗能否影响哮喘患者的抗微生物宿主防御反应仍不清楚。本研究发现,铜绿假单胞菌感染哮喘小鼠的肺部炎症明显比铜绿假单胞菌感染正常小鼠严重,其细菌载量也显著高于铜绿假单胞菌感染正常小鼠。然而,采用尘螨疫苗免疫治疗时,铜绿假单胞菌感染哮喘小鼠的肺部炎症明显减轻,并且铜绿假单胞菌载量显著降低。因此,本研究结果提示,铜绿假单胞菌感染加重了哮喘小鼠的肺部炎症,而尘螨疫苗免疫治疗能够增强哮喘小鼠的抗微生物宿主防御反应。
先天性免疫是机体发育和进化过程中形成的自然免疫防御系统,是宿主抵御微生物入侵的第一道防线,由固有免疫屏障、固有免疫细胞和固有免疫分子组成[13]。AMP是重要的固有免疫分子,具有广谱杀菌作用,包括防御素和cathelicidins两大主要的AMP家族。防御素是一个重要的内源性AMP家族,能够快速、非特异性地杀死入侵的病原体[14]。作为先天性免疫的多功能效应分子,防御素是固有免疫系统的关键成分,在体外可杀死或抑制细菌、真菌和包膜病毒等大多数微生物[15]。人β防御素2(HBD-2)是气道先天性免疫的主要成分,是第一个由炎症和细胞因子诱导表达的人防御素。HBD-2在皮肤、黏膜和气道黏膜的抗感染免疫中起重要作用[16]。本研究发现,哮喘感染组小鼠MBD-3(HBD-2的同源物)的表达水平显著低于非哮喘感染组小鼠;在接受尘螨疫苗免疫治疗后,哮喘感染组小鼠MBD-3的表达上调,与非哮喘感染组小鼠比较差异无统计学意义。因此,本研究结果提示,铜绿假单胞菌感染能抑制哮喘MBD-3的表达,而尘螨疫苗免疫治疗能够上调哮喘小鼠气道中被抑制的MBD-3的表达。
4 结 论
本研究表明,尘螨疫苗免疫治疗可能通过上调MBD-3的表达,来降低哮喘小鼠气道铜绿假单胞菌感染的严重程度;这些发现提示,除上调宿主特异性免疫应答外,尘螨疫苗免疫治疗还可能增强哮喘小鼠气道抗菌宿主防御反应。
